一 : 76大头平胸龟体色观察
?16? 动物学杂志 ChineseJournalofZoology200035(1)
原因尚不清楚,也许是由于除草剂之间发生了
反应,从而导致遗传毒性降低。参 考 文 献
[1] 楼允东,吴 萍.亚硝基胍对泥鳅红细胞微核及核异常
[3] 王蕊芳,贺维顺,吴世芳等.昆明水源水和自来水水质致
突变性及化学背景值Ⅱ.蝌蚪红细胞微核和CHO细胞染色体畸变及SCE试验.动物学研究,1996,17(4):
469~475.
[4] 陈军建,夏宜 .青蛙蝌蚪微核试验———一种水体诱变
剂检测系统的建立.水生生物学报,17(4):298~
308.
[5],,的诱发.中国环境科学,1996,16(4):275~278.
[2] 贺维顺,王蕊芳.污水和污水土地处理系统中各种水质
对华西蟾蜍蝌蚪红细胞微核率的影响.动物学研究,
1992,13(3):275~279.
突变,
):4EandNuclearAnomalies
EofBufobufogargarizans
GENGDe2Gui ZHANGDa2Sheng CHENGWei CHENGang WENHong2Yu
(DepartmentofBiology,XuzhouNormalUniversityXuzhou221009,China)
Abstract:Effectsoffourherbicides:JingKeCaoXing,BenHuangLong,STARANE2andYiCaoAn,onmicronucleiandnuclearanomaliesintadpoleerythrocytesofBufobufogargarizanswerestud2ied.Theresultsshowedthatanyoneoffourherbicidestreatingalonecanincreasethefrequenciesofmicronucleiandnuclearanomalies.Thefrequenciesofthedamageditemsweresignificantlydifferentincomparisonwithcontrolgroupatcertainherbicideconcentrations.Therearenotsignificantcorrelationbetweemicronucleiandconcentrations.Fourherbicidestreatingtogethercandecreasethefrequenciesofthedamageditems.AllresultssuggestedthatfourherbicidescancausesignificantgeneticdamagestotheerythrocytesofBufobufogargarizans.WefoundoutthatgenotoxiceffectofSTARANE2ishigherthantheotherthreeherbicides.
Keywords:Herbicide;Bufobufogargarizans;Tadpole;Microncleus;Nuclearanomalies
大头平胸龟体色、体形随年龄变化的初步观察
唐伯平3 周开亚
(南京师范大学生物系 南京 210097)
宋大祥
(河北大学生物系 保定 071002)
摘要:通过野外采集和室内饲养发现1、2、3、4、5龄的大头平胸龟体形、体色在不同的年龄段各不相同。一般要在5龄后才完全定型。该文报道了大头平胸龟的颜色、眉纹、后缘盾凹刻、肋盾突起以及股后及肛侧锥状鳞的变化规律。并指出,在标本鉴定中,上述特征的引用,应注意年龄的影响。关键词:大头平胸龟;体形;体色;年龄变化
中图分类法:Q95919 文献标识码:A 文章编号:025023263(2000)01216203
第一作者介绍:唐伯平,男,33岁,博士; 收稿日期:1997
211225,修回日期:1999206204
200035(1)动物学杂志 ChineseJournalofZoology
?17?
大头平胸龟(Platysternon
megacephalum)隶属鳄龟科(Chelydridae),我国仅1属1种,分布于东洋界[1,2]。该龟生活在山溪中,能爬到树上或者岩壁上觅食。食虾、螺、鱼、蠕虫等。头大、颈短、喙具鹰嘴状钩曲[3]。曾于1994年5月在江苏省宜兴龙池山同一山溪中,采到1、2、4龄的大头平胸龟3只,并对此进行了1年
腹甲橘红色,具“丰”字形黑斑(图2)。下
缘盾黑色。颈盾、前3枚缘盾和后5枚缘盾的腹面都为深浅不一的橘红色,其中以颈盾和臀盾的颜色最深。四肢及尾黑色。尾较光滑。在
的人工饲养。文内所列各龟年龄的推算采用目前龟年龄鉴定的常用方法进行的年轮多少来推测1龄幼龟,背甲及头颈的背面呈橄榄绿。头颈腹面呈橘红色,但在头颈相连处有一个十分醒目的三角形黑斑,其三角形尖头指向头部。在眼后具一黄色长条状眉纹。其长度从眼后一直延伸至颈部(图1),喙的鹰嘴状钩突不明显。
图2 大头平胸龟幼龟(1龄)腹甲腹面
015)观示“丰”字形黑斑(比例尺:1∶
泄殖腔孔附近有少数淡橘红色刺状鳞片,绝大部分鳞片为黑色。后6枚相邻缘盾之间具凹刻,其中以两臀盾之间的凹刻为最深,约为两臀盾接缝之长。椎盾上具一明显高出椎盾的纵脊。每一肋盾的中央各具一较小的“1”字形突起,并以最后1枚肋盾上的“1”字形突起最少(图3)。随着龟龄的增长,龟体的长大,其体色和体形发生一系列的变化(表1)。
图1 大头平胸龟幼龟(1龄)头部侧面观示眉纹
(比例尺:1∶0127) 11眉纹 21颈部
三角形黑斑 31打点为橘红色
表1 大头平胸龟体色、体形与年龄的关系
特征
1
2
3
4
5
年龄
背面颜色
腹面颜色腹面“丰”字形黑斑
眉纹后缘盾凹刻肋盾突起股后及肛侧锥状鳞橄榄橘红黑色黄色深明显几乎没有淡绿浅红浅黑浅黄浅不太明显少灰褐淡黄深灰淡黄浅凹
第四枚消失,其余退化
明显灰褐黄褐界限不清消失近平滑消失较大灰褐黄褐消失消失平滑消失大
?18? 动物学杂志 ChineseJournalofZoology200035(1)
在颜色变化中,不同部位同一颜色的变化
几乎是同步的。大头平胸龟从幼体到成体,其颜色、体形变化较大,因此在引用这些特征时,要考虑到年龄因素。至于其他变化的生物学意
义还有待进一步探讨。
刘 ;邹寿昌,在此深表谢忱。参 考 文 献
[1] 张孟闻,宗 愉,马积藩.中国动物志?爬行纲(第一卷).
北京:科学出版社,1998.85~90.
[2] 杨安峰.脊椎动物学(第二版).北京:北京大学出版社,
1992.147~167.
[3] 胡淑琴,赵尔宓.中国动物学图谱?两栖类2爬行类(第二
图3 大头平胸龟(1龄)背面观示椎盾、
014)肋盾和缘盾(比例尺:1∶
版).北京:科学出版社,1987.28~34.
几种腹蛇12SrRNA和Cytb基因片段
3
序列的初步研究
沈 曦 周开亚
王义权
(南京师范大学生命科学学院遗传资源研究所 南京 210097)
摘要:首次对我国几种腹属蛇类的12SrRNA和Cytb基因的部分序列进行了测定。12SrRNA基因片段序列结果揭示:中介蝮有较大的种下分化。本文为蝮属蛇类的分子系统学研究提供了一些资料。关键词:蝮蛇;12SrRNA;Cytb
中图分类号:Q95812 文献标识码:A 文章编号:025023263(2000)01218204
蝮属(Agkistrodon)是高度分化的蛇类。
对我国的蝮属蛇类,除形态学性状外,已应用了核型、蛋白质电泳、DNA复性动力学[1]等技术进行过研究。作者曾应用随机扩增多态性DNA(RAPD)技术,根据基因组DNA的差异,对其系统发生和分类进行了探讨[2]。迄今尚无对我国蝮属蛇类线粒体DNA的核苷酸序列进行测定和分析的报道。下面简介几种蝮蛇
12SrRNA和Cytb基因序列的初步研究结果。
1 材料与方法
111 实验材料
3国家自然科学基金项目 No.39470098; 第一作者介绍:沈 曦,男,26岁,硕士; 收稿日期:1998205226,修回日期:1999210218
二 : 果蝇唾腺染色体的观察
实验5、果蝇唾腺染色体的观察
一、实验目的
1. 练习取出果蝇等幼虫唾腺的技术和制作唾腺染色体标本的方法。
2. 根据唾腺染色体上带纹的形态和排列识别不同的染色体,进一步研究和鉴别果蝇染色体结构变异的方法。
二、果蝇唾腺染色体的有关知识
1.发现
1881年,意大利的细胞学家巴尔比尼(Balbiani)在双翅目昆虫摇蚊幼虫的唾腺细胞间期核中发现了一种巨大的染色体,由于存在于唾腺细胞中,所以又称为唾腺染色体。1933年,美国学者贝恩特(Painter)等又在果蝇核其它双翅目昆虫的幼虫唾腺细胞间期核中发现了巨大染色体。这种染色体宽约5μm,长400μm,相当于普通染色体的100-150倍,因而又称为巨大染色体。
2.原因
(1)染色体螺旋化程度不高。
(2)果蝇幼虫的唾腺细胞在发育过程中,细胞核内的DNA多次复制,但细胞、细胞核不分裂,复制后的染色单体DNA也不分开,形成了多线染色体。
(3)同源染色体相互靠拢在一起呈现一种联会状态,使其比一般的体细胞染色体粗大。
3.基本概念
核内有丝分裂:不伴随核分裂和细胞分裂的染色体分裂。
核内复制;不伴随细胞内核分裂的染色体复制现象。
体联会:唾腺细胞中的染色体复制后,所有同源染色体一直处于紧密配对的前期状态,如同减数分裂的联会,这种现象称为体联会。
4.果蝇的染色体组成
由于在唾腺细胞中8条染色体之间以着丝粒相互连结在一起形成染色盘或异染中心和同源染色体之间的假联会,经碱性染料染色后,可以观察到一个染色较深的染色盘和以染色盘为中心向外辐射出的5条染色体臂。在这些染色体臂上可以看到染色深浅不同,被称为明带和暗带的横纹,这些横纹的位置、宽窄、数目都具有物种的特异性,不同物种,不同染色体的不同部位形态和位置是固定的,因此根据染色体各条臂带纹特征和各条臂端部带纹的特征能准确识别各条染色体。在染色体臂上还可看到某些带纹通过染色体的界旋、膨大形成的疏松区和巴尔比尼环,其富含转录出来的RNA ,因此不着色,是基因活动的区域。在个体发育的不同阶段,疏松区或巴尔比尼环在染色体上出现的部位不同,因此可以研
究基因的表达,开展各种染色体变异的研究等等。
果蝇共有4对染色体。其中一对为性染色体(XY或XX),XX染色体为顶端着丝粒染色体,呈杆状,Y染色体为“J”形;第二对、第三对染色体均为中央着丝粒染色体,呈“V”形;第四对染色体短小,为顶端着丝粒染色体,呈点状,附在染色盘边缘。由于唾腺染色体的假联会,X染色体的一端在异染中心上,另一端游离;而第二对、第三对染色体着丝粒在中央,可以从异染中心呈“V”字形向外伸展出四条臂(2L、2R、3L、3R),Y染色体着丝粒附近的异染色质参与了染色中心的形成,所以理想的片子,不管雌雄果蝇的唾腺细胞在显微镜下均可见五条长臂(X、2L、2R、3L、3R)和一条短臂(第四条染色体臂不易观察)。雄果蝇唾腺细胞中的X染色体臂比雌果蝇的稍细。在染色体臂上可观察到许多明暗相间的带。
(1)果蝇染色体有102个区,每个区又有A—F六个亚区,每个亚区又有1,2,3……等亚亚区。
(2)疏松区有许多灯刷状物质(灯刷染色体)
(3)唾腺染色体的末端有不同的特征,可以借此来鉴别各条染色体。
5.特点
(1)巨大;
(2)体联会现象决定了染色体只有半数;
(3)各个染色体中异染色质多的着丝粒部分相互靠拢形成染色中心;
(4)横纹有深浅、数目、疏密的不同,各自对应排列,这意味着基因的排列,具有种的特异性。
(5)多线染色体(与中期高度螺旋的染色体相区别)若有缺失、易位、倒位、重复等现象,很容易在唾腺染色体上识别出来。
三、幼虫的培养
发育充足、肥大的三龄幼虫,唾腺和唾腺细胞发育良好。利用这样的唾腺细胞才能制备出理想的染色体玻片标本。因此要求培养基营养丰富,含水量较高,比较松软,发酵良好。
将果蝇放入培养瓶中(果蝇不应过多,半磅牛奶瓶10对左右)于15-18℃的稍低温度条件下培养,接种12小时后,将成虫移出,控制成虫的排卵持续时间,以免产生过多的卵(要求每cm2培养基表面20-40只幼虫),一龄幼虫出现后,每天在培养基表面滴加2-4.5%的酵母液或鲜酵母。2-3龄幼虫应滴加10%左右的酵母液,滴加的量以覆盖在培养基表面薄薄一层为宜。待三龄幼虫大量爬出培养基时,也可将培养瓶移至3-5℃冰箱中进行低温处理,不让其化蛹。这样的幼虫活动慢,易解剖出唾腺,而且可以获得染色体分散良好的制片。
四、实验步骤
1.剥离唾腺: 在一干净的载玻片上滴一滴生理盐水,选择行动迟缓、肥大、爬在瓶壁上即将化蛹的三龄幼虫,或者选择经低温处理的果蝇三龄幼虫置于载玻片上。每只手各持一个解剖针,在解剖镜下进行操作。由于果蝇的唾腺位于幼虫体前1/3-1/4处,所以左手持解剖针按压住虫体后端三分之一的部位,固定幼虫,右手持解剖针扎住幼虫头部口器部位,适当用力向右拉唾腺腺体随之而出。唾腺是一对透明的棒状腺体,外有白色的脂肪组织(不透明)。去除幼虫其它组织部分,并把唾腺周围的白色脂肪剥离干净。
2.解离: 在唾腺组织上滴一滴1NHCl,解离1-2min ,以松软组织,利于染色体的分散。
3.染色: 吸去 HCl,用水冲洗2-3次后滴加醋酸洋红染液染色10min。
4.压片: 染色完成后,盖上干净的盖片,并覆一层滤纸。将片子放在实验台上,用大拇指用力压住,并横向揉几次。(注意不要使盖片移动,用力和揉动是一个方向,不能来回揉。)
5.镜检:
流程:解剖唾腺→转到载玻片上→加1N Hcl酸解1min →吸去HCl→水洗→醋酸洋红染色10min →盖片、压片→镜检
五、注意事项
1.一定加生理盐水,否则唾腺易干。
2.将脂肪组织清除干净。
3.水不可太多,否则幼虫会漂浮而且活跃。
4.染色时间不可过长,否则背景也着色。
5.压片时要揉。
6.染色完以后,将旧的染色液吸去,加新的染色液,再压片。 所需药品及材料
三龄幼虫 0.7%生理盐水 1NHCl 碱性品红 解剖镜 解剖针 吸水纸
三 : 果蝇唾液腺染色体标本的制备与观察
果蝇唾液腺染色体的制备与观察
微生物技术班 潘红芳 2011/10/11
摘要:本论文以果蝇三龄幼虫为实验材料,通过解剖分离出其唾液腺,制备染色体标本,在显微镜下观察果蝇唾腺染色体的形态特征,寻找形态良好分散适中的图像仔细观察,并根据唾腺染色体上横纹的形态和排列,识别不同的染色体。(www.61k.com]我观察到5条染色体臂,它们从染色中心以V字形向外伸出,由于短小的第4染色体有时不易现察到,所以我只识别了5条染色体长臂。根据染色体臂末端横纹及形态特征,我识别出了两条臂,X及3R。
前言: 双翅目昆虫(摇蚊、果蝇等)幼虫期的唾腺细胞很大,其中的染色体称为唾腺染色体。这种染色体比普通染色体大得多,宽约5um,长约400um,相当于普通染色体的100—150倍,因而又称为巨大染色体。唾腺染色体处于体细胞染色体联会配对状态。并且唾腺染色体经过多次复制而并不分开,每条染色体大约有1000—4000根染色体丝的拷贝,所以又称多线染色体。多线染色体经染色后,出现深浅不同、密疏各别的横纹,这些横纹的数目和位置往往是恒定的,代表着果蝇等昆虫的种的特征;如染色体有缺失、重复、倒位.易位等,很容易在唾腺染色体上识别出来。各染色体的异染色质的着丝粒部分互相靠拢形成染色中心(chromocenter);横纹有深浅、疏密的不同,各自对应排列,这意味着基因的排列。唾腺染色体广泛应用于细胞遗传学、发生遗传学、进化遗传学及分子遗传学的研究中。 实验材料:
仪器用具:显微镜,果蝇培养瓶,镊子,解剖针,毛笔,载玻片,盖玻片,吸水纸等 药品试剂:生理盐水、盐酸、蒸馏水、改良苯酚品红染色液等
培养基:玉米琼脂培养基
实验材料:果蝇三龄幼虫
实验方法:
1. 剥离唾腺:
在一干净的载玻片上滴一滴生理盐水,选择行动迟缓、肥大、爬在瓶壁上即将化蛹的三龄幼虫,或者选择经低温处理的果蝇三龄幼虫置于载玻片上。每只手各持一个解剖针,在解剖镜下进行操作。由于果蝇的唾腺位于幼虫体前1/3-1/4处,所以左手持解剖针按压住虫体前端三分之一的部位,固定幼虫,右手持解剖针扎住幼虫头部口器部位,适当用力向右拉唾腺腺体随之而出。如图。
2. 解离:在唾腺组织上滴一滴1NHCl,解离1-2min ,以松软组织,利于染色体的分散。
3. 吸去 HCl,用水冲洗2-3次.
4. 染色:滴加改良苯酚品红染液染色10min,染色时间不可过长,否则背景也着色。
5. 压片:染色完成后,盖上干净的盖片,并覆一层滤纸。将片子放在实验台上,用大拇指用力压住,并横向揉几次。(注意不要使盖片移动,用力和揉动是一个方向,不能来回揉。)
6. 镜检:先用低倍镜进行观察,找到分散好的染色体再转用高倍镜进行观察。
果蝇唾腺染色体 果蝇唾液腺染色体标本的制备与观察

实验结果及分析:
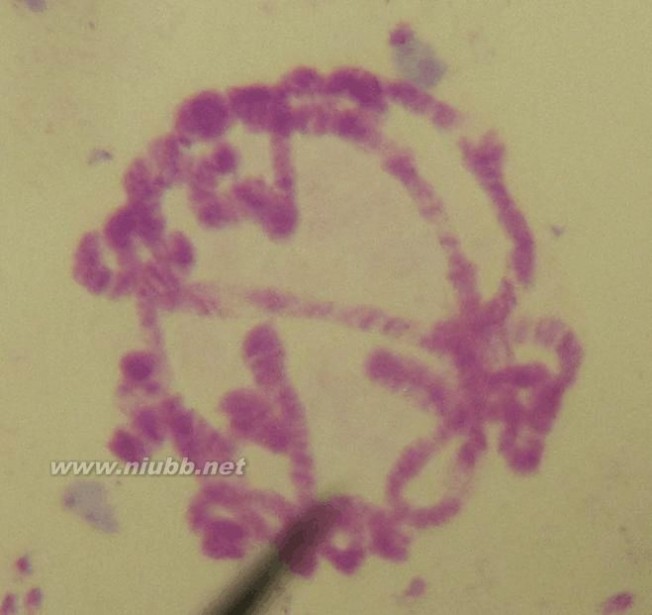


图1

1 如图

1箭头所示,确定染色中心后,可以分辨出有5条长臂与染色中心相连。(www.61k.com]由于染色体展开不成功,且4染色体臂很短,故没有观察到4染色体。我共找到了四个染色体臂的末端,但根据唾液染色体各条臂末端的形态特征,只确定了两条臂的末端,分别是X,3R。
2 由图可见,X染色体臂末端有一个永久性的蓬突,虽然X染色体臂发生了弯折,但仍可辨别;虽然该染色体臂与2L臂末端有所相似,(2L臂是在末端尾处也可能存在颜色浅的蓬松),但是由课本67页图可确定,2L臂末端挨着末端蓬松处的臂有明显的横纹,颜色应该较深,但是图1中靠近蓬松处的染色体臂颜色较浅,故可判定为X臂,而不是2L臂。
3 之所以判定3R臂,主要是因为3R臂末端有几条横纹,如果染色时间过长的话,很可能将数条横纹染成一条较粗的“横纹带”,即如图中标定3R的臂的末端有一条很粗的颜色很深的“带”。
4 红色箭头所指处,不是染色体臂末端,应是染色体臂蓬松处受损断裂而成,故虽然该断裂处附近有一小型蓬突,也排除了它是2R染色体臂的可能。
5 另外两条臂末端无法辨别。
果蝇唾腺染色体 果蝇唾液腺染色体标本的制备与观察
6 此标本压片不成功,染色体臂没有完全展开,各染色体臂交缠在一起,无法清楚判定各臂。[www.61k.com]但尚能确定由染色中心伸出了5条长臂;断臂无法准确判断。再者,此标本染色时间过长,本该染色浅的部分着色也很深,无法清晰辨别横纹。
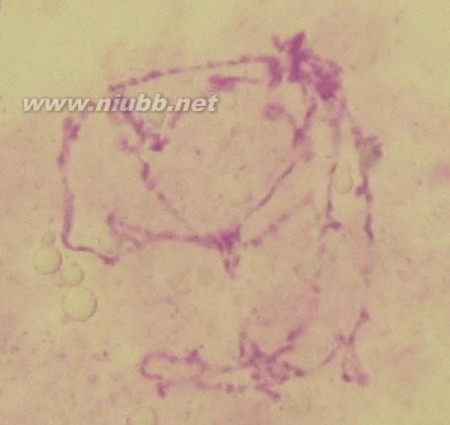
图2
此片制备较为成功,能清楚的观察到染色中心和5条长臂及1条断臂;但选择的幼虫为三龄前期或者是二龄幼虫,故染色体臂较细,不易观察横纹。我推测,由于处于三龄前期或二龄幼虫期,染色体复制后螺旋化程度尚低,或DNA复制尚未达到9次,故致使形成的染色体臂较细。
实验小结:
1 一定要加生理盐水,否则唾液腺容易干,影响其正常形态,进而影响观察。但生理盐水不可加太多,否则幼虫会漂浮而且活跃。如水多了,请再剥离唾腺前吸走些,唾腺剥离后请勿吸水,以防将唾腺一起吸走。
2. 清除脂肪组织时要量力而行;在实验中,我发现如果严格按照实验步骤所写剥离唾液腺,撕裂后唾液腺将与脂肪分离,得到较干净的唾液腺,很少脂肪干扰。我多次剥离,每次都很成功,几乎没有脂肪。如果脂肪真的很难去除,则可用解剖针截取一部分没有脂肪的唾液腺细胞,不必一定要完整的唾液腺。
4. 染色液勿过多,否则压片时唾腺易随染色液漂走。如染色时间到后,染色液已干,应再少加些染色液,再盖上盖波片,避免气泡产生。
5. 染色时间不要太长,否则背景会着色,影响观察效果。
6. 用吸水纸吸取液体时,一定要注意不要将唾液腺吸走。实验中,我缓缓倾斜载玻片,让载玻片上的液体慢慢流下,而唾液腺粘在载玻片上游,用吸水纸在下游轻轻吸取溶液。向唾液腺组织滴加染液或蒸馏水时,如果滴管口距离载玻片太近,滴下液体时,由于水的表面张力作用,唾液腺会被水带到滴管口上。我曾经两次将唾液腺细胞粘到滴管口上,后来总结出经验,将滴管口离载玻片稍远一些,不至于将唾液腺吸走,也不至于液滴滴下时将唾液腺溅走。
7. 我经过多次实验,发现压片前先轻敲,使染色体分散,压片时再朝一个方向揉片,这种方法效果比较理想。
8. 本次实验难度较大,但是孰能生巧;我操作了十次之后,终于比较熟练,掌握了制片的技巧,最终获得了较为理想的标本。

四 : 果蝇唾腺染色体的观察
实验5、果蝇唾腺染色体的观察
一、实验目的
1. 练习取出果蝇等幼虫唾腺的技术和制作唾腺染色体标本的方法。(www.61k.com]
2. 根据唾腺染色体上带纹的形态和排列识别不同的染色体,进一步研究和鉴别果蝇染色体结构变异的方法。
二、果蝇唾腺染色体的有关知识
1.发现
1881年,意大利的细胞学家巴尔比尼(Balbiani)在双翅目昆虫摇蚊幼虫的唾腺细胞间期核中发现了一种巨大的染色体,由于存在于唾腺细胞中,所以又称为唾腺染色体。1933年,美国学者贝恩特(Painter)等又在果蝇核其它双翅目昆虫的幼虫唾腺细胞间期核中发现了巨大染色体。这种染色体宽约5μm,长400μm,相当于普通染色体的100-150倍,因而又称为巨大染色体。
2.原因
(1)染色体螺旋化程度不高。
(2)果蝇幼虫的唾腺细胞在发育过程中,细胞核内的DNA多次复制,但细胞、细胞核不分裂,复制后的染色单体DNA也不分开,形成了多线染色体。
(3)同源染色体相互靠拢在一起呈现一种联会状态,使其比一般的体细胞染色体粗大。
3.基本概念
核内有丝分裂:不伴随核分裂和细胞分裂的染色体分裂。
核内复制;不伴随细胞内核分裂的染色体复制现象。
体联会:唾腺细胞中的染色体复制后,所有同源染色体一直处于紧密配对的前期状态,如同减数分裂的联会,这种现象称为体联会。
4.果蝇的染色体组成
由于在唾腺细胞中8条染色体之间以着丝粒相互连结在一起形成染色盘或异染中心和同源染色体之间的假联会,经碱性染料染色后,可以观察到一个染色较深的染色盘和以染色盘为中心向外辐射出的5条染色体臂。在这些染色体臂上可以看到染色深浅不同,被称为明带和暗带的横纹,这些横纹的位置、宽窄、数目都具有物种的特异性,不同物种,不同染色体的不同部位形态和位置是固定的,因此根据染色体各条臂带纹特征和各条臂端部带纹的特征能准确识别各条染色体。在染色体臂上还可看到某些带纹通过染色体的界旋、膨大形成的疏松区和巴尔比尼环,其富含转录出来的RNA ,因此不着色,是基因活动的区域。在个体发育的不同阶段,疏松区或巴尔比尼环在染色体上出现的部位不同,因此可以研
果蝇唾腺染色体 果蝇唾腺染色体的观察
究基因的表达,开展各种染色体变异的研究等等。[www.61k.com]
果蝇共有4对染色体。其中一对为性染色体(XY或XX),XX染色体为顶端着丝粒染色体,呈杆状,Y染色体为“J”形;第二对、第三对染色体均为中央着丝粒染色体,呈“V”形;第四对染色体短小,为顶端着丝粒染色体,呈点状,附在染色盘边缘。由于唾腺染色体的假联会,X染色体的一端在异染中心上,另一端游离;而第二对、第三对染色体着丝粒在中央,可以从异染中心呈“V”字形向外伸展出四条臂(2L、2R、3L、3R),Y染色体着丝粒附近的异染色质参与了染色中心的形成,所以理想的片子,不管雌雄果蝇的唾腺细胞在显微镜下均可见五条长臂(X、2L、2R、3L、3R)和一条短臂(第四条染色体臂不易观察)。雄果蝇唾腺细胞中的X染色体臂比雌果蝇的稍细。在染色体臂上可观察到许多明暗相间的带。
(1)果蝇染色体有102个区,每个区又有A—F六个亚区,每个亚区又有1,2,3……等亚亚区。
(2)疏松区有许多灯刷状物质(灯刷染色体)
(3)唾腺染色体的末端有不同的特征,可以借此来鉴别各条染色体。
5.特点
(1)巨大;
(2)体联会现象决定了染色体只有半数;
(3)各个染色体中异染色质多的着丝粒部分相互靠拢形成染色中心;
(4)横纹有深浅、数目、疏密的不同,各自对应排列,这意味着基因的排列,具有种的特异性。
(5)多线染色体(与中期高度螺旋的染色体相区别)若有缺失、易位、倒位、重复等现象,很容易在唾腺染色体上识别出来。
三、幼虫的培养
发育充足、肥大的三龄幼虫,唾腺和唾腺细胞发育良好。利用这样的唾腺细胞才能制备出理想的染色体玻片标本。因此要求培养基营养丰富,含水量较高,比较松软,发酵良好。
将果蝇放入培养瓶中(果蝇不应过多,半磅牛奶瓶10对左右)于15-18℃的稍低温度条件下培养,接种12小时后,将成虫移出,控制成虫的排卵持续时间,以免产生过多的卵(要求每cm2培养基表面20-40只幼虫),一龄幼虫出现后,每天在培养基表面滴加2-4.5%的酵母液或鲜酵母。2-3龄幼虫应滴加10%左右的酵母液,滴加的量以覆盖在培养基表面薄薄一层为宜。待三龄幼虫大量爬出培养基时,也可将培养瓶移至3-5℃冰箱中进行低温处理,不让其化蛹。这样的幼虫活动慢,易解剖出唾腺,而且可以获得染色体分散良好的制片。
果蝇唾腺染色体 果蝇唾腺染色体的观察
四、实验步骤
1.剥离唾腺: 在一干净的载玻片上滴一滴生理盐水,选择行动迟缓、肥大、爬在瓶壁上即将化蛹的三龄幼虫,或者选择经低温处理的果蝇三龄幼虫置于载玻片上。(www.61k.com)每只手各持一个解剖针,在解剖镜下进行操作。由于果蝇的唾腺位于幼虫体前1/3-1/4处,所以左手持解剖针按压住虫体后端三分之一的部位,固定幼虫,右手持解剖针扎住幼虫头部口器部位,适当用力向右拉唾腺腺体随之而出。唾腺是一对透明的棒状腺体,外有白色的脂肪组织(不透明)。去除幼虫其它组织部分,并把唾腺周围的白色脂肪剥离干净。
2.解离: 在唾腺组织上滴一滴1NHCl,解离1-2min ,以松软组织,利于染色体的分散。
3.染色: 吸去 HCl,用水冲洗2-3次后滴加醋酸洋红染液染色10min。
4.压片: 染色完成后,盖上干净的盖片,并覆一层滤纸。将片子放在实验台上,用大拇指用力压住,并横向揉几次。(注意不要使盖片移动,用力和揉动是一个方向,不能来回揉。)
5.镜检:
流程:解剖唾腺→转到载玻片上→加1N Hcl酸解1min →吸去HCl→水洗→醋酸洋红染色10min →盖片、压片→镜检
五、注意事项
1.一定加生理盐水,否则唾腺易干。
2.将脂肪组织清除干净。
3.水不可太多,否则幼虫会漂浮而且活跃。
4.染色时间不可过长,否则背景也着色。
5.压片时要揉。
6.染色完以后,将旧的染色液吸去,加新的染色液,再压片。 所需药品及材料
61阅读提醒您本文地址:
三龄幼虫 0.7%生理盐水 1NHCl 碱性品红 解剖镜 解剖针 吸水纸
61阅读提醒您本文地址:
本文标题:果蝇唾液腺染色体观察-76大头平胸龟体色观察61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1