一 : 乙酸乙酯皂化反应
乙酸乙酯皂化反应
实验目的
1.测定乙酸乙酯皂化反应速率常数,了解反应活化能的测定方法。[www.61k.com)
2.了解二级反应的特点,学会用图解计算法求出二级反应的反应速率常数。 3.熟悉电导仪的使用方法。
实验原理
乙酸乙酯皂化反应是二级反应,反应式为:
CH3COOC2H5+Na++OH-→CH3COO-+Na++C2H5OH
反应的动力学方程为:
dx/dt=k(a-x)(b-x)
若a=b=c,dx/dt=k(c-x)2
积分后的:k=x/(t*c(c-x))
测得不同t时的x值,可由上式计算出不同t时的k值,如果k常数,就可证明反应是二级。作x/(c-x)-t图,若所得的是直线,也就证明反应是二级的,并可从直线的斜率求出k值。
用电导测定x的依据是:
1.假定整个反应是在稀溶液里进行的,可以认为是全部电离的,Na+反应前后浓度不变。OH-的电导率比Ac-大很多,随着反应的进行,溶液的电导率随着下降。
2.在稀溶液中,强电解质的电导率与其浓度成正比,总电导率等于溶液电解质的导电率之和。
L0=A1CNaOH L∞=A2CHAc
Lt=A1(C-x)+A2x
x=C*( L0- Lt)/( L0- L∞)
若乙酸乙酯与NaOH起始浓度相等(a=b)计算公式为:
( L0- Lt)/( Lt- L∞)=Ckt或1/( Lt- L∞)=Ck/( L0- Lt)*t
若乙酸乙酯与NaOH起始浓度不相等(a>b)计算公式为: ln(a*( L0- L∞)-b*( L0- Lt))/a(Lt- L∞)=(a-b)kt
仪器与药品
DJS-308型电导率仪1 台、恒温槽1套、分析天平1台、铂黑电极1只、双
管电导池1支、秒表1支…
新鲜制备的0.0200mol*L-1NaOH ,0.0100 mol*L-1NaAc,0.0100 mol*L-1NaOH,
0.0200mol*L-1CH3COOC2H5。
实验步骤
1.电导率仪的调节
2.溶液的配制
配制0.0100mol*L-1NaAc、0.0100mol*L-1NaOH、0.0200mol*L-1NaOH、
0.0200mol*L-1CH3COOC2H5的溶液。
3. L0和L∞的测量
用0.0100 mol*L-1NaAc装入干净的电导池A管中,液面高出铂黑片1cm为宜。25℃恒温10min,然后接通电导率仪,测定其电导率,即为L∞;测定0.0100 mol*L-1NaOH的电导,便为L0。
测量时每种溶液都必须更换一次,重复测定,同时误差在一定的范围之内。每次电导池都要先用蒸馏水淋洗电导池的铂电极三次,接着用待测液洗三次。
4. Lt的测定
将干燥、洁净的电导池放在恒温槽中夹好,用移液管分别移取25mL0.0200mol*L-1NaOH放入A管,25mL0.0200mol*L-1CH3COOC2H5放入B管。塞好塞子,以防挥发。
将铂电极经电导水冲洗后,用滤纸吸干电极上的水,(不要碰到铂黑),然后将电极插入A管中,恒温10min,打开B管塞子,用吸耳球迅速的将乙酸乙酯压入A管,压入一半时开始计时,反复抽压几次,便可混合均匀。每隔5min读一次数据,共测定1h。
实验结束后,将电极用蒸馏水洗净,插入有蒸馏水的试管中。
乙酸乙酯皂化反应 乙酸乙酯皂化反应
数据处理

-1 -1
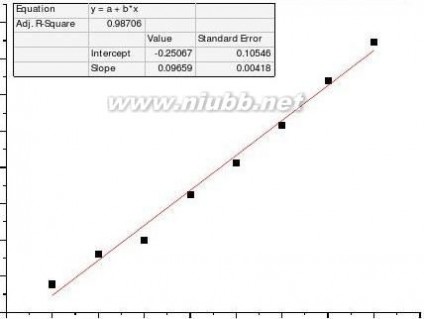
(k0-kt)/(kt-k∞
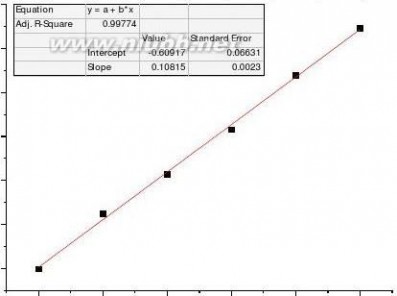
)t/min
乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低,反应速率也偏低,舍去5、10min两点作图。[www.61k.com)
(k0-kt)/(kt-k∞)t/min
速率常数测量值k=5.408dm3*mol-1*min-1 理论值k=6.42 dm3*mol-1*min-1 相对误差Er=-15.77%
乙酸乙酯皂化反应 乙酸乙酯皂化反应
思考题
1.为何本实验要在恒温条件下进行,而且乙酸乙酯和NaOH溶液在混合前还要预先恒温?
因反应速度与温度有关,温度每升高10℃,反应速度约增加2~4倍,同时电导率也与温度有关,所以实验过程中须恒温。(www.61k.com)且NaOH溶液和CH3COOC2H5溶液混合前要预先恒温,以保证反应在实验温度下进行。
2.制备乙酸乙酯溶液时,为什么在容量瓶中要事先加入适量的重蒸馏水?
乙酸乙酯沸点为77.06℃,挥发性强,可明显的问到乙酸乙酯蒸汽的香味,制备乙酸乙酯溶液时,为什么在在容量瓶中要事先加入适量的重蒸馏水,是为了防止滴落的乙酸乙酯,接触瓶底时飞溅,挥发为蒸汽。
3. 为什么乙酸乙酯和NaOH溶液浓度必须足够稀?
只有对稀溶液,强电解质的电导率?与其浓度成正比,才会推倒得到κt~(κ0-κt)/t作图为一直线,进而求得k值。
4.本实验除用电导法测量外,还可以用适用什么方法测量?
求反应速率的方法很多,归纳起来有化学分析法及物理化学分析法两类。化学分析法是在一定时间取出一部分试样,使用骤冷或取去催化剂等方法使反应停止,然后进行分析,直接求出浓度。这种方法虽设备简单,但是时间长,比较麻烦。物理化学分析法有旋光、折光、电导、分光光度等方法,根据不同情况可用不同仪器。这些方法的优点是实验时间短,速度快,可不中断反应,而且还可采用自动化的装置。但是需一定的仪器设备,并只能得出间接的数据,有时往往会因某些杂质的存在而产生较大的误差。
5.若b>a,公式是否适用?实验操作应有哪些变化?
要按k=2.303/t(a-b)log((a-x)/(b-x))或ln(a*( L0- L∞)-b*( L0- Lt))/a(Lt- L∞)=(a-b)kt计算,式中x=((κ0-κt)/( κ0-κ∞))*a(a是为两溶液中浓度较低的一个溶液浓度) 以κt~t作图,可得到κ0和κ∞的值,解出不同t时的x值,然后,就可求出k。
6.实验误差的来源是什么?
乙酸乙酯称量时会挥发;乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低。因此最好在反应4~6分钟后开始测定,否则所得结果呈抛物线形;如NaOH溶液和CH3COOC2H5溶液浓度不等,而所得结果仍用两者浓度相等的公式计算,则作图所得直线也将缺乏线性;温度对速率常数影响较大,需在恒温条件下测定。在水浴温度达到所要的温度后,不急于马上进行测定,须待欲测体系恒温10分钟,否则会因起始时温度的不恒定而使电导偏低或偏高,以致所得直线线性不佳。
实验讨论
1.实验中的注意事项:
本实验需用电导水,并避免接触空气及灰尘杂质落入; 配好的NaOH溶液要防止空气中的CO2气体进入; 乙酸乙酯溶液和NaOH溶液浓度必须相同, 用书中的公式k=(κ0-κt)/(( κ0-κ∞)*t*a) 计算速率常数时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同; 由于CH3COOC2H5在稀溶液中能缓慢水解,会影响CH3COOC2H5的浓度,且水解产物CH3COOH又会消耗NaOH。所以CH3COOC2H5水溶液应在使用时临时配制。,CH3COOC2H5易挥发,故称量时应在称量瓶中准确称取,并需动作迅速; 记录电导率值时,注意单位的换算; 在测定κ0时,所用的蒸馏水最好先煮沸,以除去CO2;测κt时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀; 注意不可用纸擦电导电极上的铂黑。
2. 乙酸乙酯皂化反应机理
脂碱性水解是通过亲核加成-消除机理完成的,OH-先进攻脂羰基碳发生亲核加成,形成四面体中间体,然后消除C2H5O-,这两不反应均是可逆的。由于反应是在碱性条件下进行的,生成的羧酸可以和碱发生中和反应,从而移动了平衡。
3.根据二级反应动力学特点,半衰期t1/2=1/k/a=9.24min,反应进行30min90%的乙酸乙酯已水解、40min是95%、1h后是99%。
4.实验结果与理论值相差很大,可能的原因是由于时间原因,此次实验的溶液是别人配制的,乙酸乙酯和氢氧化钠的浓度是否严格相等不得而知,实验的偶然误差很大,即使实验数据的线性很好,实验结果也会有很大的偏差。
二 : 物理化学实验报告 乙酸乙酯皂化反应60
物理化学实验报告
乙酸乙酯皂化反应动力学
1.目的:
(1)了解二级反应的特点。
(2)用电导法测定乙酸乙酯皂化反应的速率常数。 (3)用不同温度下的反应速率常数求反应的活化能。 2.原理:
乙酸乙酯在碱性水溶液中的水解反应即皂化反应,其反应式为:
CH3COOC2H5+NaOH=CH3COONa+C2H5OH
反应是二级反应,反应速率与乙酸乙酯及氢氧化钠的浓度成正比。用a,b分别表示乙酸乙酯和氢氧化钠的初始浓度,x表示在时间间隔t内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为:
dx
=k a?x b?x K为反应速率常数,当a=b时,上式为:
dx
=k(a?x)2 开始反应时t=0,反应物浓度为a,积分上式时得:
1xk=
在一定温度下,由实验测得不同t时的x值,再由上式可计算出k值。
改变实验温度,求不同温度下的k值,根据Arrhenius方程的不定积分式有: Ea
+C 以lnk对1/T作图,得一直线,从直线斜率可求的Ea。
lnk=?
若对热力学温度T1,T2时的反应速率常数k1,k2,也可由Arrhenius方程的定积分式变化得Ea值:
k111
Ea=(Rln)/(?)
221本实验通过测量溶液的电导率k代替测量生成物的浓度x。乙酸乙酯,乙醇是非电解质。在稀溶液中,强电解质电导率与浓度成正比,溶液的电导率是各离子电导率之和。反应前后Na离子浓度不变,整个反应过程电导率的变化取决于OH?根离子与CH3COO?浓度的变化,溶液中的OH?导电能力约为CH3COO?的五倍,随着反应的进行,OH?浓度降低,CH3COO? 浓度升高,溶液导电能力下降。
一定温度下,在稀溶液中反应,k0,kt,k∞为溶液在t=0,t=t,t=∞时的电导率,A1,A2分别是与NaOH,CH3COONa电导率有关的比例常数(与温度,溶剂有关)。于是:
t=0,k0=A1a;
t=t,kt=A1 a?x +A2x
t=∞,k∞=A2a;
由此可得:k0? kt=(A1?A2)x x=(k0?,kt)/(A1?A2) kt?k∞= A1?A2 a?x a?x =(kt?k∞)/(A1?A2)
则可以得到:kat=k0?ktt
∞
k?k
以k0?ktt作图,由斜率ka可求得k。初始浓度a为实验中配制溶液时确定,通过实验
t
∞
k?k
可测得k0,kt,k∞。
通过公式变形避免测定k∞,则式为:
kt=
以kt对
(k0?kt)
t
k0?kt
+k∞ 1
作图为一条直线,斜率为由此可求k.
ka
3.实验仪器
恒温槽 电导率仪 电导电极 叉形电导池 秒表 滴定管
移液管 容量瓶(50ml,100ml) 乙酸乙酯 NaOH溶液 4.实验步骤
(1)调节超级恒温槽至25摄氏度。
(2)配制100ml浓度约为0.02mol/L的乙酸乙酯溶液。
所需乙酸乙酯的量约为0.1762g。首先在洁净的100ml容量瓶中加入少量去离子水,用分析天平称量加入的乙酸乙酯的量。加入的乙酸乙酯的量应该尽量小于0.1762g。事先加入少量水是为了防止乙酸乙酯挥发。在称量之后计算出乙酸乙酯的准确浓度。 (3)配制100ml等浓度的NaOH溶液,浓度以乙酸乙酯实际浓度为准,计算需要加入NaOH溶液的体积。
(4)测定k0:用移液管取与乙酸乙酯浓度相同的NaOH溶液25ml,加入到洁净的50ml容量瓶中,用去离子水稀释至刻度,用于测量k0。取一定量的溶液于叉形电导池直支管中,用部分溶液淋洗电极,将电极放入叉形电导池的直支管中,溶液应能将电极没过。将叉形电导池放入恒温槽中10min以后,读取记录电导率值。保留此叉形电导池中的溶液,用于后面35摄氏度时的k0。
(5)kt的测量:用移液管取所配制的乙酸乙酯溶液10ml,将加入到洁净干燥的叉形电导池的直支管中,取浓度相同的NaOH溶液10ml,加入到同一叉形电导池的支管中,注意此两种溶液不能互相污染。将此电导电极放入直支管中,再将此电导池放入恒温槽恒温。10min后,将这两种溶液混合均匀,溶液应能将电极完全淹没,同时启动计时器,每三分钟读一次数,持续30min.
(6)调节恒温槽至35摄氏度。
(7)同样按照上述步骤测量在35摄氏度时的k0,kt。 (8)在实验后将电导电极浸入去离子水中。
初始浓度a=0.02045mol/L 25℃ k0=2000μs 35℃ k0=1976μs
数据图像
25℃ kt?t图像
2000
1800
1600
kt
140012001000
051015202530
t/min
35℃ kt?t图像
1700160015001400
kt
1300120011001000900
5
10
15
20
25
30
t/min
25℃ kt?
k?kt
kt
(k_0-k_t)/t
直线斜率为14.85678 k=3.291
35℃ kt?
k?kt
图像
kt
(k_0-k_t)/t
直线斜率:4.77267 k=10.25
Ea=(Rln
k111)/(?) 221
=8.314J/mol*k *ln0.3211/(-0.00010884) =86.776KJ/mol
6.思考题
(1)在本实验中,使用的电导率仪测定溶液的电导率,可以不进行电极常数的校正,为什么? 由于我们所使用的数据是k0?kt,即使在测量时存在一定的误差,但是想减之后误差就没有了,所以可以不用校正。 (2)为什么溶液浓度要足够小 因为只有在稀溶液中,溶液的电导率才与浓度呈正比,进而可以通过测量电导率求出平衡常数。
(3)利用反应物,产物的某种物理性质间接测量浓度进行动力学研究,应满足那些条件? 浓度与间接测量的物理量之间有简单的对应关系,而且物理量一定得容易测量。
三 : 物理化学实验报告-乙酸乙酯皂化反应动力学研究1 94
乙酸乙酯皂化反应动力学研究
摘要:本实验通过乙酸乙酯的皂化反应进行化学反应动力学研究。实验利用电导法测定乙酸
乙酯的皂化反应体系中的电导率,通过体系中电导率减少量与酸根离子浓度增加量成正比这一关系,计算反应的速率常数及其活化能,同时了解电导率仪的使用方法。
关键词:皂化反应、电导率、反应速率常数、活化能
1. 序言
化学动力学是研究化学反应速率和反应历程的物理化学分支学科,它的研究对象是物质性质随时间变化的非平衡的动态体系,综合考虑时间及其它各类因素对反应速率的影响以及反应进行的其他细节。本实验通过乙酸乙酯的皂化反应来初探化学反应动力学的一些相关性质和规律。
本实验采用物理方法,通过测定不同时刻溶液的电导率来得到反应各物质的浓度,进而确定反应速率常数这一化学反应中重要的动力学参数,并进一步计算出该反应的活化能。
2. 实验部分
2.1 实验仪器与试剂
DDSJ-308型电导率仪 1台 JB—1B型磁力搅拌器 1台
HK-2A超级恒温水浴槽 1套 秒表 1只 洗耳球 1只 0.5mL移液管 1支 100mL移液管 1支 50mL的烧杯 1个 50mL滴定管 1个
250mL锥形瓶 3个 CH3COOC2H5试剂(分析纯) NaOH(分析纯) 酚酞指示剂溶液。
2.2 实验步骤
1)打开恒温槽使其恒温在25℃±0.2℃。
2)打开电导率仪。根据附录“电导率仪的使用”对电导率仪进行0点及满刻度校正。并认真检查所用电导电极的常数,并用旋钮调至所需的位置。
3)NaOH溶液的配制:(室温下)
用一个小烧杯配制少量的浓NaOH溶液,在1000ml的广口瓶装入约900ml的蒸溜水,将所选用实验仪器的测量电极插入水中,电磁搅拌条件下,逐滴加入浓NaOH溶液到L=1300~1400μS/cm
4)NaOH溶液的滴定:(室温下)
将配制好的NaOH溶液用人工手动滴定管和酚酞指示剂在室温下进行浓度测定,重复三次以上,取平均值。
5)L0的测定:(25.00℃) 取100ml配制且滴定好的NaOH溶液置于恒温夹套反应器中,插入洗净且吸干水的测量电极,恒温10分钟,等电导仪上的读数稳定后,每隔1分钟读取一次数据,测定三个平行的数据。
6)Lt的测定:(冬天25.00℃或夏天30.00℃)
完成L0的测定后,使用小容量的移液管移取所需用量的乙酸乙酯,穿过大口玻璃套,将乙酸乙酯全部放入溶液中,不要遗留在玻璃套的内壁上,以免浓度不准。放到一半时打开秒表计时,读数平稳变化后,尽快测量第一组数据,以后每隔1分钟读一次数,15分钟后每隔2分钟读一次数,进行到35分钟后结束。
7)根据需要进行其他测量
8)按步骤5、6和7在第二个温度下进行测量。(30.00℃)
2.3 注意事项
1)NaOH溶液会吸收空气中的CO2,所以当配置好NaOH溶液后,应马上进行滴定并马上开始实验,否则会导致NaOH的浓度发生变化而影响实验结果;
2)NaOH溶液和乙酸乙酯混合之前应该先恒温,以减小温度变化对实验的结果的影响; 3)取少量的乙酸乙酯的时候应该格外小心,当把乙酸乙酯加到一半时应该立即计时,同时应该避免把乙酸乙酯弄到器壁上而使得乙酸乙酯用量发生改变,影响其浓度;
3. 结果与讨论
3.1 实验结果
反应速率常数K (25℃) = 6.04(L/mol?min);K (30℃) = 7.14(L/mol?min) 活化能Ea=45.29 kJ/mol
相对误差(27.3-25.14)/ 27.3=7.91%
3.2 误差分析
①本实验的数据处理方法是造成结果较大误差的根本原因。 在导出
L0?Lt
?akt这个公式时,我们假定CH3COO?完全电离,且由于CH3COO?迁
Lt?L?
?
移率比OH小,致使体系电导率不断下降,且在一定范围内认为体系的电导率的减少量和的CH3COO?浓度x增加量成正比。实际实验过程中,而实际过程中CH3COO?的浓度和迁移率与体系的电导率之间有着更为复杂的关系。
②实验操作中易产生误差。
1)实验过程中将乙酸乙酯添加到实验仪器时,可能有少许乙酸乙酯粘在器璧上而使得实验时的浓度与计算所用浓度不符。
2)实验过程中使用乙酸乙酯的量很少,因此在取溶液的过程很容易造成较大的误差。
③滴定时造成的误差。
放置的NaOH溶液会吸收空气中的CO2变成Na2CO3,而使得滴定时的NaOH浓度和实验过程中使用的NaOH的浓度略有不同。滴定也存在误差,如读数的误差。
④其他的系统误差:如恒温槽有轻微的温度波动,电导仪老化等。
3.3 讨论
① 在反应开始的一段时间内,曲线上的点了偏离了拟合曲线一些,这可能是因为反应的开
始阶段,反应速率较快,反应物未充分混合,各处浓度不完全一致,得电导率不大稳定。又因本反应为吸热反应,开始时温度会有所降低,起始段的数据反映的是略低温度下的k值,这点从拟合图中也可以清楚地看到。 ② 我们在不同温度下都得到了线性程度较好的直线,说明乙酸乙酯的皂化反应为二级反
应。 ③ 皂化反应曲线随着时间的延长,会出现偏离二级反应的现象。对此,有的研究者认为,
“皂化反应是双分子反应”的说法欠妥,此反应是一种“表观二级反就”;随着时间的延长,反应的可逆性对总反应的影响会逐渐变得明显。有的研究者认为,皂化反应还存在盐效应,即某些中性盐的存在会降低其速率系数,因此,皂化反应实验的时间以半小时为宜,至多不能超过去40min
(2)实验改进
从误差分析中,我们知道虽然该法步骤简单、数据容易处理,但会带来极大的误差,我们可以从下面几个方面对实验进行改进:
1) 采取精确精算的方法,考虑CH3COONa的不完全电离。
Lt?L0Lt?L?
测出Lt后利用上面两式计算出t时间时体系中NaOH浓度,再由(C0-C)/C0C对t作n拟合直线,从斜率得到反应速率常数。
2) 对拟合式进行改进。 将Gt?
1L0?Lt
??G?进行变形: kC0t
LtktC0?L0?LtktC0L'tkt'C0?L0?L'tkt'C0
tLt?t'L't1Lt?L't??G?
?tkC0?t
tLt?t'L'tLt?L't对和进行拟合,这样可消除L0的误差影响。
?t?t
3)采取其他一些非线性拟合的办法。
(3)对实验的体会和认识
通过本次的实验,我对物理化学课本中化学反就动力学的知识有了更加具象的理解,了解到化学反应动力学和两个重要的研究任务,即反应速率和反应历程的研究,而乙酸乙酯皂化反应实验可通过测定电导率的方法很好得计算出反应速率常数,从而推断出反应的级数。同时我从实验中学到了化学动力学的一般实验研究的原则和方法:动力学研究中,应选择反应前后变化非常显著的物理量,测的物质浓度成线性关系的特征物质量为最佳;准确进行动力学测量,必须在恒温条件下进行。
参考文献
[1] 崔献英,柯燕雄,单绍纯.物理化学实验[M].中国科技大学出版社,2000: 29~32. [2] 付献彩,沈文霞,姚天扬,侯文华.《物理化学》(第五版)下册[M].南京大学化学化工学院,高等教育出版社,2005.
[3] 金家骏,化学通报,1974,(3);1981,(11)
[4] 凌锦龙.乙酸乙酯皂化反应实验数据处理方法的改进[J]. 通化师范学院学报,2005,26(2),49~51.
[5]清华大学化学系物理化学实验编写组,《物理化学实验》,p201-209,清华大学出版社,1991年
Study on Kinetics of Ethyl Acetate
Saponification
Abstract: In this experiment, we measure the conductivity of the ethyl acetate saponification by conductivity method, then using the positive correlation between the decrease of conductivity and the increase of acetate (CH3COO?) to calculate the reaction rate constant ,finally, calculate the activation energy of the reaction.
Key Words: activation energy, electrolytic conductivity, reaction rate constant, saponification
附件:实验数据处理
1. 数据记录
1、 NaOH溶液的滴定数据
20t
实验温度: 25 ℃
1) L0的测定:
L0=1598 ?S/cm
物理化学实验报告-乙酸乙酯皂化反应动力学研究1 94_乙酸乙酯皂化反应
2)Lt的测定:
实验温度:
30 ℃
1) L0的测定: L0=1758 ?S/cm
2)Lt的测定:
3、基本误差
电导率:?0.5%
稳定性:?0.3% (FS)/3h 重复范围:0.15% (FS)
2. 数据处理
2.1 数据计算
2.2反应速率常数和活化能的计算
Fig 1.25℃时
L0?Lt
与Lt的关系图 t
Fig 2.25℃时
L0?Lt
与Lt的关系图(除去起始四个点) t
Y = A + B * X
Parameter Value Error
------------------------------------------------------------
A -25.20497 0.7505 B 0.04675 6.39287E-4
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.99814 0.44065 22 <0.0001
------------------------------------------------------------
Fig 2.30℃时
L0?Lt
与Lt的关系图 t
Fig 4.30℃时
L0?Lt
与Lt的关系图(除去起始五个点)
t
Y = A + B * X
Parameter Value Error
------------------------------------------------------------
物理化学实验报告-乙酸乙酯皂化反应动力学研究1 94_乙酸乙酯皂化反应
A -30.65599 1.31963
B 0.05525 0.00109
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.99636 0.7977 21 <0.0001
------------------------------------------------------------
——————————————————————————————————————— K (25℃) =B1/C [NaOH] =0.04675/7.734*10-3=6.04(L/mol?min)
K (35℃) =B2/C [NaOH] = 0.05525/7.734*10-3= 7.14(L/mol?min)
T1=29.95℃=303.1K,T2 = 34.90℃ = 308.05K
由阿累尼乌斯公式:
lnEa?k2Ea?T2?T1?7.145???ln????? k1R?T1?T2?6.048.314?298.15?303.15?
得活化能Ea=25.14kJ/mol
四 : 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
乙酸乙酯皂化反应速度常相数的测定
一、实验目的
1.通过电导法测定乙酸乙酯皂化反应速度常数。[www.61k.com]
2.求反应的活化能。
3.进一步理解二级反应的特点。
4.掌握电导仪的使用方法。
二、基本原理
乙酸乙酯的皂化反应是一个典型的二级反应:
CH3COOC2H5?OH????CH3COO??C2H5OH
设在时间t时生成浓度为x,则该反应的动力学方程式为
?dx?k(a?x)(b?x) (8-1) dt
式中,a,b分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
dx?k(a?x)2 (8-2) dt
1x积分上式得: k?? (8-3) ta(a?x)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作x对t图,如果所的是直线,也可证明反应是二级(a?x)
反应,并可从直线的斜率求出k值。
不同时间下生成物的浓度可用化学分析法测定,也可用物理化学分析法测定。本实验用电导法测定x值,测定的根据是:
(1) 溶液中OH?离子的电导率比离子(即CH3COO?)的电导率要大很多。因此,
随着反应的进行,OH?离子的浓度不断降低,溶液的电导率就随着下降。
(2) 在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率
乙酸乙酯皂化反应 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
就等于组成溶液的电解质的电导率之和。[www.61k.com]
依据上述两点,对乙酸乙酯皂化反应来说,反映物和生成物只有NaOH和NaAc是
强电解质,乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不至于影响电导率的数值。如果是在稀溶液下进行反应,则
?0?A1a
???A2a
?t?A1(a?x)?A2x
式中:A1,A2是与温度、溶剂、电解质NaOH和NaAc的性质有关的比例常数;
?0,??分别为反应开始和终了是溶液的总电导率;?t为时间t时溶液的总电导率。由此三式可以得到:
x?(?0??t)a (8-4) ?0???
若乙酸乙酯与NaOH的起始浓度相等,将(8-4)式代入(8-3)式得:
k?
由上式变换为: 1?0??t? (8-5) ta?t???
?t?
作?t~?0??tkat??? (8-6) ?0??t
t图,由直线的斜率可求k值,即
m?11,k? kama
由(8-3)式可知,本反应的半衰期为:
t1/2?1 (8-7) ka
可见,两反应物起始浓度相同的二级反应,其半衰期t1/2与起始浓度成反比,由(8-7)式可知,此处t1/2亦即作图所得直线之斜率。
若由实验求得两个不同温度下的速度常数k,则可利用公式(8-8)计算出反应的活化能Ea。
乙酸乙酯皂化反应 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋 lnk2Ea?11????? (8-8) k1R?T1T2?
三、仪器和试剂
恒温槽1套;
电导仪1套;
锥形瓶(250mL)2只;
停表1块;
烧杯(250mL)1只;
容量瓶(100mL)2只; 移液管(20mL)2支; 比色管(50mL)2支; 0.02mol?L?1NaOH溶液; 0.02mol?L?1CH3COOC2H5溶液; 0.01mol?L?1NaOH溶液; 0.01mol?L?1CH3COONa溶液。[www.61k.com]
四、操作步骤
1.准确配制0.02mol?L?1的NaOH溶液和CH3COOC2H5溶液。调节恒温槽温度至25℃,调试好电导仪。将电导池(如图8-1)及0.02mol?L?1的NaOH溶液和CH3COOC2H5溶液浸入恒温槽中恒温待用。
2.分别取适量0.01mol?L?1的NaOH溶液和CH3COONa溶液注入干燥的比色管中,插入电极,溶液面必须浸没铂黑电极,置于恒温槽中恒温15分钟,待其恒温后测其电导,分别为G0和G?值,记下数据。
3.取20mL0.02mol?L?1的CH3COOC2H5溶液和20mL0.02mol?L?1的NaOH溶液,分别注入双叉管的两个叉管中(注意勿使二溶液混合),插入电极并置于恒温槽中恒温10分钟。然后摇动双叉管,使两种溶液均匀混合并导入装有电极一侧的叉管之中,同时开动停表,作为反应的起始时间。从计时开始,在第5、10、15、20、25、30、40、50、60分钟各测一次电导值。
4.在30℃下按上述三步骤进行实验。
五、数据记录和处理
将测得数据记录于下表:
乙酸乙酯皂化反应 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
室温:18.6℃ 大气压:721.5

=0.02

=0.01


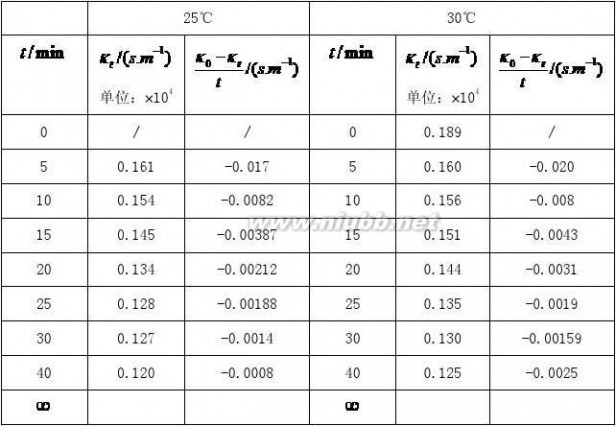
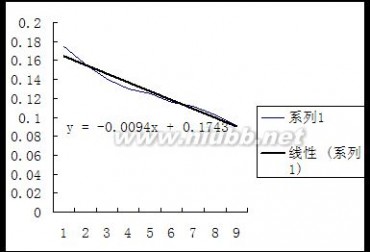
说明:其中温度为30℃时的实验数据为我小组所测,25℃时的数据是参考其他小组多得。[www.61k.com)
1.利用表中数据以对作图求两温度下的。
乙酸乙酯皂化反应 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
25℃时的—图
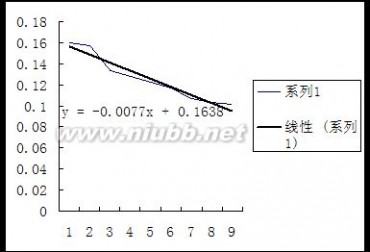
30℃时的 —图
2.利用所作之图求两温度下的25℃:测量的30℃:测量的=0.1964=0.1850,并与测量所得之 作图所得 作图所得进行比较。(www.61k.com) =0.1743=0.1638
可以看出作图所求的两温度下的比测量值小一些,说明可能是测量时间太短,反应不完全所造成的,再就是可能数据处理存在着误差,使得结果偏小。
3.求此反应在25℃和35℃时的半衰期
由图象法可以求出半衰期分别为:25℃:
4.计算此反应的活化能。


值。 30℃:

乙酸乙酯皂化反应 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
六、注意事项
1.注意每次测量之前都应该校正。(www.61k.com]
2.选择合适的量程,使得读取的数值在10~100之间。
3.进行实验时,溶液面必须浸没电极,实验完毕,一定要用蒸馏水把电极冲洗干净并放入去离子水中。
七、思考题
1.为什么以0.01mol?L?1的NaOH溶液和0.01mol?L?1的CH3COONa溶液测得的电导,就可以认为是G0和G?。
答:因为它们是强电解质,在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率就等于组成溶液的电解质的电导率之和。
2. 如果两种反应物起始浓度不同,怎么求速率常数?
答:设起始反应物浓度分别为a,b 其动力学方程式为{1/(a-b)}ln[{b(a-x)}/a(b-x)}]=kt,其中x为t时刻的产物浓度 x用电导仪测的Go,Gt 求得
3.如何从实验结果来验证乙酸乙酯皂化反应为二级反应? 1x答:k?? (8-3) ta(a?x)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作x对t图,如果所的是直线,也可证明反应是二级(a?x)
反应,并可从直线的斜率求出k值。
4. 为什么本实验要在恒温条件下进行?而且NaOH溶液和CH3COOC2H5溶液在混合前还要预先恒温?
答:不同温度条件下所得速率常数不一样。保证温度的均一性,使得所测速率常数更加准确。
本文标题:乙酸乙酯皂化反应-乙酸乙酯皂化反应61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1