一 : 二氧化硅与碳酸钙反应化学方程式是什么?二氧化硅与碳酸钙反应谢谢!
二氧化硅与碳酸钙反应化学方程式是什么?
二氧化硅与碳酸钙反应谢谢!
二氧化硅与碳酸钙反应生成二氧化碳和硅酸钙
条件是高温,制取玻璃的方程式。
SiO2 + CaCO3 = CaSiO3+ CO2↑ (高温)
二 : 碳酸钙与醋酸的反应式是什么
碳酸钙与醋酸的反应式是什么
碳酸钙跟醋酸反应的离子方程式:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
碳酸钙与醋酸的化学方程式 CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑
三 : 乳酸钙的性能与应用
乳酸钙的性能与应用
尽管无机钙盐的价格便宜,但很少用于饮料中。(www.61k.com]饮料中一般都倾向于使用有机钙盐,如柠檬酸钙、乳酸钙、葡萄糖酸钙和乳酸葡萄糖酸钙,这主要是由于有机钙盐都是可溶解的。在饮料中,可溶性的钙盐能起到乳化或稳定的作用。在乳制品产品或含蛋白质的产品中,某些钙盐还是很好的缓冲剂。特别是混合钙盐,由于其溶解性好,可以消除不溶性钙盐的任何不利影响。为了获得最高的缓冲能力,将不同的钙盐按一定的比例结合使用,这样在食品加工过程中,可以避免沉淀的产生。有时,将钙盐加入到蛋白质饮料中作为营养强化剂中,会出现沉淀,造成质量问题,这是由于饮料中蛋白质的作用。当受热时,蛋白质链夺取了溶液中的游离钙离子引起凝结沉淀。这时调节好饮料的pH值和加入螯合剂是十分必要的,螯合剂可以从蛋白质链中保护钙离子。柠檬酸钙能够作为螯合剂,柠檬酸钠或柠檬酸钾是最常用的螯合剂。在谷类食品中,也经常用硫酸钙作为螯合剂,这是利用了硫酸根基团的多功能性。
对于不同的产品,应根据原材料特性和产品特性,选用不同的可溶性钙,否则加入的钙盐将与产品的成分发生反应,出现沉淀或其他风味问题,例如乳酸钙与蛋白质分子起反应会从乳制品中沉淀出来。
碳酸钙是不溶性的,它会在饮料中沉淀,但通过加入乳
乳酸钙 乳酸钙的性能与应用
酸钙和磷酸二钙作为缓冲剂,碳酸钙将不会沉淀出来。(www.61k.com]
钙的生物利用度测定钙的生物利用度有很多变数。例如,在高的加工温度下,谷类食品和蔬菜中的钙被螯合,并降低了反作用,生物利用度降低。当最终产品中钙的数量不变时,钙的生物利用度会降低。其他因素也影响到钙的吸收。当碳酸钙与饭食一起吃时,其生物利用度是最好的,不与饭食同时吃时其生物利用度可能急剧下降。
一般认为可溶性的钙盐生物利用度较高,因为这种钙盐有较高的反作用,更容易在肠道内被吸收。
研究发现低聚糖的加入有助于增加钙的吸收,现在国际食品界得到应用,如短链低聚果糖已经用于乳制品和大豆制品中用于提高钙的吸收。另外菊粉也证明能促进钙的吸收。 乳酸钙是纯天然发酵产品,为白色至乳白色结晶粉末或颗粒,无异味,微有风化性,易溶于热水,不容于乙醇、乙醚和氯仿。乳酸钙具有如下特性:
1.溶解度高:
如上图所示,常温下溶解度乳酸钙>柠檬酸钙>葡萄糖酸钙>磷酸钙>碳酸钙
2.口感好:
钙盐一般都有苦涩味,但是乳酸钙相对于其它钙盐其可感知的阀值较大。阀值是指人们对某种物质感到味觉的最低浓度,阀值越高,表示越难感觉到苦味。
乳酸钙 乳酸钙的性能与应用
3.钙含量较高:
4.生物利用率高,人体对钙的吸收率顺序:乳酸钙>葡萄糖酸钙>碳酸钙>磷酸钙
5.稳定性好:乳酸根分子量较小,稳定性较好,在不同的加工条件下保持相对稳定,乳酸根与其他组分不会发生沉淀反应,不影响产品品质。[www.61k.com)
6.钙离子作用明显:乳酸钙含有钙离子,由于是二价离子,钙离子可以在有机大分子之间形成连接桥,加强有机大分子之间的相互作用,增强腌菜的脆性。
35、乳酸钙产品用途
1.由于具有较好的溶解性和口感,且与其它物质不产生沉淀反应,广泛用于乳制品及各种饮料中,如:奶粉、液态奶、乳酸菌饮料、果蔬、蛋白饮料,起钙强化作用。
2.用于饼干、麦片、各种米面糕点类食品中,进行钙元素的营养强化,如面包、馒头、米饭、面条、米饼、雪饼、方便食品、膨化食品及各种饼干糕点食品,具有钙加强,保护牙齿等作用。
3.用于钙片,钙冲剂、补钙口服液中,优点是溶解度高,口感好,人体吸收利用率高,无毒副作用。
4.由于具有很高的溶解度,乳酸钙可以提供高浓度的钙离子,而钙离子具有较强的架桥作用,因而乳酸钙是一种优秀的胶联剂。
乳酸钙 乳酸钙的性能与应用
5.固化剂和增脆剂:由于乳酸钙具有很高的溶解度,乳酸钙可以提供很高浓度的钙离子,而钙离子能在磷脂分子间形成结构桥,将磷脂分子联结起来,进而稳定膜结构。www.niubb.net同时钙离子还能与植物细胞的膜蛋白结合,降低细胞膜的渗透性,防止细胞内含物外渗。因而乳酸钙可作为固化剂和增脆剂用于水果、蔬菜、腌菜的加工和保存,降低固化物的损失,保持性状、增脆。
6.乳酸钙还用于牙膏,可以防止牙釉中矿物质的流失,同时减少牙垢的形成以达到护齿健齿的功效;在烟草工业中,可以改善香烟的燃烧特性,改善灰质,提高香烟的品质。
7.乳酸钙能降低产品中水的活度、乳酸根离子能进入到细胞内部抑制和破坏微生物的新陈代谢,故乳酸钙能抑制腐败菌的生长,延长产品货假期。
应用指导:腌制液中添加0.2—0.35%乳酸;1-1.5%乳酸钙。
L-乳酸盐系列在食品中的应用
□品种分类
L-乳酸盐系列主要分为L-乳酸钙L-CalciumLactate、L-乳酸钠L-
SodiumLactate、L-乳酸锌L-ZincLactate、L-乳酸亚铁L-FerrousLactate、L-乳酸镁L-MagnesiumLactate、L-乳酸钾L-PotassiumLactate等。
乳酸钙 乳酸钙的性能与应用
□L(+)左旋型与DL(-)混旋型的区别
1.符合人体左旋的生理特征。(www.61k.com)2.DL-型乳酸与L(+)型乳酸在人体中的代谢途径不同,婴幼儿对D型乳酸不能代谢,使血液中酸值升高,引起有害作用。
3.联合国粮农组织和世界卫生组织(FAO\WHO)明确规定:D型乳酸和DL乳酸都不能允许用于婴幼儿食品。
4.欧共体(EEC)的食品添加剂允许使用名单中,乳婴的强化牛奶及乳婴、幼儿断奶食品中只许可食用L-乳酸和L-乳酸盐。
□L-乳酸钙L-CalciumLactate性状:白色晶体或粉末,无臭、无味,五水化合物,三水化合物,吸潮性,可溶于水。
良好的溶解度:20℃时溶解度大于7%,50℃时溶解度大于20%。
适宜的钙含量:13.0%~14.0%高吸收率:作为生物发酵有机钙,吸收率高于其他补钙产品,是理想的食品钙强化剂。
优点:由天然的L(+)乳酸与无机盐反应而成,人体吸收好,中性pH值,Ca离子含量高。
61阅读提醒您本文地址:
溶解度高,营养利用率高,稳定性好,口感好。
特别需要钙的人群:1.十几岁的青少年;2.孕妇和哺乳期的妇女;3.更年期妇女;
4.老年人;5.不能消耗乳制品的特殊人群。不同年龄每天钙的摄入量:0~0.5岁→400mg0.5~1岁→600mg1~10岁→800mg11~18岁→1200mg>18岁→800mg□L-乳酸钙的广泛用途1.可添加于各种米面糕点类食品中,进行钙元素的营养强化,如面包、馒头、米饭、面条、米饼、雪饼、方便食品、膨化食品及各种饼干糕点。
2.可添加于乳制品及各种饮料中,如:奶粉、液态奶、乳酸菌饮料、果蔬、蛋白饮料。
3.可添加于各种食品中,如水果糖、奶糖、口香糖、果冻、巧克力、朱古力、雪糕、冰淇淋等。
4.可配合海藻酸盐等作为胶化盐添加于果酱、辣酱等食品中。
5.可用于罐装和瓶装水果、蔬菜加工处理过程、降低加工处理过程中的固化物损失。
6.可添加于香肠、肉肠、火腿肠的肉泥中,增加钙元素营养强化,同时可提高抑菌能力。
7.可配合海藻酸钠作为肉的黏合剂,在肉类产品加工烹调时,可增加黏合力,降低
乳酸钙 乳酸钙的性能与应用
烹调损耗,保持肉类多汁、香味、颜色、结构等特征。(www.61k.com)
□L-乳酸钠溶液SodiumLactateSolution性状牶无色或微黄色透明浆状液体,有很强的吸水能力,无臭或略,有特殊气味,略有咸苦味,混溶于水、乙醇和甘油。一般浓度60%~80%(以重量计)。
作用:保湿性强,能锁定产品中自由水分的吸收量,从而降低成品中水分活性。另外,L-乳酸钠中存在的乳酸盐离子能阻碍微生物的生长;同时在食品中具有增香作用。 L-乳酸钠广泛应用于肉禽食品的加工业,能显著延长产品货架期。由于对肉类的颜色没有影响,因此将取代亚硝酸盐,对加工产品来说是非常突出的加工助剂。特别是低盐产品,增加效益,降低成本。
增强产品原有风味:由于产品中保存了天然原料,因此改善了产品结构。并能抑制食物内致病菌的生长。
在调味料中:可作风味改进剂;pH值调节剂。
在烘烤食品(蛋糕、蛋卷、饼干等):可作品质改进剂、保湿剂,亦可作抗氧化剂。 □用于食品及日化领域的其他L-乳酸盐1.L-乳酸亚铁性状:淡黄绿色结晶状粉末,易溶于水,无味或稍有甜的铁锈味。应用:该产品对防治和治疗缺铁性贫血有显著的效果,可广泛应用于食品、饮料、乳制品、食盐、营养液、保健品等。
L-乳酸亚铁的优点:·由蔗糖发酵生成的天然L(+)-乳酸作为原料制备而得到的。·溶解性好,安全性好,吸收率高是目前人体吸收利用率最好的铁质强化剂。·具有与人体相融的左旋性特征,被WHO推荐为婴幼儿最佳补铁产品。2.L-乳酸锌分子量:297.38性状:白色结晶状粉末,无味,三水化合物。有吸潮性,溶于水。应用:可添加于各种类型食品中,进行锌元素的营养强化,如饮料、果冻、酸奶、面包、米饼、方便食品、膨化食品、馒头、米饭、面条、及各种饼干糕点。
L-乳酸锌的优点牶用发酵法生产的L-乳酸锌具有与人体相融的左旋性特征,人体内含有L-乳酸脱氢酶,使其具有双重天然生物特性,因此人体吸收利用率高.L-乳酸锌是婴幼儿、儿童最佳补锌强化剂。
3.其他应用:L-乳酸锌、L-乳酸亚铁、L-乳酸镁、L-乳酸钾、L-乳酸锰都具有人体相融的左旋性特征。中性口感,稳定性好,高生物利用率。可广泛应用于饮料、乳制品、营养液、保健品等。
乳酸钾还可作增香剂、抗氧化增效剂。
乳酸钙 乳酸钙的性能与应用
在强化运动员的健康饮料、果汁、减肥食品中都具有较好的效果。(www.61k.com)
被世界卫生组织WHO推荐为婴幼儿最佳补镁、锌、铁、锰产品。
护肤品:L-乳酸盐可作为新一代的皮肤增白剂,与其他增白剂结合使用时会产生协同效果。
特殊皮肤护理品:L-乳酸钠能非常有效的治疗皮肤功能紊乱,如皮肤干燥病症等引起的极度干燥症状。由于L(+)乳酸和L(+)乳酸盐具有抗微生物作用,而被应用于治疗粉刺产品中。
口腔护理品:L-乳酸钙作为护齿垢剂,用于众多口腔护理产品,如牙膏、漱口水等。L-乳酸钙和L-乳酸锌也可作为产品中钙和锌的来源。
浴洗宝:L-乳酸钠可作为保湿剂用于各种浴洗用品中,如沐浴液、润肤蜜;在液体肥皂、香皂和香波中可作为pH调节剂等。
61阅读提醒您本文地址:
四 : 将水中的钙离子转化为草酸钙(CaC2O4)后进行反应与计算是测定水硬度的一种方法.下图是6.4g草酸
将水中的钙离子转化为草酸钙(CaC2O4)后进行反应与计算是测定水硬度的一种方法.下图是6.4g草酸钙固体在受热分解过程中所得固体产物的质量随温度变化的曲线,图中A、B、C分别代表三种固体.试利用图中信息结合所学的知识,回答下列问题: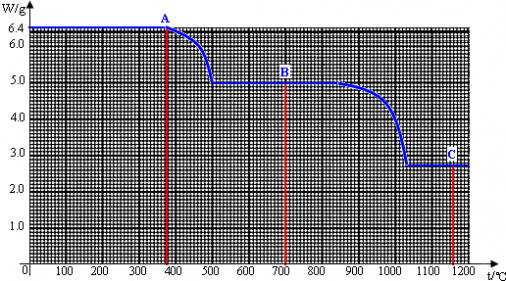 (1)6.4g草酸钙A完全分解为碳酸钙B和CO时,生成的CO的质量是______g. (2)当温度从500℃升至840℃时,为什么碳酸钙的质量保持不变______. (3)试据图计算并推断C的合理化学式. |
| (1)设生成CO的质量为x,CaCO3的质量为y,草酸钙分解为碳酸钙和CO的方程式为: CaC2O4
128100 28 6.4 yx ∴
解之得:x=1.4g y=5g ∴生成CO的质量为1.4g. (2)因为碳酸钙只有在高温下才分解,所以碳酸钙的质量保持不变. (3)根据图可以看出生成C的质量为2.8g,又因为碳酸钙在高温时可分解为CaO和CO2,所以猜测C是氧化钙(CaO),验证如下: CaCO3
10056 52.8 ∴固体C是氧化钙,化学式CaO. |
考点:
考点名称:盐的性质盐的定义:| 氯化钠 | 碳酸钠 | 碳酸氢钠 | 碳酸钙 | 硫酸铜 | |
| 化学式 | NaCl | Na2CO3 | NaHCO3 | CaCO3 | CuSO4 |
| 俗称 | 食盐 | 纯碱、苏打 | 小苏打 | —— | —— |
| 物理性质 | 白色固体,易溶于水。水溶液有咸味,溶解度受温度影响小 | 白色固体,易溶于水 | 白色固体,易溶于水 | 白色固体,不溶于水 | 白色固体,易溶于水,溶液为蓝色,有毒 |
| 化学性质 | 水溶液显中性 AgNO3+NaCl==AgCl↓+NaNO3 | 水溶液显碱性 Na2CO3+2HCl==2NaCl+H2O+CO2↑ Na2CO3+Ca(OH)2==CaCO3↓+2NaOH | 水溶液显碱性 NaHCO3+HCl==NaCl+H2O+CO2↑ | CaCO3+2HCl==CaCl2+H2O+CO2↑ | CuSO4+5H2O==CuSO4·5H2O CuSO4+Fe==FeSO4+Cu CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 |
| 用途 | 作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料 | 制烧碱,广泛用于玻璃、纺织、造纸等工业 | 焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多 | 实验室制取CO2,重要的建筑材料,制补钙剂 | 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜 |

| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
| 化学式的含义 | 以H2O为例 | ||
| 质的含义 | 宏观 | ①表示一种物质 ②表示物质的元素组成 | ①表示水 ②表示水是由氢、氧两种元素组成的 |
| 微观 | ①表示物质的一个分子 ②表示组成物质每个分子的原子种类和数目 ③表示物质的一个分子中的原子总数 | ①表示一个水分子 ②表示一个水分子是由两个氧原子和一个氧原子构成的 ③表示一个水分子中含有三个原子 | |
| 量的含义 | ①表示物质的相对分子质量 ②表示组成物质的各元素的质量比 ③表示物质中各元素的质量分数 | ①H2O的相对分子质R =18 ②H2O中氢元素和氧元素质量比为1:8 ③H2O中氢元素的质量分数= 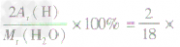 100%=11.1% 100%=11.1% | |
化学式和化合价的关系:
(1)根据化学式求化合价
①已知物质的化学式,根据化合价中各元素的正负化合价代数和为0的原则确定元素的化合价。
标出已知、未知化合价: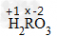
列出式子求解:(+1)×2+x×1+(-2)×3=0 x=+4
②根据化合价原则,判断化学式的正误,如判断化学式KCO3是否正确
标出元素或原子团的化合价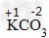
计算正负化合价代数和是否为0:(+1)×1+(-2)×1=-1≠0,所以给出的化学式是错误的,正确的为K2CO3。
③根据化合价原则,计算原子团中某元素的化合价,如计算NH4+中氮元素的化合价和H2PO4-(磷酸二氢根)中磷元素的化合价。
由于NH4+带一个单位的正电荷,不是电中性的,因此各元素的化合价代数和不为多,而是等于+1. 设氮元素的化合价为x
x+(+1)×4=+1 x=-3
所以在NH4+中,氮元素的化合价为-3. 同理H2PO4-带一个单位的负电荷、不是电中性的、因此各元素的化合价代数和不为零,而是-1.
设磷元素的化合价为y
(+1)×2+y+(-2)×4=-1 y=+5 所以在H2PO4-中磷元素的化合价为+5.
④根据化合价原则,确定物质按化合价的排序。如H2S,S,SO2,H2SO4四种物质中均含有硫元素,并且硫元素的化合价在四种物质中分别为:-2,0, +4,+6,故这四种物质是按硫元素的化合价由低到高的顺序排列的。
(2)根据化合价写化学式
根据化合物中化合价的代数和等于0的原则,已知元素的化合价可以推求实际存在物质的化学式,主要方法有两种:
①最小公倍数法
| 步骤 | 举例 | |
| 写 | 一般把正价元素的符号(或原子团)写在左边,负价元素的符号(或原子团)写在右边,并把化合价写在元素符号(或原子团)的正上方 | 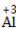 、 、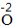 |
| 求 | 求出两种元素化合价绝对位的最小公倍数,然后求出每种元素的原子个数= | 因为|-2|×|+3|=6,所以Al原子个数为6/3=2,O原子个数=6/2=3 |
| 标 | 将原子个数写在相应元素符号的正下角 | Al2O3 |
| 验 | 检验各种元素正负化合价的代数和是否为0,确定化学式的正确性 | (+3)×2+(-2)×3=0,所以该化学式正确。 |
| 步骤 | 例1 硫酸铜 | 例2 氧化钙 | |
| 排列 | 分析名称,确定元素符号(或原子团)的顺序 | 铝 硫酸根 Al SO4 | 钙 氧 Ca O |
| 标价 | 标上化合价 | 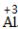 、 、 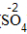 |  、 、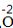 |
| 约简 | 将化合价的绝对值约成最简整数比 | 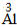 、 、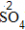 |  、 、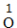 |
| 交叉 | 将整数交叉写在元素符号(或原子团)的右下角 |  |  |
| 检验 | 根据正负化合价代数和是否为0,检验正误 | (+3)×2+(-2)×3=0 | (+2)+(-2)=0 |
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1