一 : “有机化学基础”模块的教学反思
“有机化学基础”模块的教学反思
有机化学的知识分布在必修2和选修5两本教材里,注重知识的获取过程,与生活、生产实际的联系;但知识的体系不如以前课本那样有系统性,给实际教学带来不便。老师教学时并不好处理。对于必修2有机知识教学,仅要求介绍几种有机物的浅表知识,然而遇到了其它一些简单同系物的名称、同分异构体、性质等问题时,也要有基本认知,否则,那些独立的知识不容易真正被学生接受。这样一来,老师教学时如果做一些整合,把选修五的部分内容提前讲,效果会更好。但由于教学时间有限,这样处理是不大可能的。那么,必修2所学的基础有机化合物的那点皮毛知识到了一年后的选修5学习中,遗忘得所剩无几了。选修5教学中会出现什么问题,教师该如何处理这部分的教学呢?
经过[www.61k.com]第一章和第二章的教学,发现学生对于该部分的学习出现了1种分化情况。快班中等程度以上的学生,感觉到学习选修5比选修4更轻松。原因是选修4《化学反应原理》这本教材设计的内容理论性很强,需要学生有很好的理解能力和逻辑思维能力,好多知识点在必修模块当中已经涉及到,但这里是更高的1个层次,有更进1步的广度和深度,而且更加系统性,所以对很多学生而言,学好这本教材有较大的难度。而选修5《有机化学基础》模块课标要求比较简单,有机化学知识的规律性强,如果能理解并及时进行知识归纳和记忆巩固,再进行一定量的应用训练,学好是不难的。
而对于普通班学生来说,却出现了1种截然不同的情形。他们感到有机化学学起来很吃力。虽然课堂上听懂了,可课后做练习时觉得很难,尤其在测验时,时间不够用,每道题似乎都要想很久才慢慢解出来。学生反应的问题主要是:(1)有机化学方程式难记。有机化学方程式与无机化学方程式有较大区别,学生初接触,感觉生疏,尤其是反应条件多样复杂,很难记清楚。(2)有些实验书中没有详细介绍实验步骤但又需掌握,比如苯的溴代、硝化反应,印象比较混乱。(3)有机物质名称多,难记,解题时有些不能顺利记起,要回忆很久才能联系。
有机化学体现系统性,对于基础好的学生来说,知识的熟练和灵活应用是基本要求。特别是有机合成要求对知识有很全面系统的掌握、要有熟练的联想应用能力。各类烃的衍生物之间的转化、各类有机反应条件的应用、各类反应中有机物化学键的断键成键规律是要重点把握的。
综合这些情况,应采取以下几个措施:
1.将已学的重要有机方程式列出来,把有机反应类型、条件做好归纳归类,印发给学生记忆。
2.将苯的溴代、硝化反应,卤代烃取代反应和消去反应等重要性质实验原理、装置、步骤、检验方法等编写出来,印发给学生,帮助其梳理知识,加强理解和应用。
3.及时针对性地讲评练习。
4.备课和编写学案时,将重要知识、核心知识列出来,让学生记住。
5.讲授新课时,对于必修2出现过的知识,要复习、甚至需重新介绍。
6.及时检查、测试,反馈学生掌握情况,采取弥补和改进措施。
7.引导学生尽力做好复习,自己主动做好知识的梳理、小结;解题时多进行联系、对比;用自己的理解和思维方式构建知识网络,画出不同知识主题的思维导图。
二 : 元素有机化学课程教学大纲
《元素有机化学》课程标准
课程编号:09010502
总学时数:32学时
学 分:2学分
一、课程性质、目的和要求
元素有机化学打破了传统的有机化学和无机化学的界限,与理论化学、合成化学、结构化学、生物无机化学、高分子化学等交织在一起,是有机化学一个重要的分支学科。[www.61k.com]作为有机合成试剂和有机反应的高效、高选择性催化剂,元素有机化合物在有机合成、医学、农药、国防和生命科学等领域具有重要的意义,近代发展十分迅速。通过学习,学生应初步掌握各类元素有机化合物的结构、制备、性质及其在合成中的应用。该课程不仅对学生科研综合素质的培养、创新能力的提高起着重要的作用,而且对他们今后从事新材料、新药物的合成,新能源、新产品的开发,新的工艺过程设计等起着重要的指导作用。
二、本课程的基本内容
第一章:绪论 2学时
(一)教学目的与要求
了解元素有机化学的研究内容、分类以及课程的学习方法。
(二)教学的重点与难点
元素有机化合物的重要基础概念。
(三)课时安排:2学时
(四)主要内容
元素有机化合物的定义、分类及用途。
第二章:元素有机化合物的制法与性质 4学时
(一)教学目的与要求
熟悉元素有机化合物的基本制法及性质。
(二)教学的重点与难点
教学的重点:元素有机化合物的制法及性质
教学的难点:元素有机化合物制法及性质
(三)课时安排:4学时
(四)主要内容
元素有机化合物的基本制法及性质。
第一节:元素有机化合物的基本制法 (3学时)
1、金属与卤代烃的反应
2、金属盐与有机金属化合物反应
3、烃类的金属化反应
元素有机化学 元素有机化学课程教学大纲
4、金属或非金属氢化物与不饱和烃加成
5、过渡金属C-M键的特殊合成法
第二节:元素有机化合物的性质 (1学时)
1、元素有机化合物的物理性质
2、元素有机化合物对氧化及水解的稳定性
第三章:有机氟化合物 4学时
(一)教学目的与要求
熟悉有机氟化合物的命名、主要化学性质;了解常见有机氟化合物在有机合成上的应用。[www.61k.com)
(二)教学的重点与难点
教学的重点:有机氟化合物的命名、性质及在有机合成上的应用。
教学的难点:有机氟化合物的主要化学性质。
(三)课时安排:4学时
(四)主要内容
有机氟化合物的命名、物理性质、化学性质及在有机合成上应用。
第一节:有机氟化合物 (1学时)
1、有机氟化合物的命名
2、有机化合物中引入氟的反应
第二节:有机氟化合物的性质 (2学时)
1、有机氟化合物的物理性质
2、有机氟化合物的化学性质
第三节:有机氟化合物的应用 (1学时)
第四章:有机磷化合物 4学时
(一)教学目的与要求
熟悉有机磷化合物的命名、性质;磷叶立德与Witting反应;了解常见有机磷化合物在有机合成上的应用。
(二)教学的重点与难点
教学的重点:有机磷化合物的命名、性质;磷叶立德与Witting反应。
教学的难点:有机磷化合物的主要化学性质;磷叶立德与Witting反应。
(三)课时安排:4学时
(四)主要内容
有机磷化合物的命名、性质;三价磷化合物、高价磷化合物的结构及应用;磷叶立德与Witting反应。
第一节:有机磷化合物 (2学时)
1、有机磷化合物的类型
2、有机磷化合物的命名
3、有机磷化合物的成键特性
第二节:三价磷化合物 (1学时)
1、烃基膦
2、亚膦酸、次亚膦酸以及它们的衍生物
第三节:高价磷化合物 (1学时)
元素有机化学 元素有机化学课程教学大纲
1、季膦盐
2、磷叶立德与Witting反应
3、膦酸、次膦酸以及它们的衍生物
第五章:有机硅化合物 4学时
(一)教学目的与要求
熟悉有机硅化合物的命名与特性;了解常见有机硅化合物的、性质及在有机合成上的应用。(www.61k.com)
(二)教学的重点与难点
教学的重点:有机硅化合物的命名与特性;常见有机硅化合物的制备及性质。
教学的难点:有机硅化合物的制备及性质。
(三)课时安排:4学时
(四)主要内容
有机硅化合物的命名、特性;有机硅烷的制备及性质;硅活性中间体的结构及性质;有机卤硅烷合成、性质。
第一节:有机硅化合物 (1学时)
1、有机硅化合物的特性
2、有机硅化合物的命名
第二节 有机硅烷 (2学时)
1、有机硅烷的制备
2、有机硅烷的性质
3、常见有机硅烷
4、硅活性中间体
第三节 有机卤硅烷 (1学时)
1、有机硅烷的合成
2、有机硅烷的性质
第六章:有机硼化合物 4学时
(一)教学目的与要求
熟悉有机硼化合物的基本特点、命名及制备方法;了解常见有机硼化合物的结构、性质及用途。
(二)教学的重点与难点
61阅读提醒您本文地址:
教学的重点:有机硼化合物的基本特点、命名、制备方法及用途。
教学的难点:有机硼化合物的基本特点、命名及制备方法;硼烷及其烃基衍生物的结构及性质;含硼杂环化合物、含B-N键的有机硼化合物和含硼聚合物的结构。
(三)课时安排:4学时
(四)主要内容
有机硼化合物的基本特点、命名及制备方法;硼烷及其烃基衍生物的结构、性质及用途;含硼杂环化合物、含B-N键的有机硼化合物和含硼聚合物。
第一节:有机硼化合物 (2学时)
1、有机硼化合物的基本特点
2、有机硼化合物的命名
元素有机化学 元素有机化学课程教学大纲
3、有机硼化合物的制备方法
第二节:硼烷及其烃基衍生物 (1学时)
1、硼烷
2、碳硼烷
3、烃基硼烷的性质及用途
第三节:其它有机硼化合物 (1学时)
1、含硼杂环化合物
2、含B-N键的有机硼化合物
第七章:非过渡金属有机化合物 4学时
(一)教学目的与要求
熟悉非过渡金属有机化合物的特点、制法及主要性质;了解常见非过渡金属有机化合物的用途。(www.61k.com]
(二)教学的重点与难点
教学的重点:非过渡金属有机化合物的特点、制法及主要性质。
教学的难点:非过渡金属有机化合物的制法及主要性质;格氏试剂。
(三)课时安排:4学时
(四)主要内容
非过渡金属有机化合物的特点及活性;IA、IIA、IIIA族元素的金属有机化合物;IB、IIB族元素的金属有机化合物;IVA、VA族元素的金属有机化合物。
第一节:概述 (0.5学时)
1、非过渡金属有机化合物的特点
2、非过渡金属有机化合物的活性
第二节:IA、IIA、IIIA族元素的金属有机化合物 (1.5学时)
1、格氏试剂
2、有机锂化合物
3、有机钠、钾化合物
4、有机铝化合物
第三节:IB、IIB族元素的金属有机化合物 (1学时)
1、有机锌、镉化合物
2、有机汞化合物
3、有机铜、银、金化合物
第四节:IVA、VA族元素的金属有机化合物 (1学时)
1、有机锗、锡、铅化合物
2、有机砷、锑、铋化合物
第八章:过渡金属有机化合物 6学时
(一)教学目的与要求
熟悉过渡金属有机化合物的结构、制法及主要性质;了解常见过渡金属有机化合物的用途。
(二)教学的重点与难点
教学的重点:过渡金属有机化合物的结构、制法及主要性质。
元素有机化学 元素有机化学课程教学大纲
教学的难点:过渡金属有机化合物的主要性质。(www.61k.com)
(三)课时安排:6学时
(四)主要内容
过渡金属有机化合物的组成、结构、制备方法、化学反应;过渡金属有机化合物催化的有机反应;过渡金属有机化合物的应用。
第一节:过渡金属有机化合物的组成及结构 (2学时)
1、过渡金属有机化合物的特点
2、过渡金属有机化合物的类型
第二节:过渡金属有机化合物的制备方法及化学反应 (2学时)
1、过渡金属有机化合物的制备方法
2、过渡金属有机化合物的化学反应
第三节:过渡金属有机化合物催化的有机反应 (2学时)
1、过渡金属有机化合物催化的有机反应的类型
2、过渡金属有机化合物催化剂与常用固体催化剂的比较
3、有机高分子过渡金属化合物催化剂
三、教学方法
以教师讲授为主,辅以多媒体教学手段,并结合学生的练习与实践。
四、成绩考核方式
考查。
五、教材与主要参考书目
(一)教材
赵玉芬.赵国辉,元素有机化学,清华大学出版社,1998-12-01
(二)主要参考书目
[1] 冯春祥.宋永才 谭自烈,元素有机化合物及其聚合物,国防科技大学出版社,1999.3
[2] 汪小兰,有机化学(第四版),高等教育出版社,2005.5
[3] 王积涛.张宝申.王永梅.胡青眉, 有机化学(第二版),南开大学出版社,2003.10
[4] 陈茹玉等, 有机磷化学研究, 高等教育出版社
[5] 杜作栋.陈剑华等,有机硅化学, 高等教育出版社, 1990.6
[6] 李光亮,有机硅高分子化学,科学出版社,1999.5
[7] 基尔希, 当代有机氟化学-合成 反应 应用 实验, 华东理工大学出版社, 2006.3
[8] 钱延龙等,有机金属化学与催化,化学工业出版社, 1997
[9] 黄耀曾等, 金属有机化合物在有机合成中的应用,上海科学技术出版社,1990
61阅读提醒您本文地址:
三 : 大学基础化学
Chap.7
界面现象
Interfacial Phenomenon
大学基础化学Ⅱ
表面与界面(Surface and Interface)
? 相:系统中物理和化学性质完全均匀的一部分。 ? 相界面:相与相之间的明显分界面,简称界面。
界面层 ----不是几何平面,而是几个分子大
小的一薄层。
五种类型:气液;气固;液液;液固;固固
? 表面:
一个相为气相的接触面。一个相(液相,固相) 与其本身饱和蒸气相接触的面。
2013-8-7
Chap.6 Interface
2
大学基础化学Ⅱ
第一节 界面张力
(Interfacial Tension)
(一)比表面积 (二)界面张力 (三)影响界面张力的因素 (四) 界面热力学
2013-8-7
Chap.6 Interface
3
大学基础化学Ⅱ
(一)比表面积 (Specific Surface)
?分散度:把物质分散成细小微粒的程度。 ?比表面积: 单位体积或单位质量物质所具有的表面积。 ?体积比表面: aV =AS/V (AS,V 为物质的总表面积,体积) ?质量比表面:as=AS/m (AS,m为物质的总表面积,质量)
2013-8-7
Chap.6 Interface
4
大学基础化学Ⅱ
(二)界面张力(Interfacial Tension)
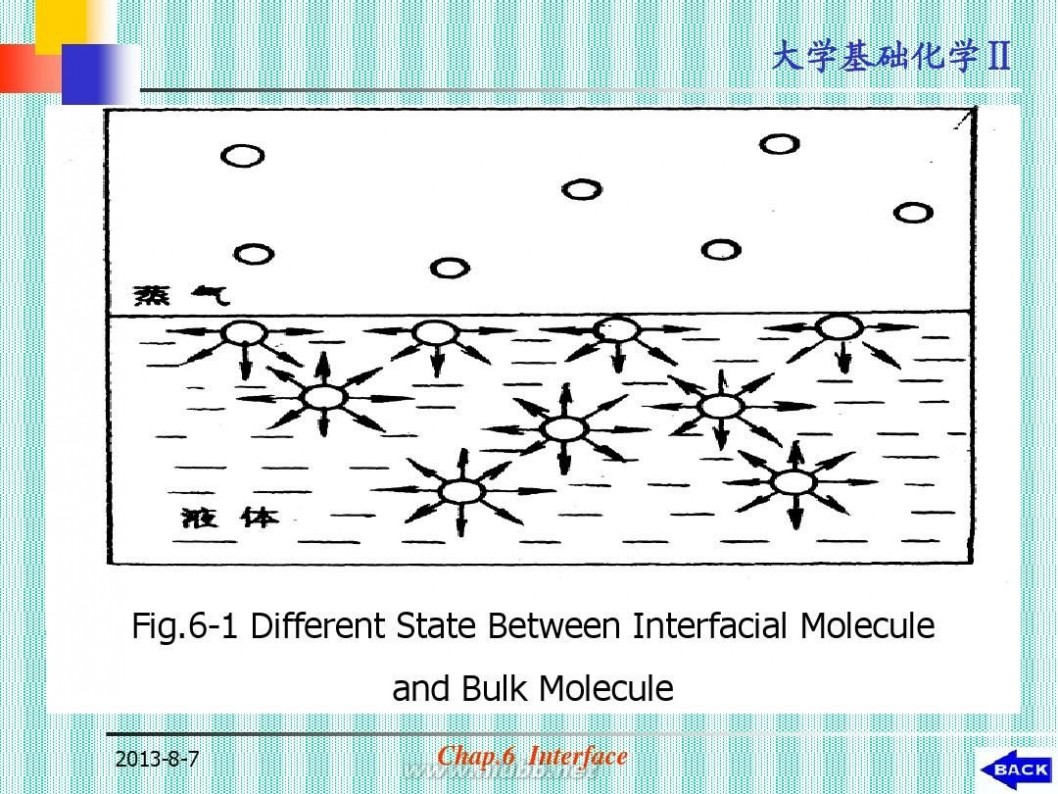
(1)表面分子所处的状态(见图6-1)
? 内压力:
表面层分子受到一个指向液体内部的 压力。 ? 导致液体表面有自动收缩的趋势,有 自发与外来分子发生化学或物理结合的 趋势。
2013-8-7
Chap.6 Interface
5
大学基础化学Ⅱ
Fig.6-1 Different State Between Interfacial Molecule and Bulk Molecule
2013-8-7
Chap.6 Interface
6
大学基础化学Ⅱ
(2)比界面吉布斯函数
(Specific Interfacial Gibbs Function)
? 在T,P下,可逆地增大表面积需环境做功 δWr’= γdAS γ :比例系数 ? δWr’=(dG) T,P = γdAS
? GSUR = γAS
? γ= GSUR /AS
GSUR: 界面吉布斯函数
比界面吉布斯函数
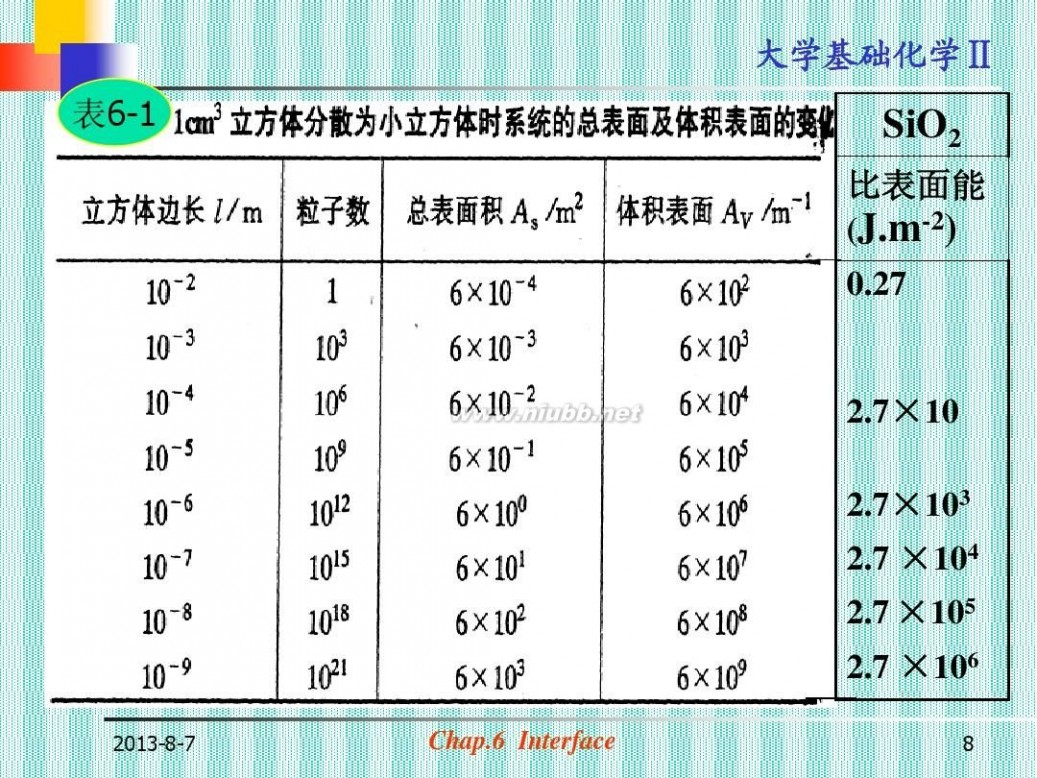
? γ=(?G/?AS)T,p(参见表6-1)
2013-8-7
Chap.6 Interface
7
大学基础化学Ⅱ
表6-1
SiO2
比表面能 (J.m-2)
0.27
2.7×10 2.7×103 2.7 ×104 2.7 ×105
2.7 ×106
2013-8-7
Chap.6 Interface
8
大学基础化学Ⅱ
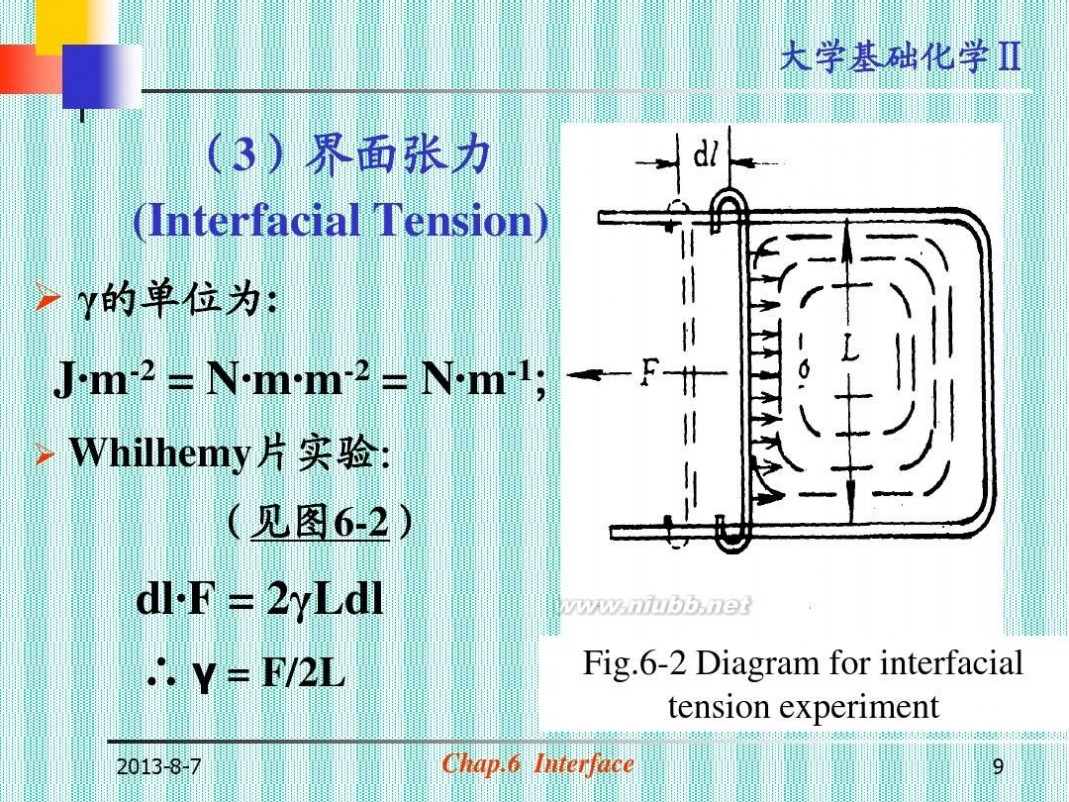
(3)界面张力 (Interfacial Tension)
? γ的单位为:
J· -2 = N· m-2 = N· -1; m m· m
?
Whilhemy片实验: (见图6-2)
dl· = 2γLdl F
∴ γ = F/2L
2013-8-7
Fig.6-2 Diagram for interfacial tension experiment
Chap.6 Interface
9
大学基础化学Ⅱ
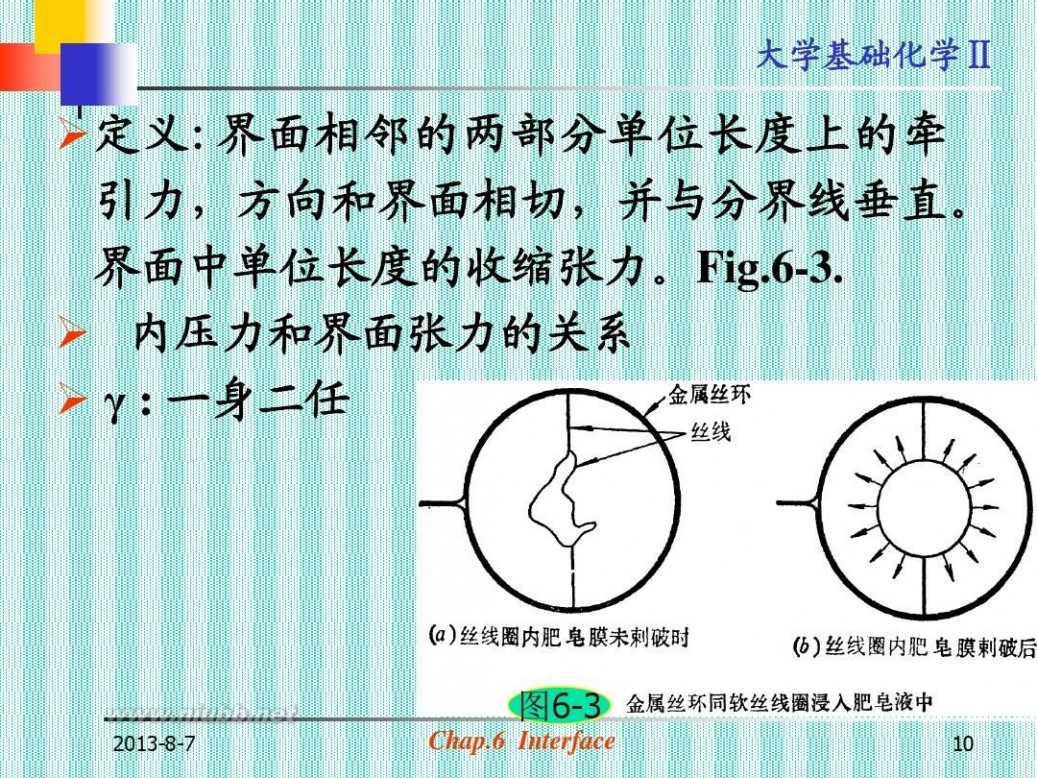
?定义:界面相邻的两部分单位长度上的牵 引力,方向和界面相切,并与分界线垂直。 界面中单位长度的收缩张力。Fig.6-3. ? 内压力和界面张力的关系 ? γ : 一身二任
图6-3
2013-8-7
Chap.6 Interface
10
大学基础化学Ⅱ
(三)影响界面张力的因素
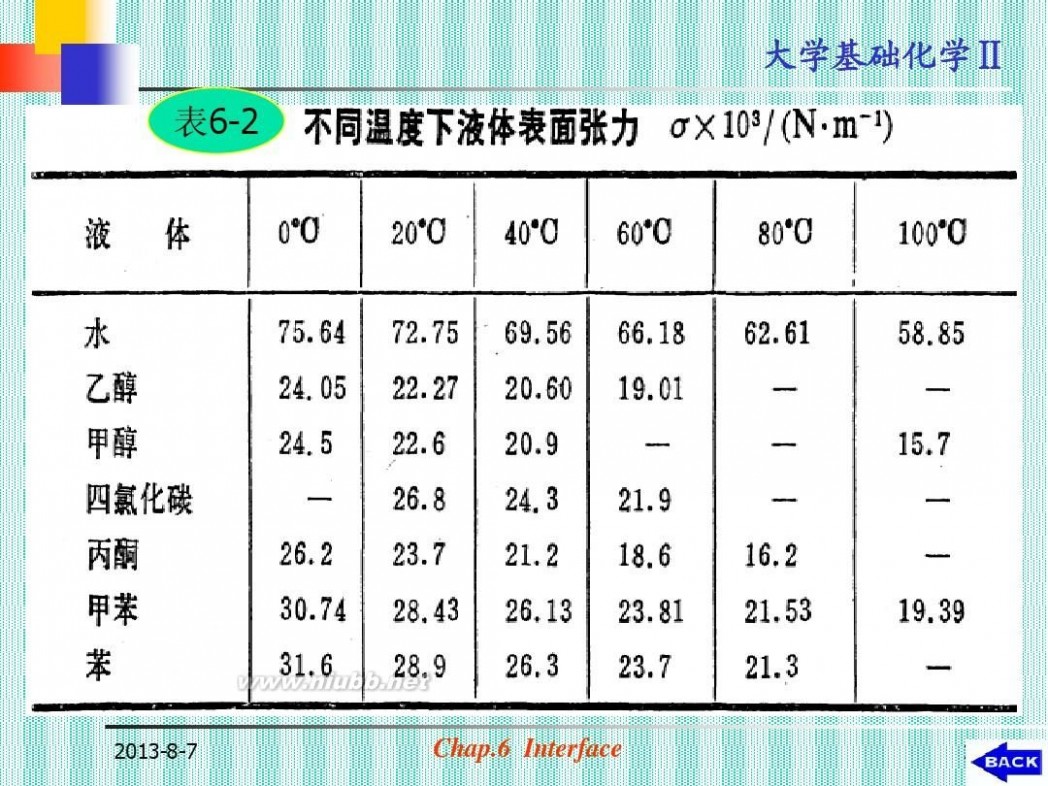
物质内部原子,分子相互作用力大小的 一种反映。 (a)温度的影响: (见表6-2)
一般,温度升高,表面张力下降;
(dγ/dT)<0
H2O: dγ/dT= -0.158×10-3 N· -1· -1 m K
2013-8-7
Chap.6 Interface
11
大学基础化学
Ⅱ 表6-2
2013-8-7
Chap.6 Interface
12
大学基础化学Ⅱ
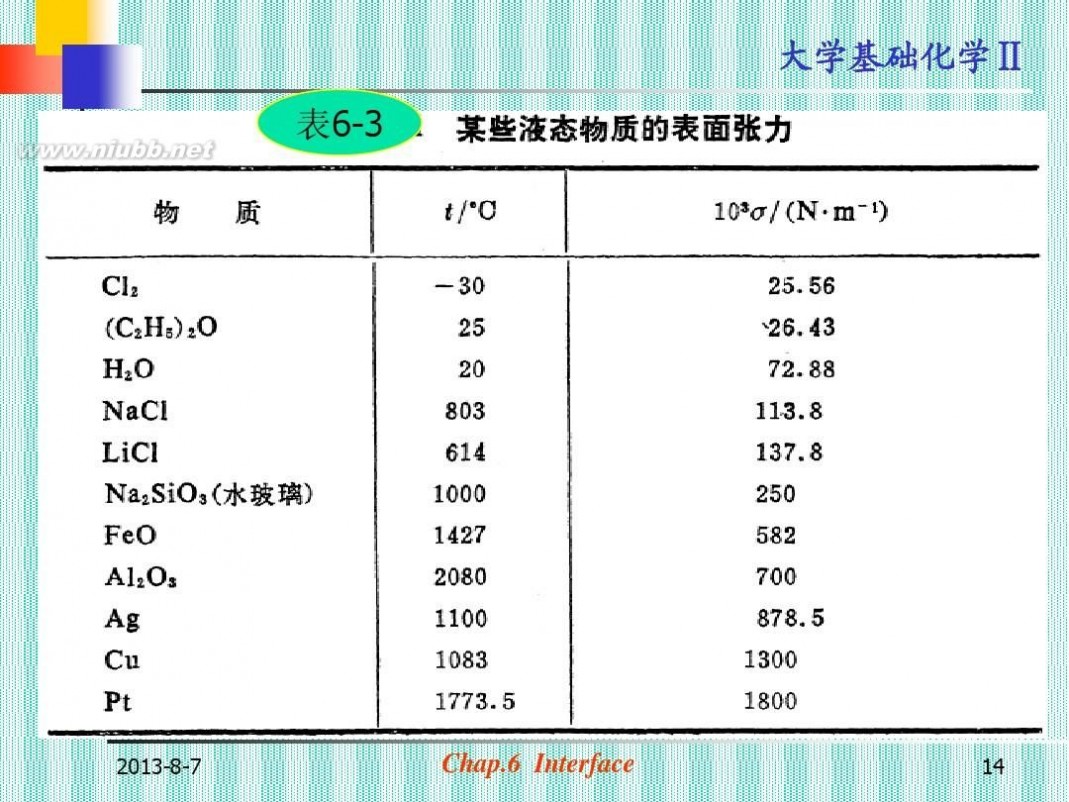
(b)物质本性的影响(见表6-3)
? 相互作用力或化学键力越大, γ越大。
? 一般而言:
金属键>离子键>极性键>非极性键
2013-8-7
Chap.6 Interface
13
大学基础化学Ⅱ 表6-3
2013-8-7
Chap.6 Interface
14
大学基础化学Ⅱ
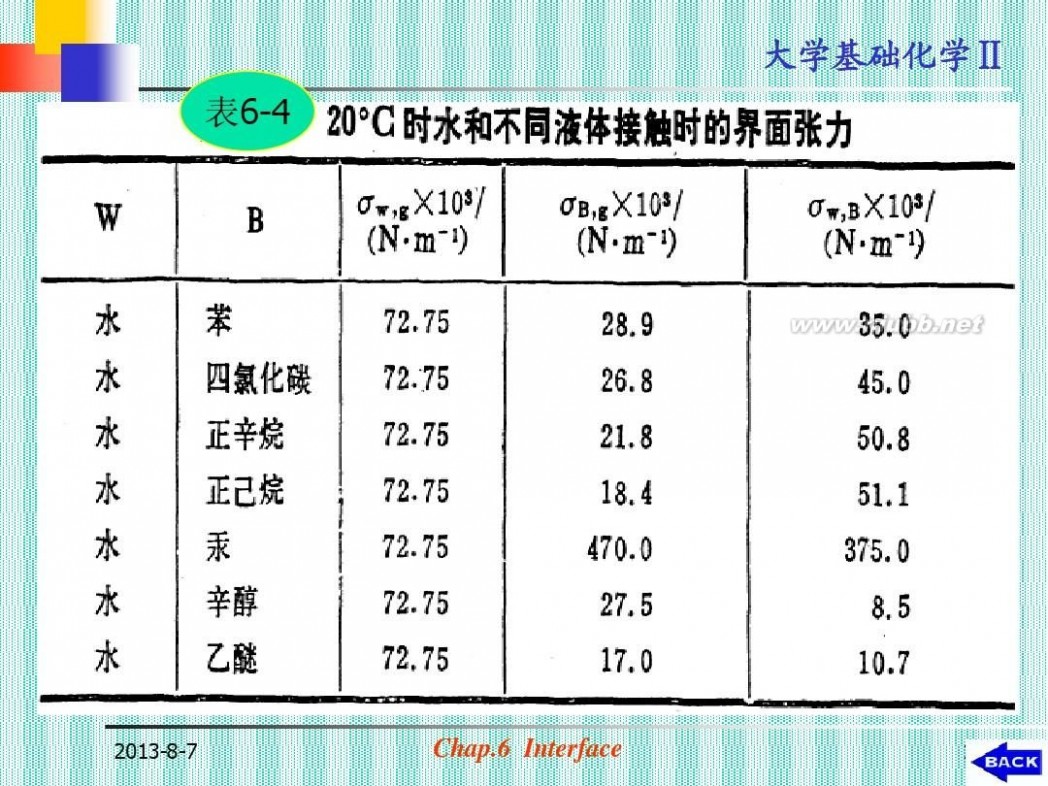
(c)邻接相性质的影响:
? 同一种物质与不同性质的其他物质接触
时,表面分子所处的力场不同,表面张 力出现明显的差异。(见表6-4)
(d)与溶液的组成有关
2013-8-7
Chap.6 Interface
15
大学基础化学Ⅱ
表6-4
2013-8-7
Chap.6 Interface
16
大学基础化学Ⅱ
(四) 界面热力学
(Thermodynamics of Interfacial)
?
对组成可变的高度分散的敞开系统, 热力学基本方程为: dU=TdS-pdV+γdAs+ΣμBdnB
?
?
dG=-SdT+Vdp+γdAS+ΣμB dnB
? ?U ? ?? ? ?A ? S ? ? ? ? S ,V ,n j ? ?G ? ?? ? ?A ? S ? ? ? ?T , p ,n j
17
2013-8-7
Chap.6 Interface
大学基础化学Ⅱ
?γ等于在等温等压下,增加单位表面
时系统吉布斯函数的增量---比界面吉 布斯函数。 ? 高度分散的系统中,界面能不能忽
视:G=GB+GS (B:bulk;S:surface)
2013-8-7
Chap.6 Interface
18
大学基础化学Ⅱ
在等温等压定组成下:
dG = dGS= d(γAs)
= γdAs + Asdγ
(a) γ一定:dAs<0,dG<0 自发 (b)As 一定:dγ<0,dG<0 自发 (c)As, γ均变化:润湿现象
2013-8-7
Chap.6 Interface
19
大学基础化学Ⅱ
?烧杯烧水,水壶烧水 ?纳米材料研究中的重大问题。
2013-8-7
Chap.6 Interface
20
大学基础化学Ⅱ
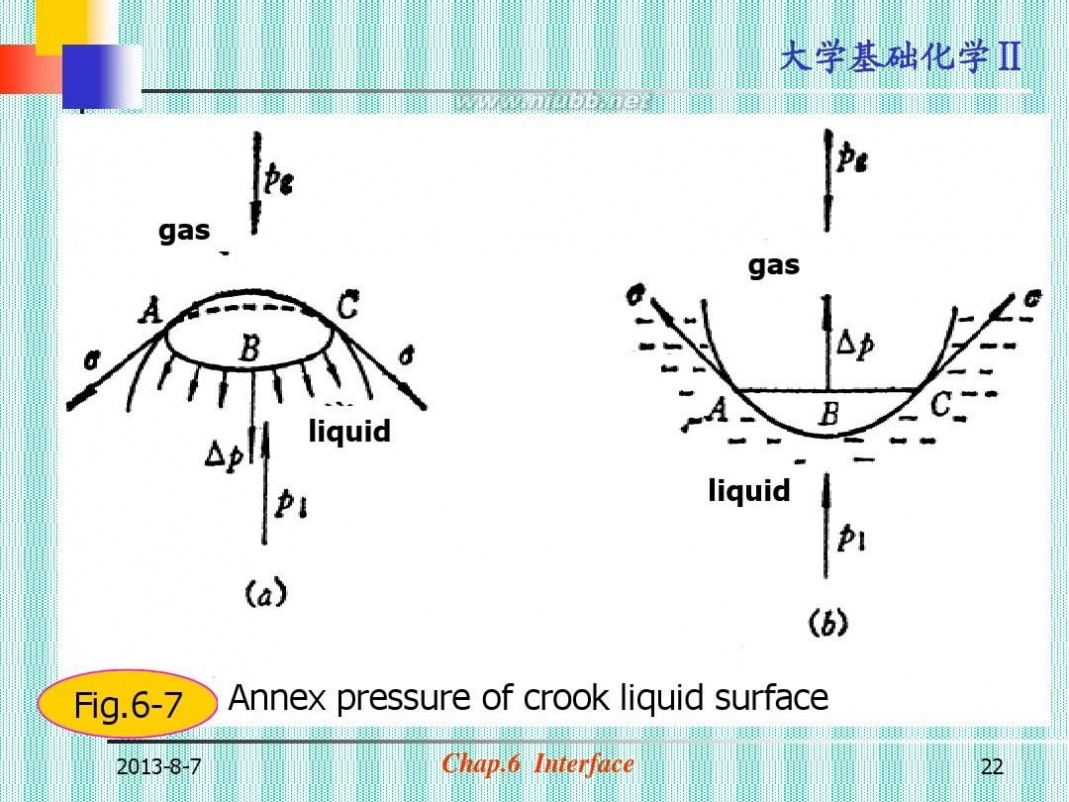
第二节 弯曲液面的附加压力
(一)弯曲液面的附加压力
(二)Laplace方程
(三)毛细现象
(四)表面张力的测定
(五)Kelvin公式和毛细管凝结
(六)亚稳状态和新相的生成
2013-8-7
Chap.6 Interface
21
大学基础化学Ⅱ
gas
gas
liquid
liquid
Fig.6-7
2013-8-7
Annex pressure of crook liquid surface
Chap.6 Interface
22
大学基础化学Ⅱ
(一)弯曲液面的附加压力
(图6-7,图6-8) ?凸面时,合力指向液体,附加压力为(+); pe+ps=pl pl -pe=Δp=ps ? 凹面时,合力指向空间,附加压力为(-); pe=ps+pl pl -pe=-Δp=-ps ? 附加压力即弯曲液面内(液)外(气)的 压力差。
2013-8-7
Chap.6 Interface
23
大学基础化学Ⅱ
Fig.6-8
Fig.6-8
Annex pressure of anomaly shape drop
Chap.6 Interface
24
2013-8-7
大学基础化学Ⅱ
?Droplets: Rayleigh round(Brief Communications, p. 128) 雷利的一个预言得到证实 液滴由于表面张力而趋于成为球形。但如 果一个液滴带了电,如在喷墨打印机和雷 雨云中那样,离子之间的静电排斥作用会 克服表面张力,使得液滴破裂。一个被称 为“雷利极限”的公式给出了一个液滴中 电荷的上限,达到这个极限时,
液滴会形 成细雾,被称为“雷利喷射”。
2013-8-7
Chap.6 Interface
25
大学基础化学Ⅱ
研究人员采用高速显微镜技术对雾化带 电水滴的分解动态进行了研究,所获得的 图像证实了雷利爵士1892年在没有高速显 微镜帮助下所做出的一个预言,即液滴在 分解前第一步是变成椭圆体。但雷利的其 他一些预言却过于牵强。
发件人: "Nature Magazine" 主题: Nature Contents 09 January 2003 (Vol. 421, 97-194) 日期: 2003年1月14日 11:29
2013-8-7
Chap.6 Interface
26
大学基础化学Ⅱ
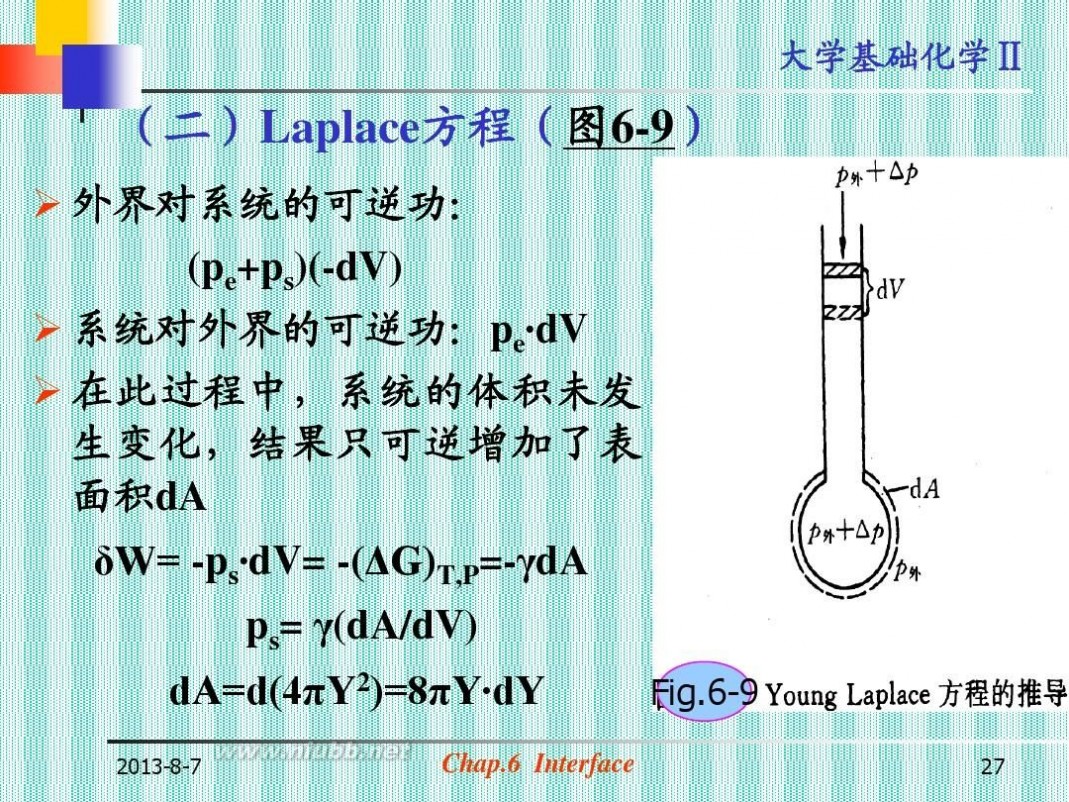
(二)Laplace方程(图6-9)
? 外界对系统的可逆功:
(pe+ps)(-dV)
? 系统对外界的可逆功:pe· dV ? 在此过程中,系统的体积未发 生变化,结果只可逆增加了表 面积dA δW= -ps· dV= -(ΔG)T,P=-γdA ps= γ(dA/dV) dA=d(4πΥ2)=8πΥ·dΥ
2013-8-7
Fig.6-9
27
Chap.6 Interface
大学基础化学Ⅱ
dV=d(4/3πΥ3)=4πΥ2·dΥ
? 讨论:
ps=2 γ/Υ
ps与γ成正比,与曲率半径成反比。
? 液面为凸面(液滴)时, r为(+), ps为(+) ?
液面为凹面(气泡)时, r为(-), ps为(-)
?
?
液面为平面时,
r=∞, ps=0
液面为任意曲面时,ps=γ(1/r1+1/r2)
Young--Laplace Eq.(参见图6-10)
2013-8-7
Chap.6 Interface
28
大学基础化学Ⅱ
Fig.6-10
2013-8-7
Chap.6 Interface
29
大学基础化学Ⅱ
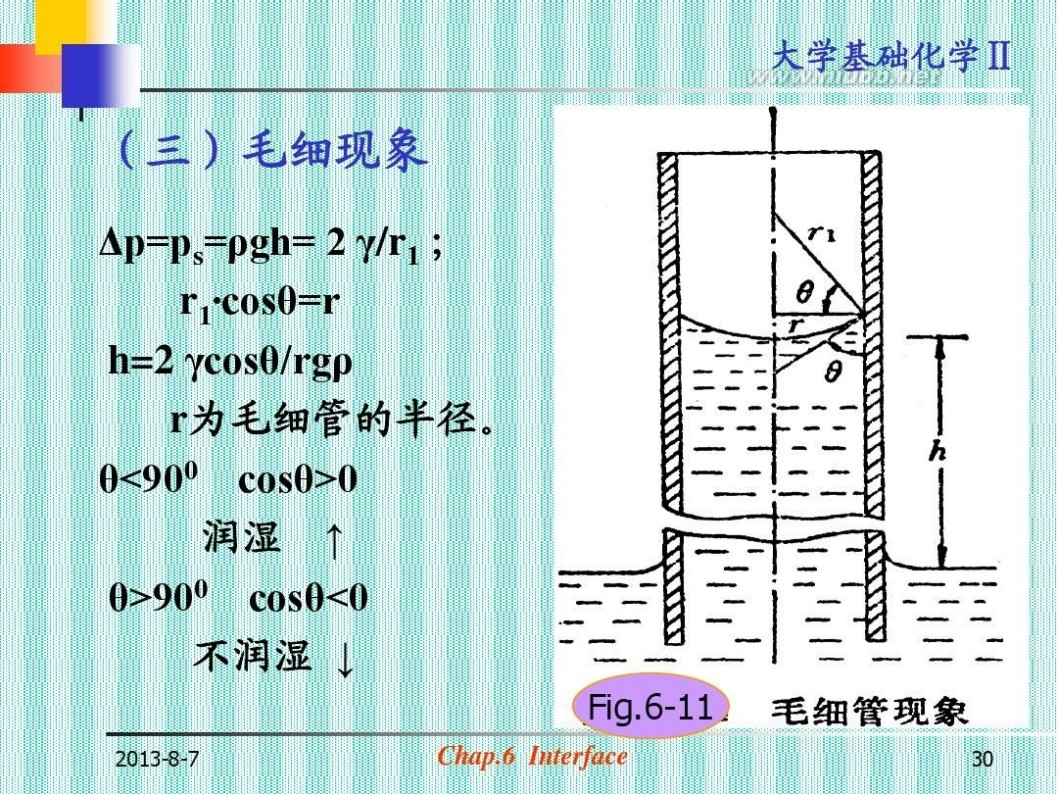
(三)毛细现象
Δp=ps=ρgh= 2 γ/r1 ; r1·cosθ=r h=2 γcosθ/rgρ r为毛细管的半径。 θ<900 cosθ>0 润湿 ↑ θ>900 cosθ<0 不润湿 ↓
Fig.6-11
2013-8-7
Chap.6 Interface
30
大学基础化学Ⅱ
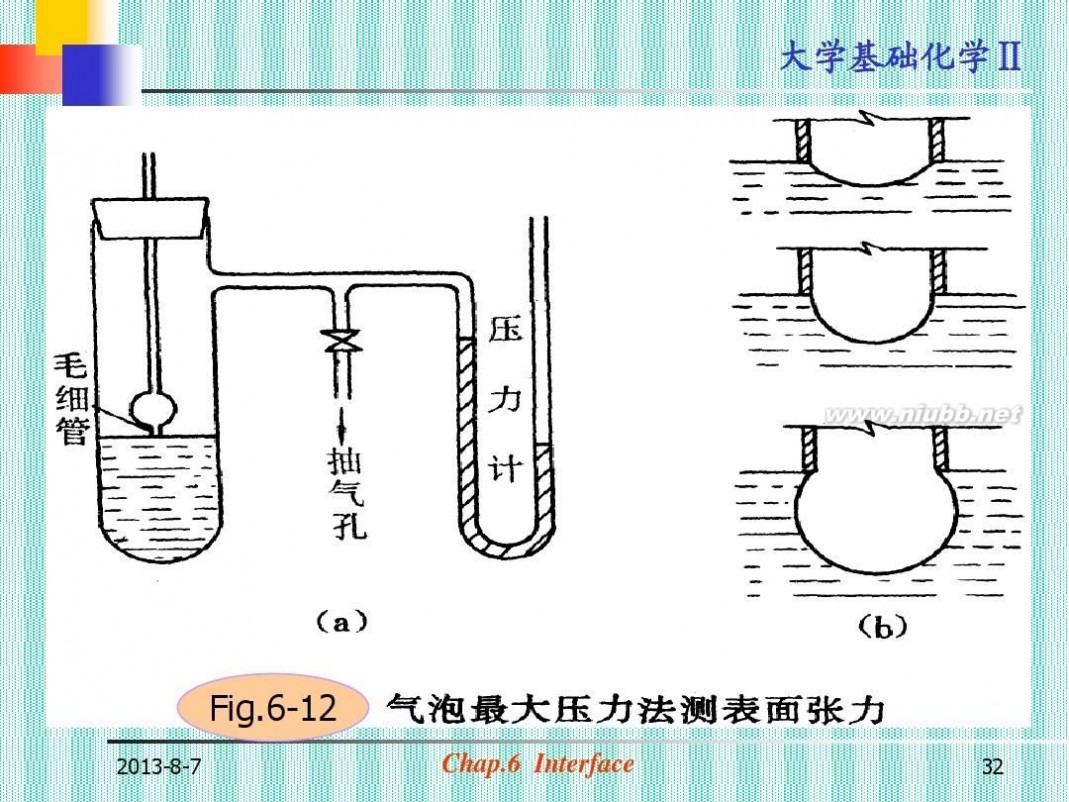
(四)表面张力的测定(图6-12)
(a)毛细管法:
h=2 γcosθ/rgρ
(b)最大气泡压力法: ps=2 γ/r
2013-8-7
Chap.6 Interface
31
大学基础化学Ⅱ
Fig.6-12
2013-8-7
Chap.6 Interface
32
大学基础化学Ⅱ
(五)Kelvin公式和毛细管凝结
Kelvin公式: ln(pr/p)=2 γM/ρRTr ? pr:温度T,曲率半径为r的液面蒸气压 ? p: 温度T时,平液面蒸气压 ? M:液体物质的摩尔质量 ? ρ:温度T时,液体物质的密度
2013-8-7
Chap.6 Interface
33
大学基础化学Ⅱ
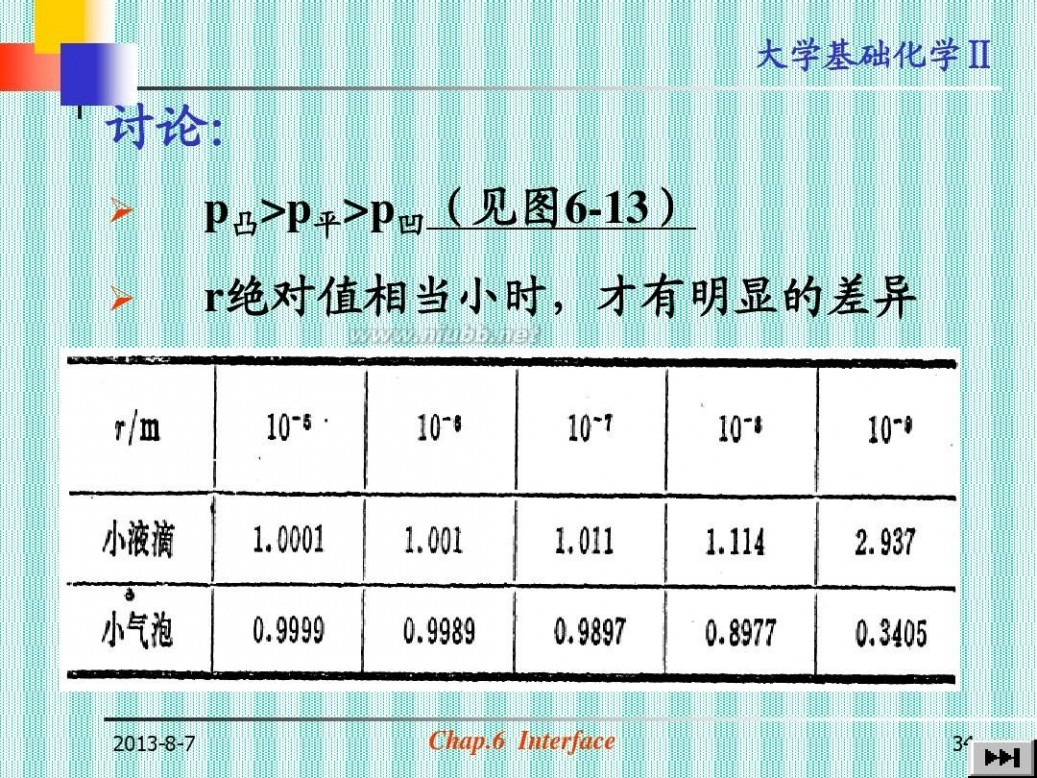
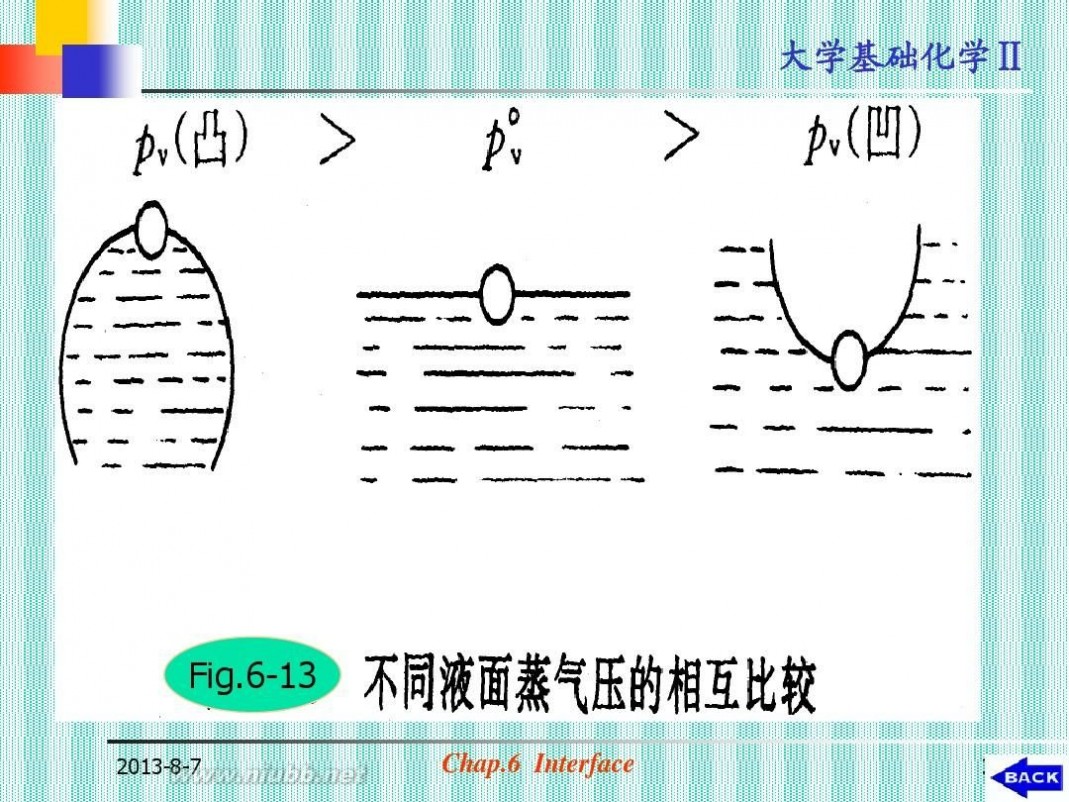
讨论:
? ?
p凸>p平>p凹(见图6-13) r绝对值相当小时,才有明显的差异
2013-8-7
Chap.6 Interface
34
大学基础化学Ⅱ
Fig.6-13
2013-8-7
Chap.6 Interface
35
大学基础化学Ⅱ
毛细管凝结
?在某温度下,蒸气对平液面尚未达到饱 和,但对毛细管内的凹液面已达过饱和 状态,蒸气凝结为液体。
? 应用:
2013-8-7
Chap.6 Interface
36
大学基础化学Ⅱ
微小晶体的溶解度 ? 改变固体颗粒的大小,会使溶解度发生变 化,这是由表面张力引起的另一种界面现 象。其关系式类似于Kelvin公式
ln(xB,r/xB)=2γM/RTρr
?
xB ,ρ,M,r 分别为温度为T时,B物 质的正常溶解度,密度,摩尔质量和颗粒 的曲率半径。
Chap.6 Interface
37
2013-8-7
大学
基础化学Ⅱ
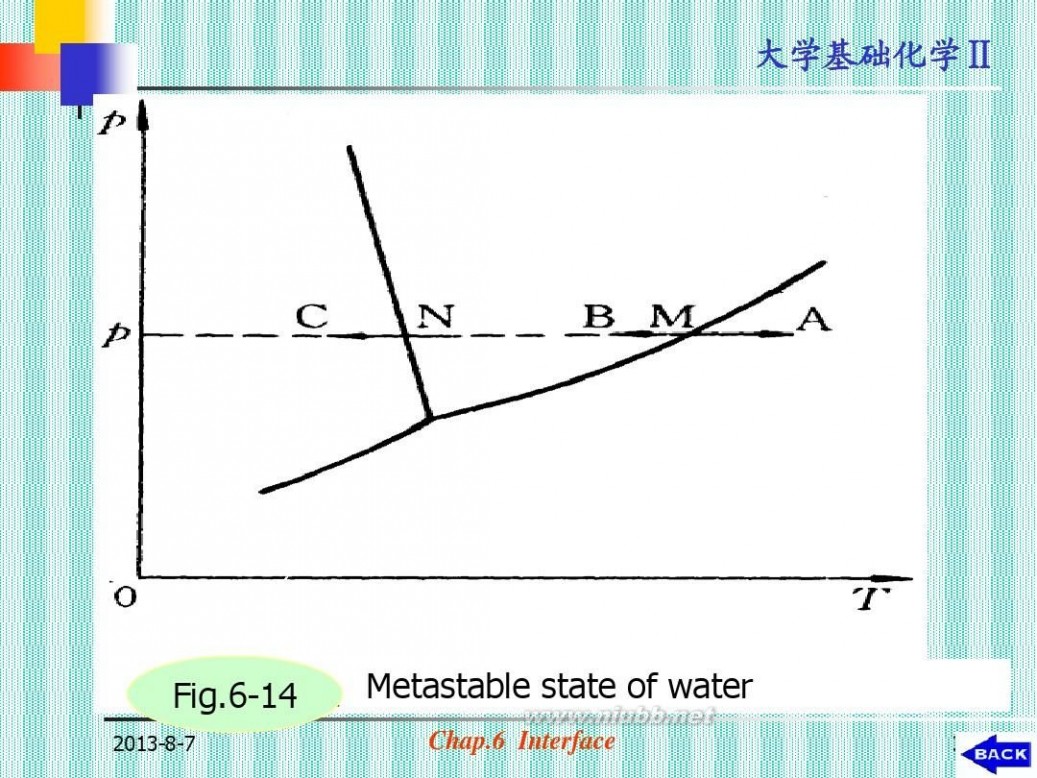
(六)亚稳状态和新相的生成
? (1)过饱和蒸气
?按相平衡条件应凝结而未凝结的蒸气
(图6-14):t=200C, pH2O=3167Pa, 空 气中 3400Pa, r=10-8, 3728Pa
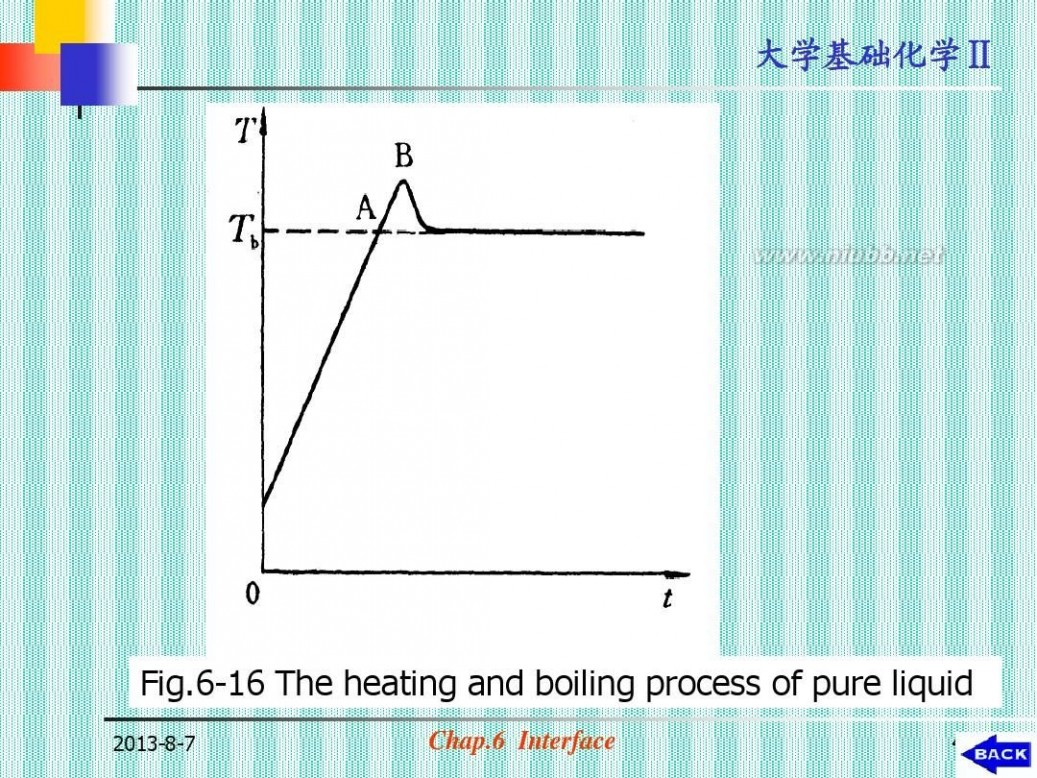
? (2)过热液体
? 按相平衡条件应沸腾而未沸腾的液体。
(见图6-15,图6-16)
2013-8-7
Chap.6 Interface
38
大学基础化学Ⅱ
Fig.6-14
2013-8-7
Metastable state of water
Chap.6 Interface
39
大学基础化学Ⅱ
Fig.6-15
2013-8-7
Chap.6 Interface
40
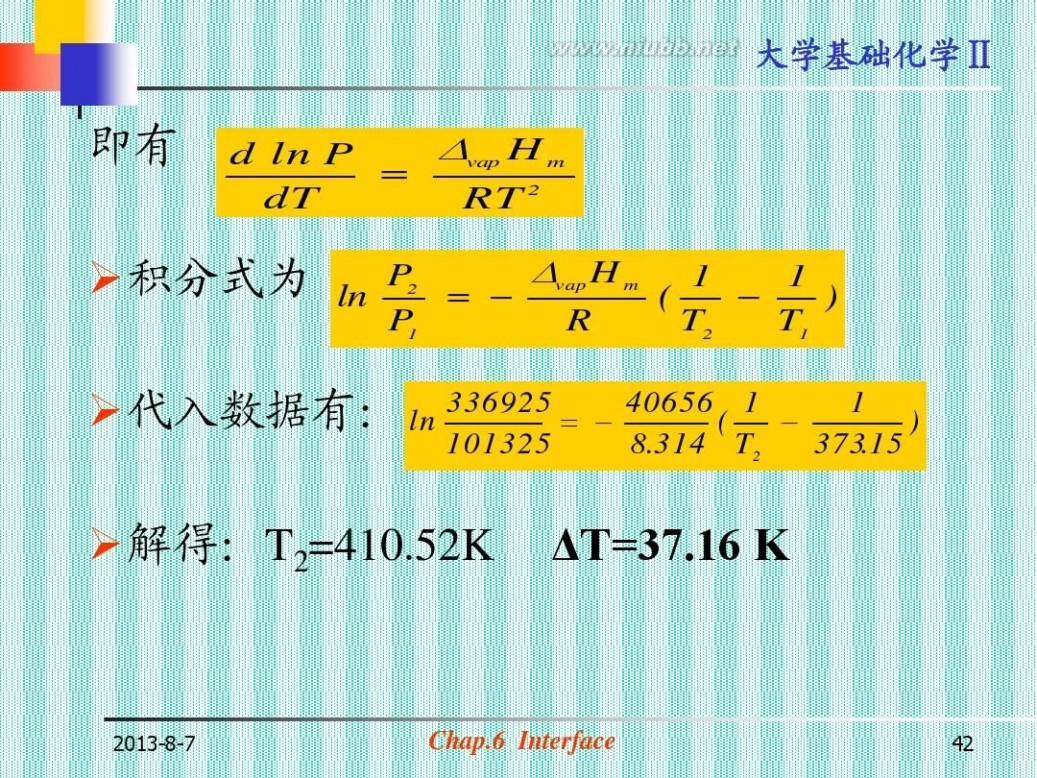
大学基础化学Ⅱ 例:正常沸点时,如水中离液面0.20m深处,仅含半
径为5.0×10-7m的气泡,问使这样的水沸腾需过热 多少度?已知水在100℃时的表面张力 σ=58.9mN·m-1,ΔvapHm=40656J· -1。 mol 解:小气泡内部的压力:p内=水的蒸气压<pθ Kelvin公式: pr 2?M 3
ln p0 ?
?RTr
? ?1.367 ? 10 ; pr ? 99.86kPa
p外=p0+ps+ρgh ρgh=1000×9.80 ×0.20=1.96kPa ps=2 ×58.9 ×10-3/5.0 ×10-7=235.6kPa p外≈101.3+235.6 =336.9kPa
2013-8-7
Chap.6 Interface
41
大学基础化学Ⅱ
即有
?vap H m d ln P ? dT RT 2
?vap H m P2 1 1 ln ? ? ( ? ) P1 R T2 T1
? 40656 1 1 ( ? ) 8.314 T2 373.15
?积分式为
?代入数据有: ln 336925 ?
101325
?解得:T2=410.52K
ΔT=37.16 K
2013-8-7
Chap.6 Interface
42
大学基础化学Ⅱ
Fig.6-16 The heating and boiling process of pure liquid
2013-8-7
Chap.6 Interface
43
大学基础化学Ⅱ
? γ
? dAs<0; dγ<0 ? ps=2 γ/Υ ? ln(pr/p)=2 γM/ρRTr ? 过饱和蒸气 ? 过热液体
2013-8-7
Chap.6 Interface
44
大学基础化学Ⅱ
(3)过冷液体: 按相平衡条件应凝固而未 凝固的液体(见图6-17) (4)过饱和溶液: 按相平衡条件应析出溶 质晶体而未析出的溶液。 ? 以上各种过饱和状态下的系统,都不是真 正热力学平衡态,从热力学角度看都不是 稳定的,称之为亚稳(定)状态。
? 原因:界面张力存在,新相生成困难。
2013-8-7
Chap.6 Interface
45
大学基础化学Ⅱ
Fig.6-17 Liquid super-cooling phenomenon
2013-8-7
Chap.6 Interface
46
大学基础化学Ⅱ
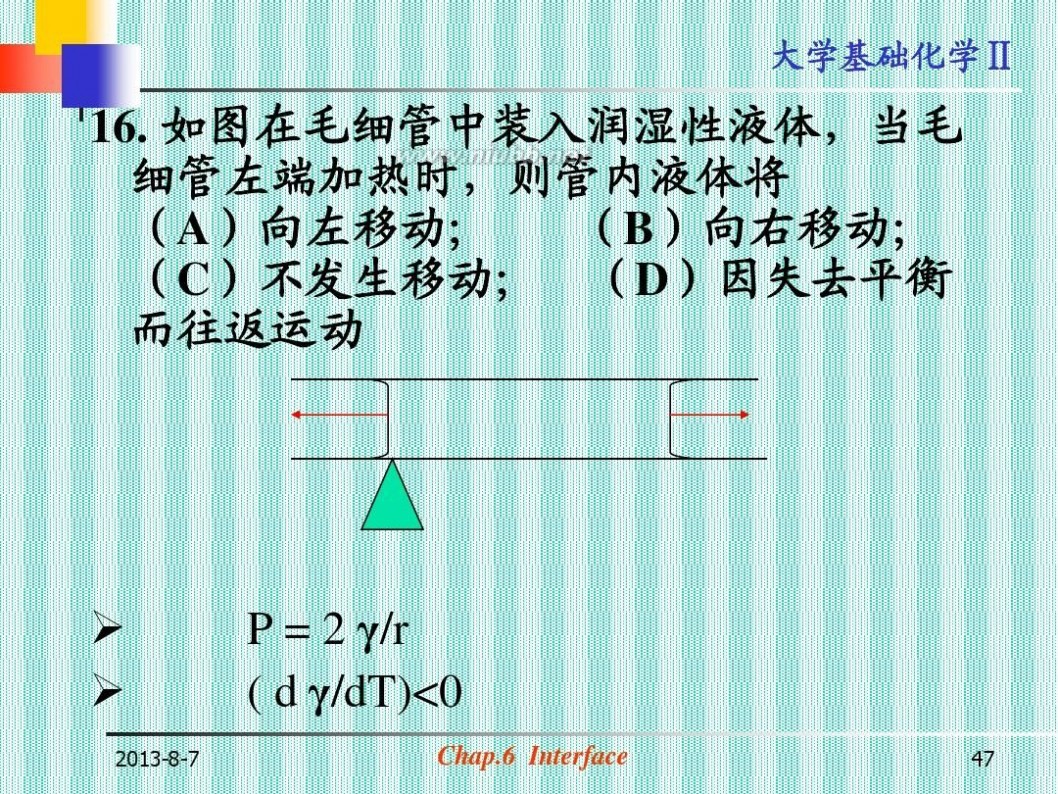
16. 如图在毛细管中装入润湿性液体,当毛 细管左端加热时,则管内液体将 (A)向左移动; (B)向右移动; (C)不发生移动; (D)因失去平衡 而往返运动
? ?
2013-8-7
P = 2 γ/r ( d γ/dT)<0
Chap.6 Interface
47
大学基础化学Ⅱ
第三节 固体表面上的吸附作用
Adsorption on Solid Surface
2013-8-7
Chap.6 Interface
48
大学基础化学Ⅱ
图6-18
2013-8-7
Chap.6 Interface
49
大学基础化学Ⅱ
?固体表面层分子受力是不对称的。 ?界面热力学:在恒温恒压下
dG ? Ad? ? ?dA
d γ<0,自发, ? 对固体而言, 第二相为液体,润湿和铺展; 为气体, 吸附作用。
2013-8-7
Chap.6 Interface
50
大学基础化学Ⅱ
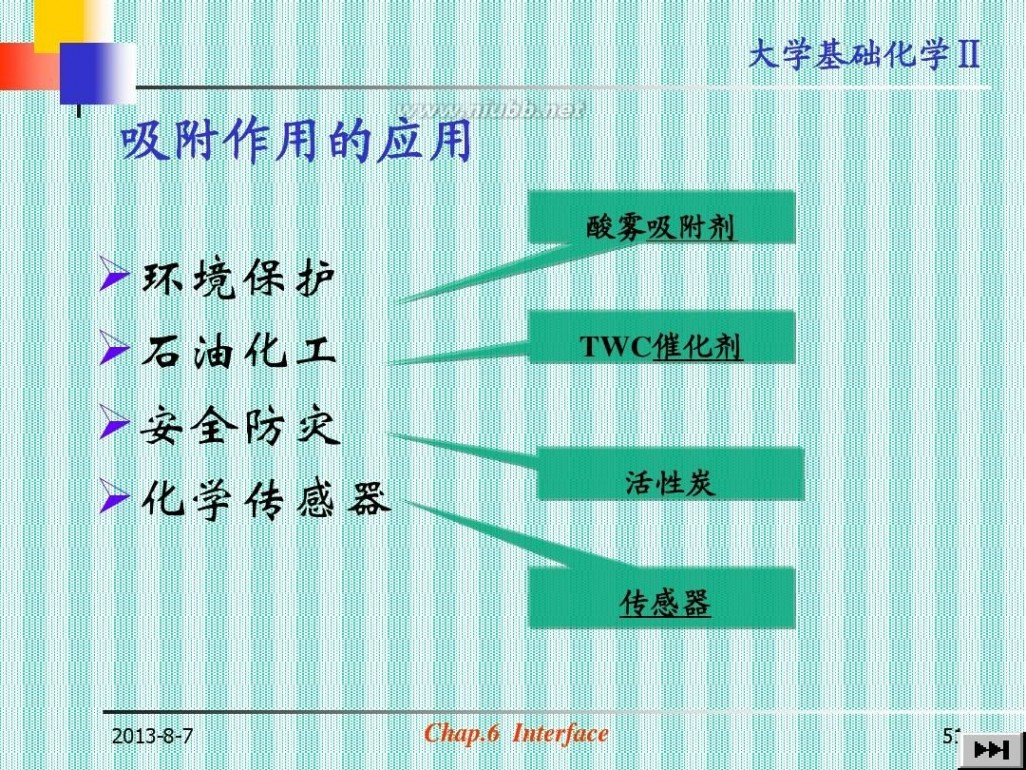
吸附作用的应用
酸雾吸附剂
?环境保护 ?石
油化工 ?安全防灾 ?化学传感器
TWC催化剂
活性炭
传感器
2013-8-7
Chap.6 Interface
51
大学基础化学Ⅱ
附图1
2013-8-7
酸雾吸附剂
52
Chap.6 Interface
大学基础化学Ⅱ
附图2
2013-8-7
TWC催化转化器
Chap.6 Interface
53
大学基础化学Ⅱ
附图3
2013-8-7
TWC堇青石载体
Chap.6 Interface
54
大学基础化学Ⅱ
附图4 催化转 化器在汽车中 的应用
2013-8-7
Chap.6 Interface
55
大学基础化学Ⅱ
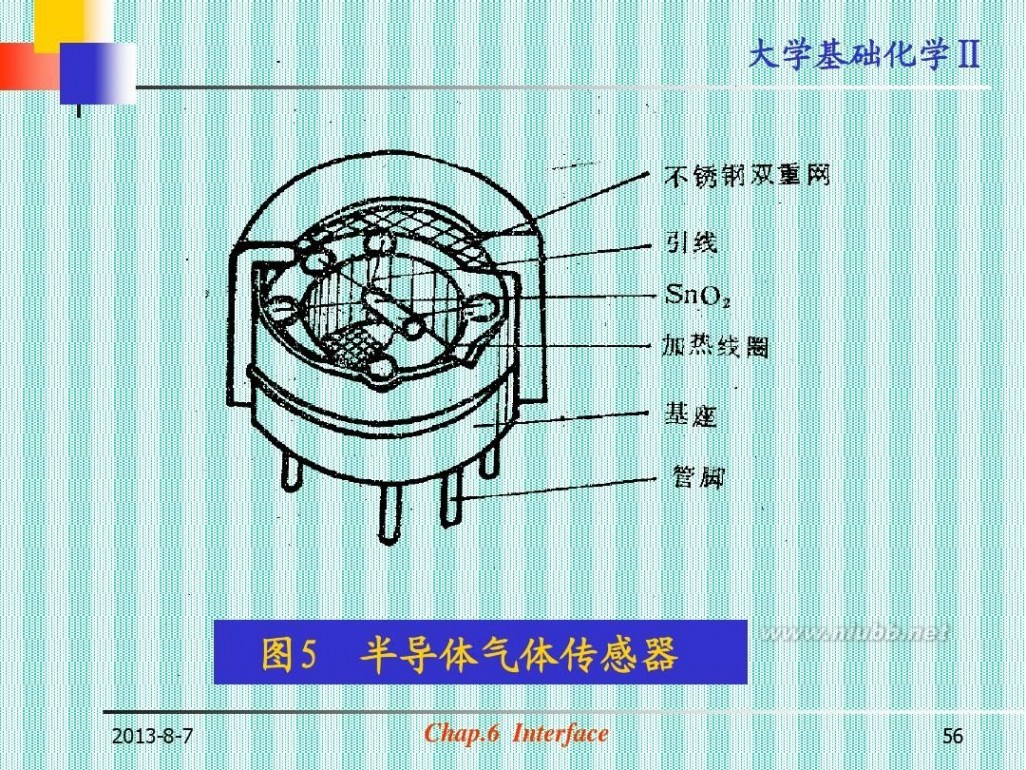
图5
2013-8-7
半导体气体传感器
Chap.6 Interface
56
大学基础化学Ⅱ
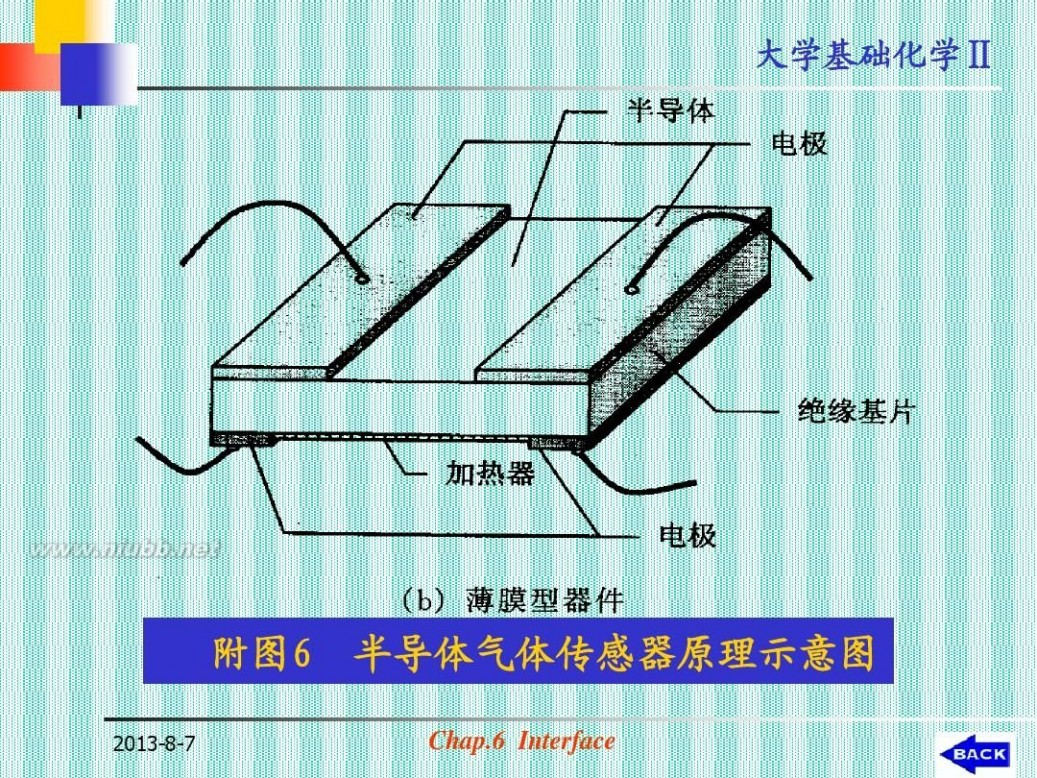
附图6
2013-8-7
半导体气体传感器原理示意图
Chap.6 Interface
57
大学基础化学Ⅱ
附图7
2013-8-7
长沙马王堆汉墓陈列馆
Chap.6 Interface
58
大学基础化学Ⅱ
附图8 马王堆西汉女尸
2013-8-7
Chap.6 Interface
59
大学基础化学Ⅱ
附图9 马王堆女 尸复原图像
2013-8-7
Chap.6 Interface
60
大学基础化学Ⅱ
1971年,基辛格博士为恢复中美外交关系秘密 访华。在一次正式谈判尚未开始之前,基辛格突然 向周恩来总理提出一个要求:“尊敬的总理阁下, 贵国马王堆一号汉墓的发掘成果震惊世界,那具女 尸确是世界上少有的珍宝啊!本人受我国科学界知 名人士的委托,想用一种地球上没有的物质来换取 一些女尸周围的木炭,不知贵国愿意否?”
2013-8-7
Chap.6 Interface
61
大学基础化学Ⅱ
? ? ? ? ?
本节主要内容: 1. 吸附作用和吸附曲线 2. 等温吸附经验式 3. 吸附的本质 4. Langmuir单分子吸附理论 5. BET 公式
2013-8-7
Chap.6 Interface
62
大学基础化学Ⅱ
(一) 吸附作用和吸附曲线
? 吸附作用:某物质在固体表面的浓度 不同于其在体相的浓度。 C6H6/C; C6H6· C; ? 吸附剂(adsorbent) 吸附质(adsorbate) ? 吸附(adsorption) 吸收(absorption ) 吸着(sorption)
2013-8-7
Chap.6 Interface
63
大学基础化学Ⅱ
吸附量(平衡吸附量)
?
Г=X/M X:被吸附气体的物质的量,
M:吸附剂的质量; 单位:mmol·-1 g
?
Г=V/M
V:被吸附气体的体积(STP下) 吸附剂的质量; 单位: dm3·-1 g
2013-8-7
M:
Chap.6 Interface
64
大学基础化学Ⅱ
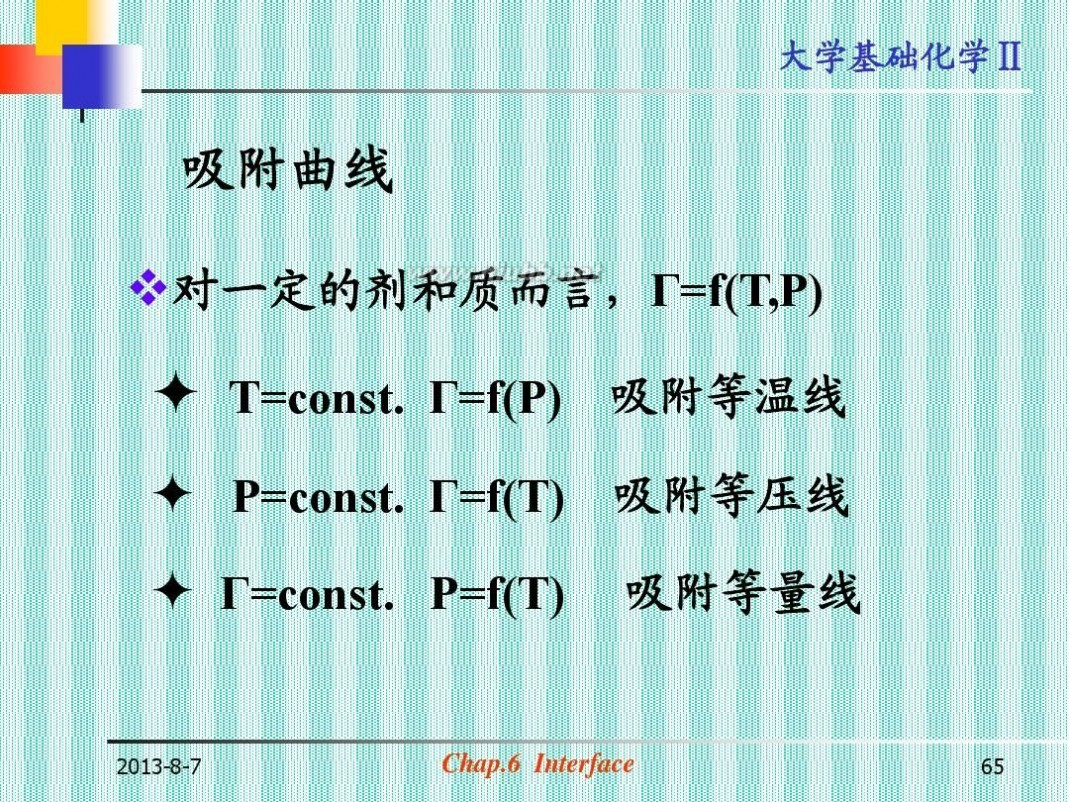
吸附曲线
?对一定的剂和质而言,Г=f(T,P)
? T=const. Г=f(P) 吸附等温线
? P=const. Г=f(T) 吸附等压线
? Г=const. P=f(T)
吸附等量线
2013-8-7
Chap.6 Interface
65
大学基础化学Ⅱ
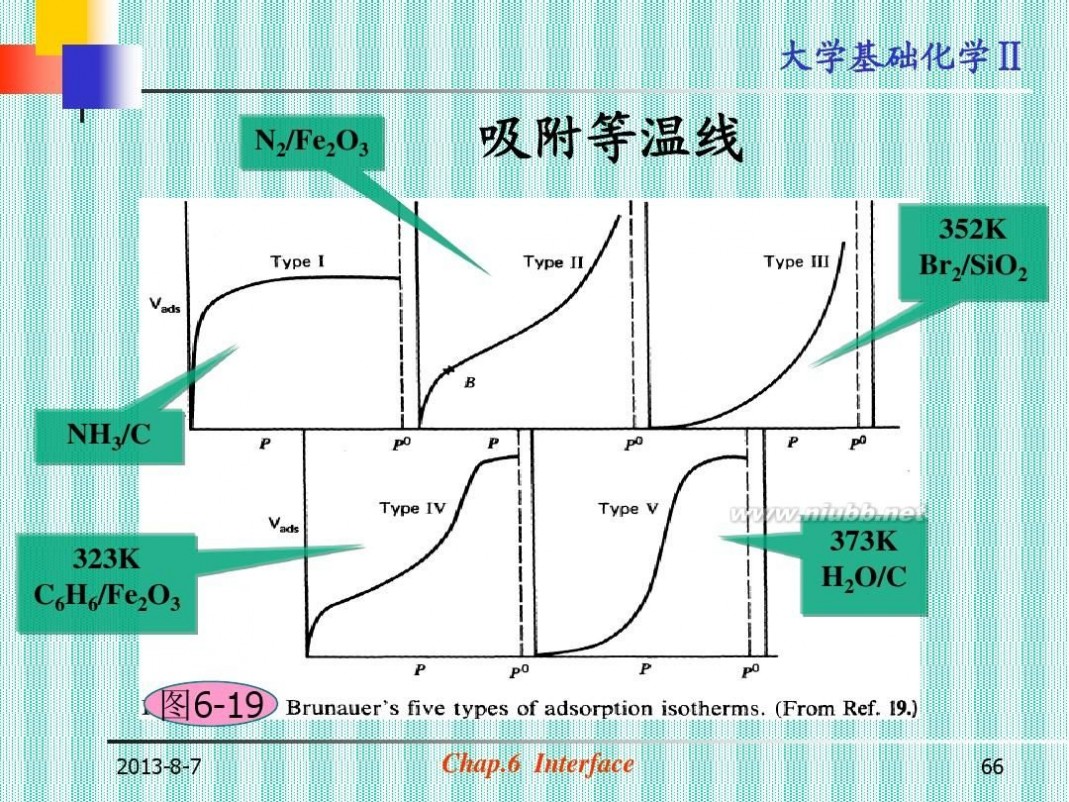
N2/Fe2O3
吸附等温线
352K Br2/SiO2
NH3/C
323K C6H6/Fe2O3
373K H2O/C
图6-19
2013-8-7
Chap.6 Interface
66
大学基础化学Ⅱ
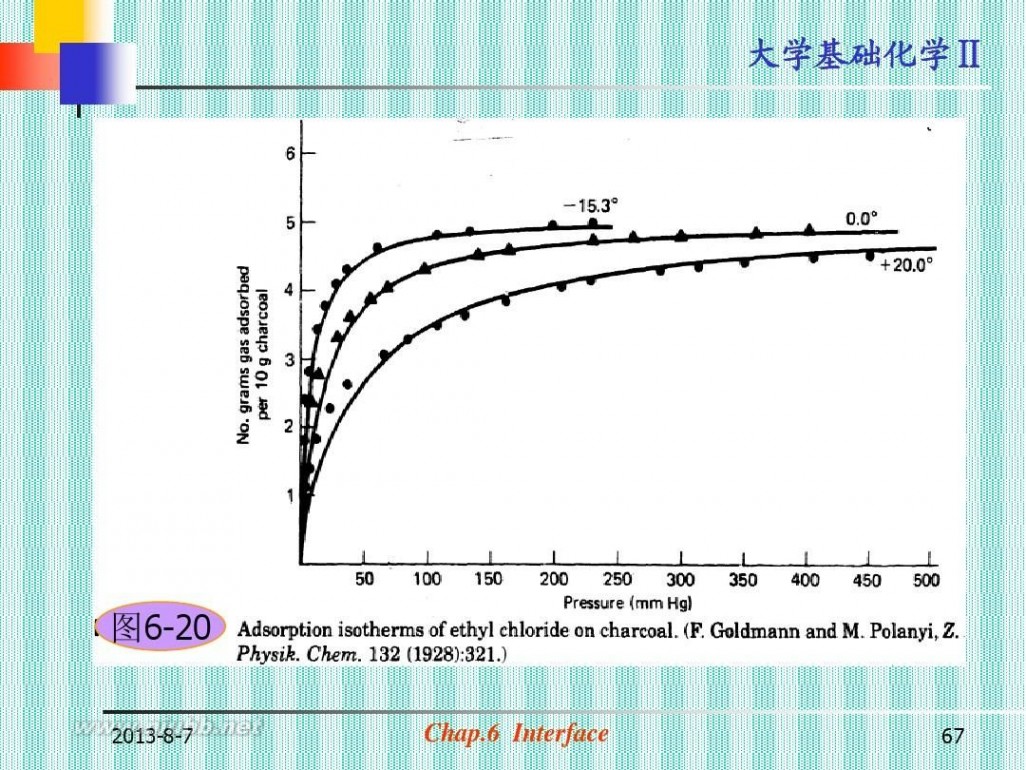
图6-20
2013-8-7
Chap.6 Interface
67
大学基础化学Ⅱ
吸附等压线
g+S=g/S (g· S)
ΔG=ΔH-TΔS
ΔG<0; ΔS<0;
ΔH<0
? T↑, Kθ↓, Г↓
图6-21
2013-8-7
? d ln K ? ? r H m ? dT RT 2
Chap.6 Interface
68
大学基础化学Ⅱ
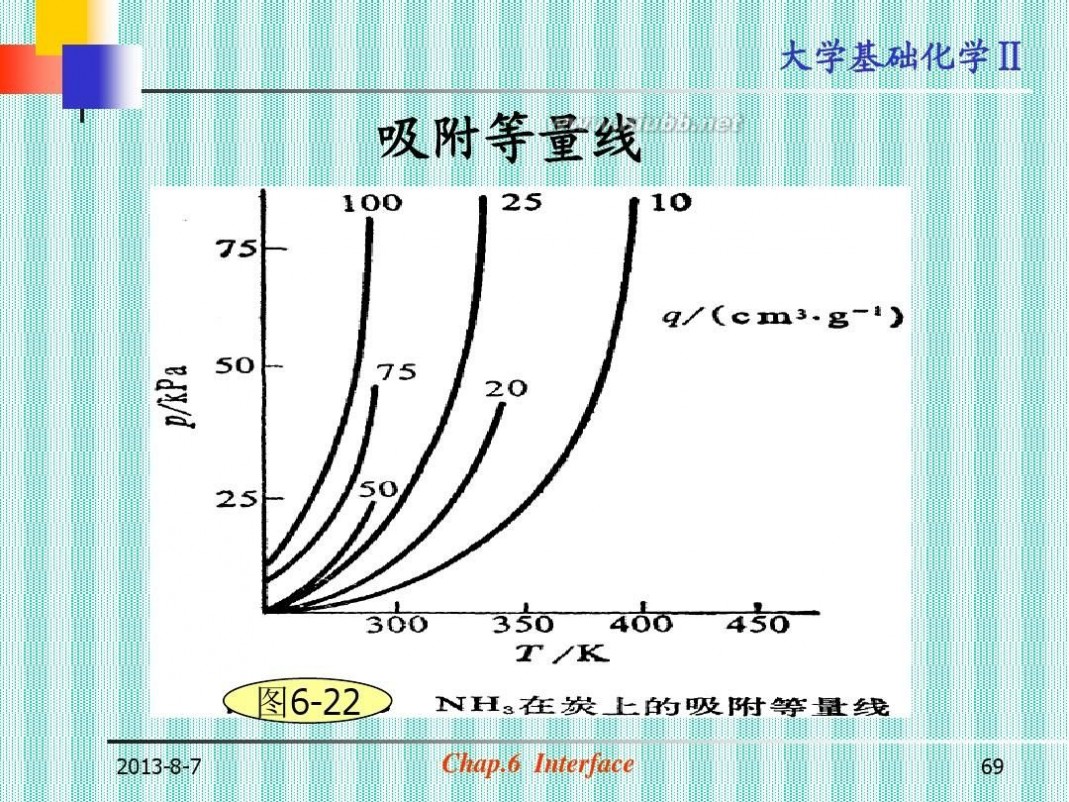
吸附等量线
图6-22
2013-8-7
Chap.6 Interface
69
大学基础化学Ⅱ
三
种吸附曲线互相联 系,从一组某一类型的曲 线可以求出另二类曲线。
2013-8-7
Chap.6 Interface
70
大学基础化学Ⅱ
(二) 等温吸附经验式
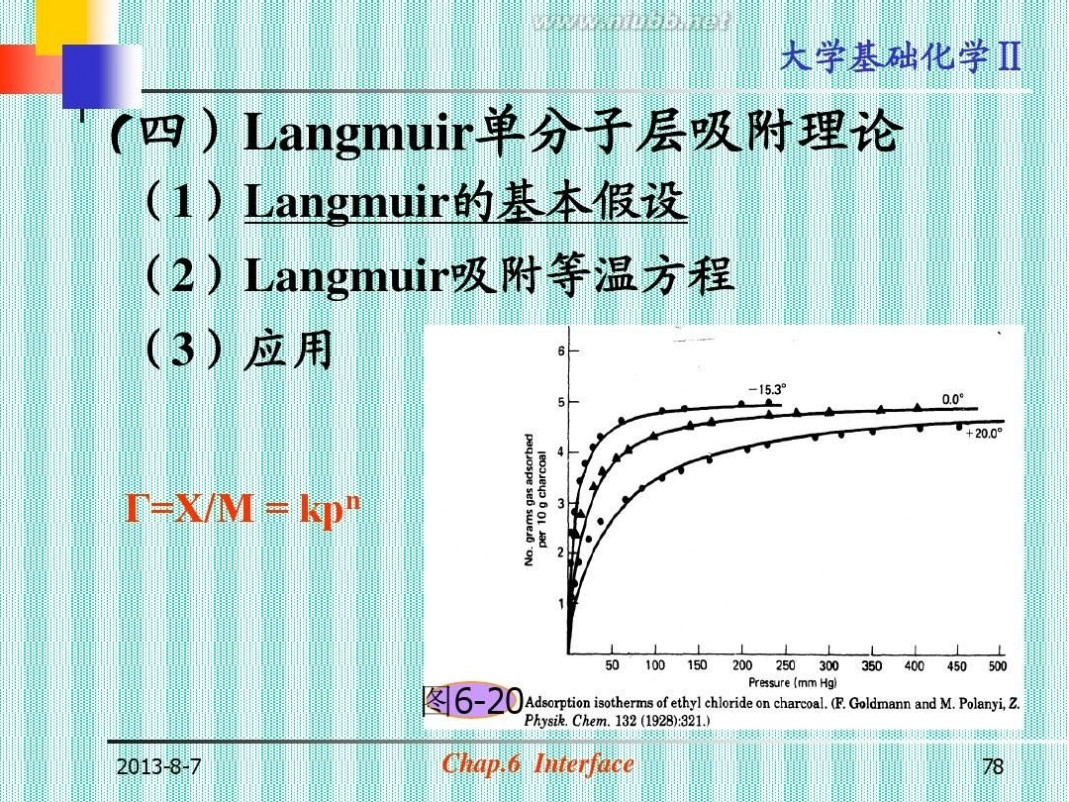
? Freundrich将第一类吸附等温线归纳为
Г=X/M = kPn (n, k为两个经验常数, 对给定系统是温度的函数)
k值:单位压力时的吸附量
n的数值:一般在0-1之间
2013-8-7
Chap.6 Interface
71
大学基础化学Ⅱ
(三) 吸附的本质
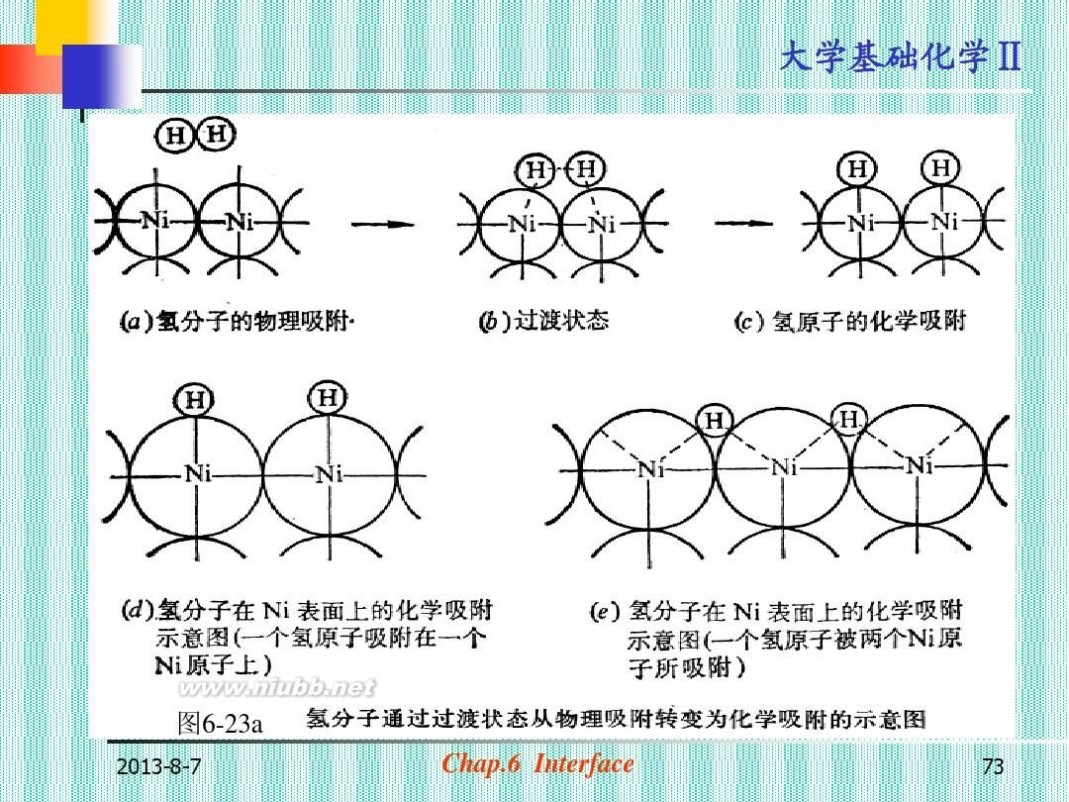
? 按吸附作用力的性质分:
? 物理吸附:范德华力,吸附相当于气
体分子在固体表面的液化。
? 化学吸附:化学键力,吸附时发生电
子的转移或形成电子对,有表面化合
物生成。(图6-23a)
2013-8-7
Chap.6 Interface
72
大学基础化学Ⅱ
图6-23a
2013-8-7
Chap.6 Interface
73
大学基础化学Ⅱ
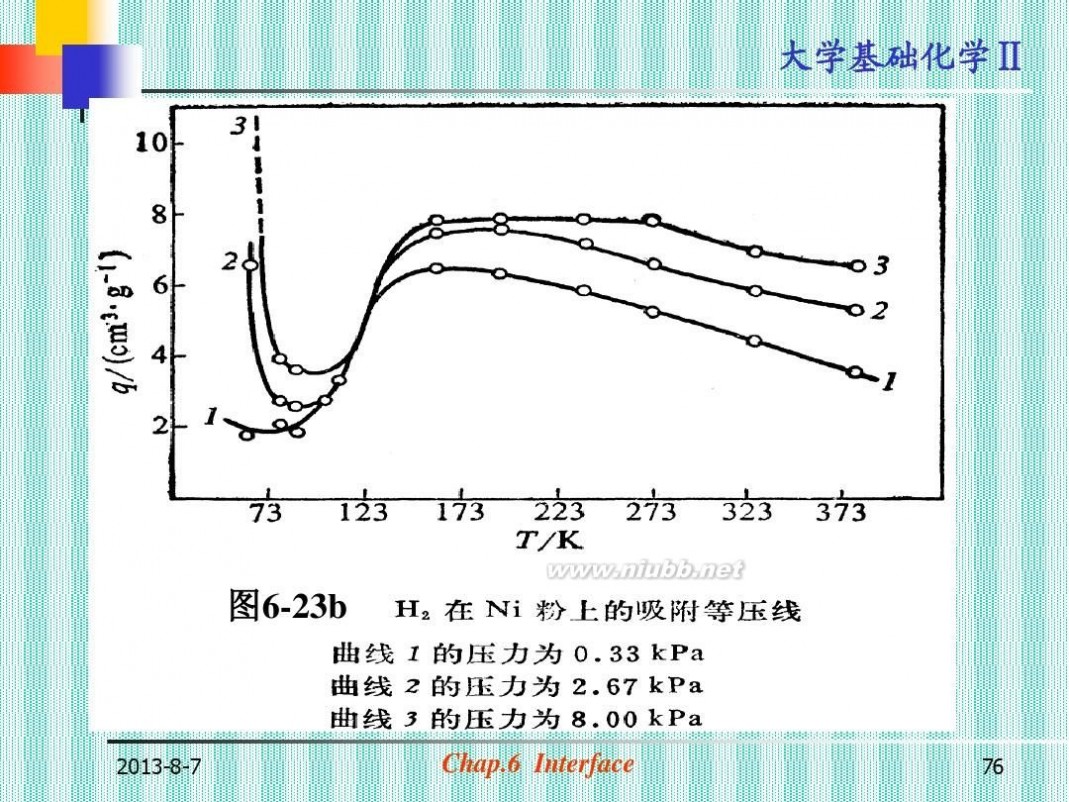
物理吸附和化学吸附宏观现象上的差异: (表6-6) ?物理吸附和化学吸附有区别也有联系: (a)在指定条件下,可以同时发生 (图6-23a) (b)对同一吸附剂和质,条件不同(T)起 主导作用的吸附可以发生变化。
(图6-23b)
2013-8-7
Chap.6 Interface
74
大学基础化学Ⅱ 表6-6
2013-8-7
Chap.6 Interface
75
大学基础化学Ⅱ
图6-23b
2013-8-7
Chap.6 Interface
76
大学基础化学Ⅱ
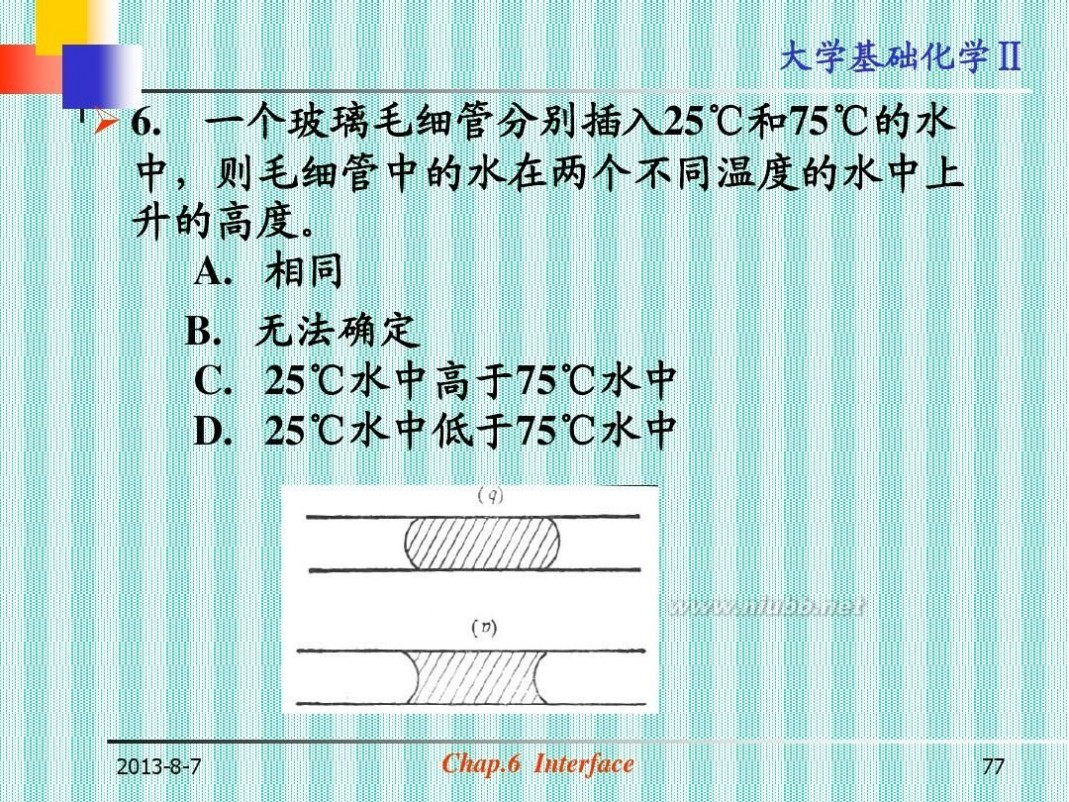
? 6. 一个玻璃毛细管分别插入25℃和75℃的水 中,则毛细管中的水在两个不同温度的水中上 升的高度。 A. 相同 B. 无法确定 C. 25℃水中高于75℃水中 D. 25℃水中低于75℃水中
2013-8-7
Chap.6 Interface
77
大学基础化学Ⅱ
(四)Langmuir单分子层吸附理论
(1)Langmuir的基本假设 (2)Langmuir吸附等温方程
(3)应用
Г=X/M = kpn
图6-20
2013-8-7
Chap.6 Interface
78
大学基础化学Ⅱ
(1)Langmuir的基本假设
?吸附是单分子层的; ?固体表面是均匀的;各处的吸附能力 相同,吸附热为常数;
?吸附分子间无相互作用;
?吸附是动态平衡:
T=const. g+S(剂)
k1 k-1
g/S
2013-8-7
Chap.6 Interface
79
大学基础化学Ⅱ
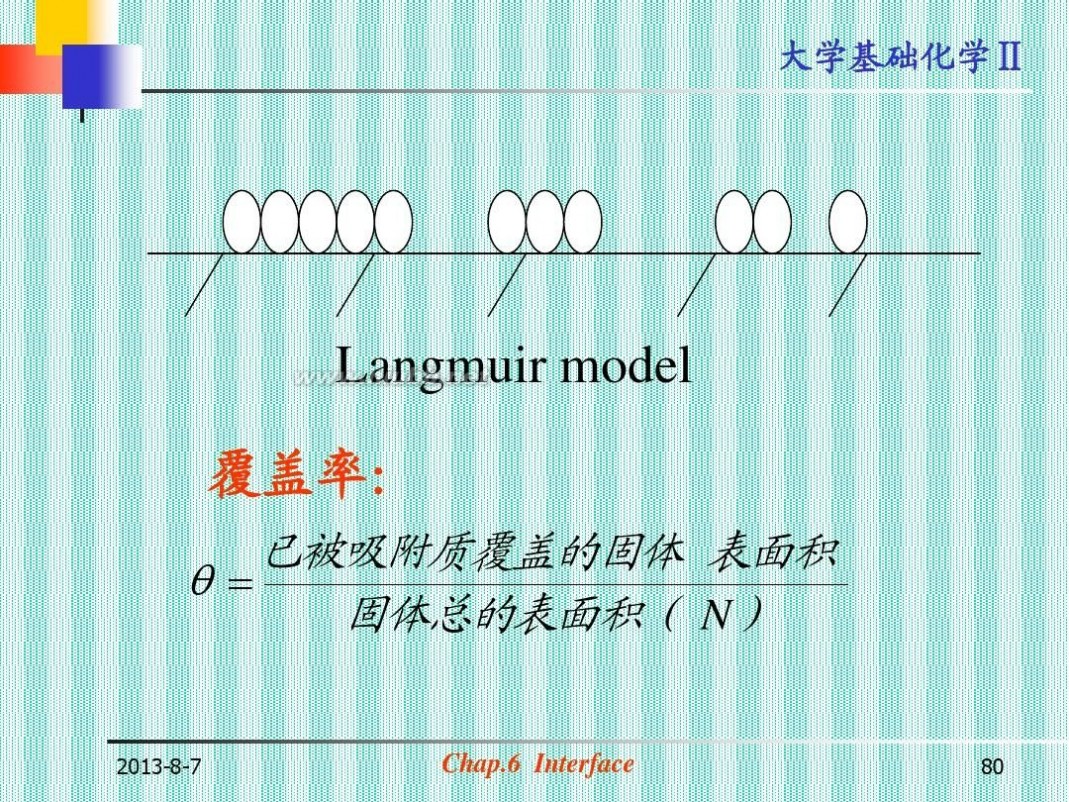
Langmuir model 覆盖率:
已被吸附质覆盖的固体 表面积 ?? 固体总的表面积( N)
2013-8-7
Chap.6 Interface
80
大学基础化学Ⅱ
(2)Langmuir吸附等温方程
? 吸附速率=k1p(1-θ)N (p:气体的分压)
? 脱附速率=k-1θN ? 达平衡时:
k1p(1-θ)N= k-1θN
k1 p bp ?? ? k?1 ? k1 p 1 ? bp
? b=k1/k-1
吸附平衡常数,吸附系数。 (单位:Pa-1)
Chap.6 Interface
81
2013-8-7
大学基础化学Ⅱ
?令Г:覆盖率为θ时的平衡吸附量
?Г∞: 覆盖率为θ=1时的平衡吸附量
?单分子层吸附:
θ=Г/Г∞
bp ? ? ?? 1 ? bp
( Langmuir Eq.)
2013-8-7
Chap.6 Interface
82
大学基础化学Ⅱ
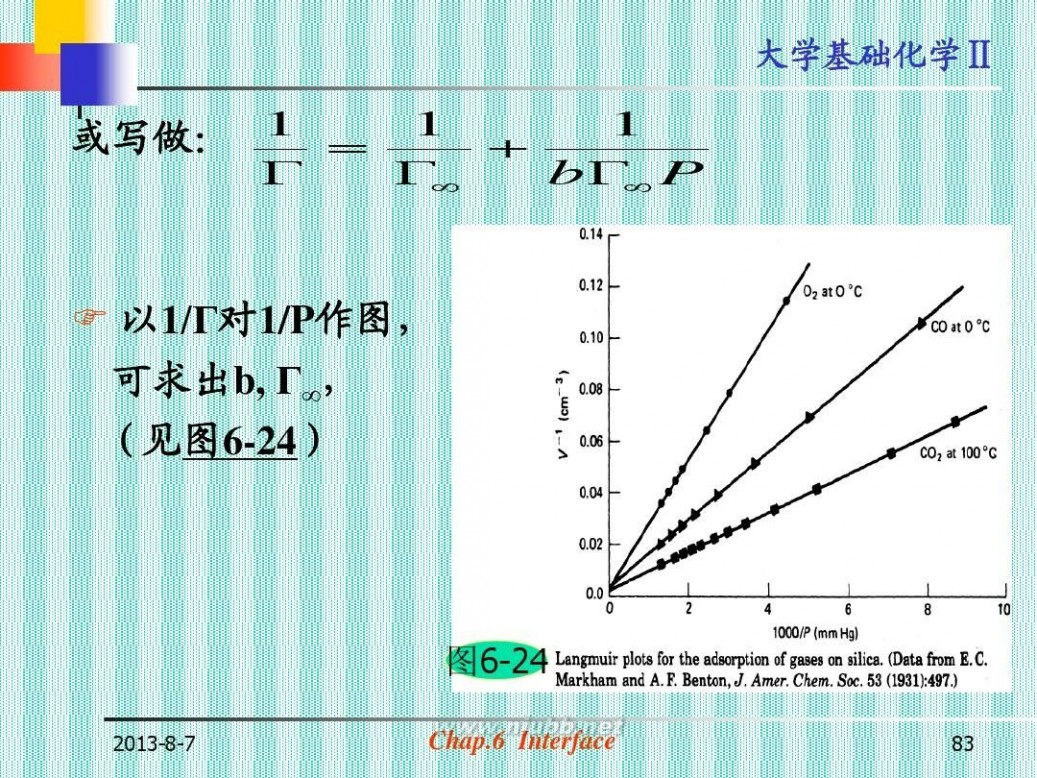
或写做: 1 ?
?
1 1 ? ?? b?? P
? 以1/Г对1/P作图,
可求出b, Г∞,
(见图6-24)
图6-24
2013-8-7
Chap.6 Interface
83
大学基础化学
Ⅱ
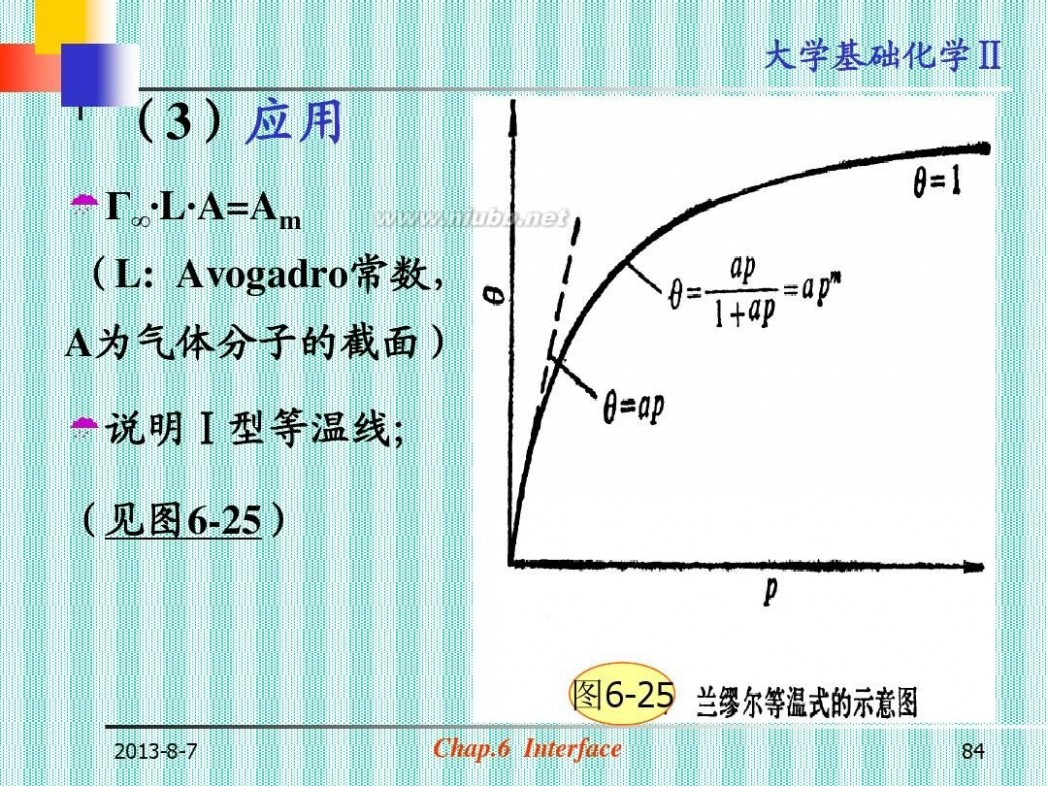
(3)应用
?Г∞· A=Am L·
(L: Avogadro常数,
A为气体分子的截面) ?说明Ⅰ型等温线; (见图6-25)
图6-25
2013-8-7
Chap.6 Interface
84
大学基础化学Ⅱ
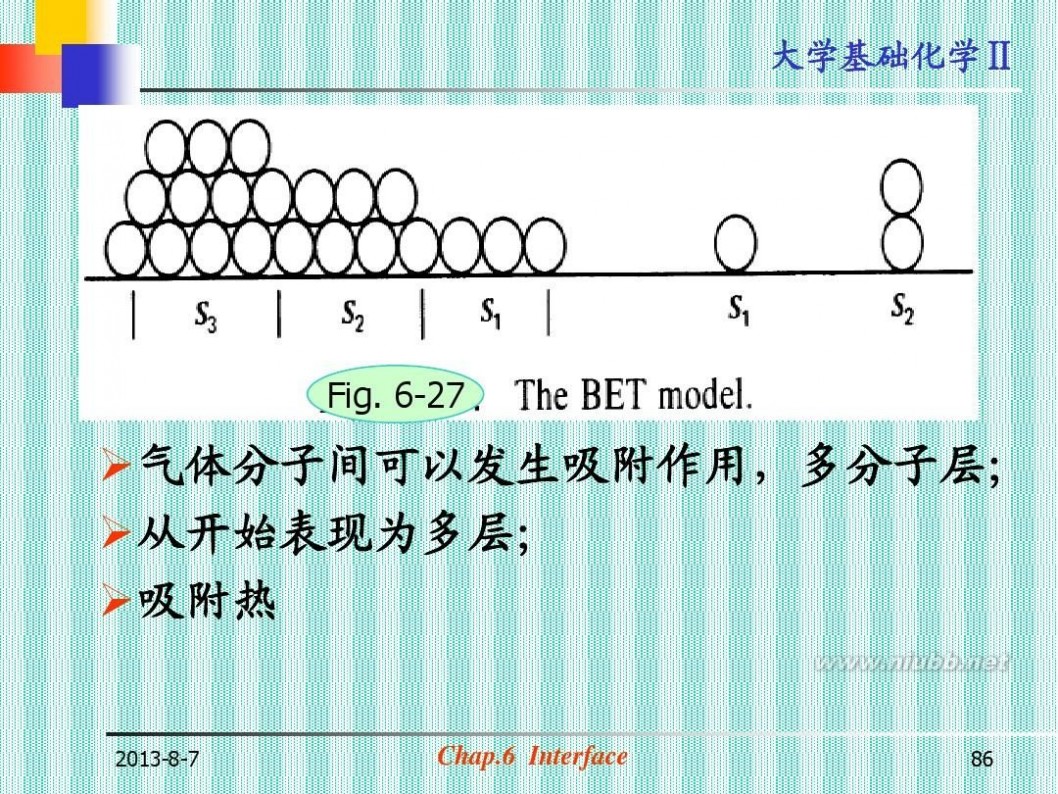
(五)多分子层吸附理论(BET)
Ⅱ,Ⅲ,Ⅳ,Ⅴ型四种类型的等温线 仍无法解释。 1938年, Brunauer S Emmett P H Teller E (图6-27)
2013-8-7
Chap.6 Interface
85
大学基础化学Ⅱ
Fig. 6-27
?气体分子间可以发生吸附作用,多分子层; ?从开始表现为多层; ?吸附热
2013-8-7
Chap.6 Interface
86
大学基础化学Ⅱ
BET的假设:
?吸附是多分子层的; ?固体表面是均匀的;各处的吸附能力相 同;
?吸附分子间无相互作用; ?吸附是动态平衡: T=const. g+S(剂)
k1 K-1
2013-8-7
g/S
Chap.6 Interface
87
大学基础化学Ⅱ
BET吸附等温方程
cp ? ? ?? ? ( p ? p)[1 ? (c ? 1) p / p? ]
V c( p / p ) ? a Vm ( 1 ? p / p? ){ 1 ? ( c ? 1 ) p / p? } p 1 c ?1 p ? a? a ? a ? V ( p ? p ) Vm cVm p
2013-8-7
a
?
Chap.6 Interface
88
大学基础化学Ⅱ
?BET公式的直线形式:
p 1 c ?1 p ? ? ? ?( p ? p ) ?? c ?? c p?
?可以求出C和Γ∞ ?可以较好地表达五种类型的吸附等 温线的中间部分,以p/p﹡=0.05— 0.35间为最佳。 ?测定吸附剂和催化剂的比表面积。
2013-8-7
Chap.6 Interface
89
大学基础化学Ⅱ
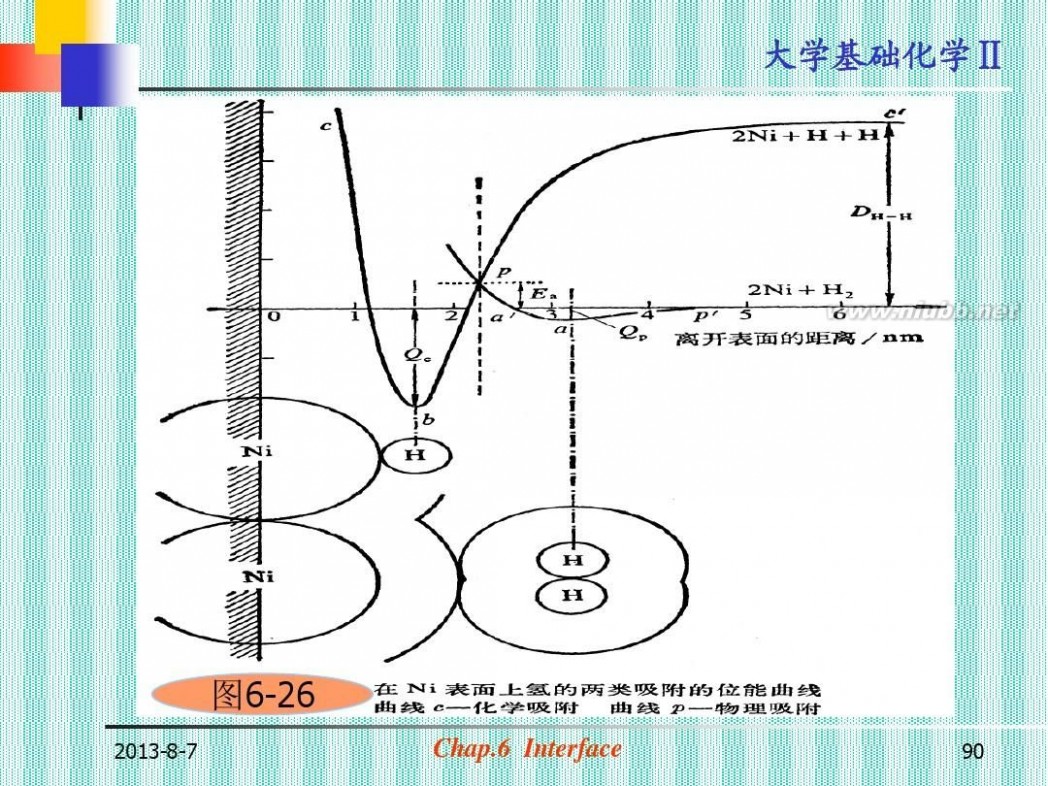
图6-26
2013-8-7
Chap.6 Interface
90
大学基础化学Ⅱ
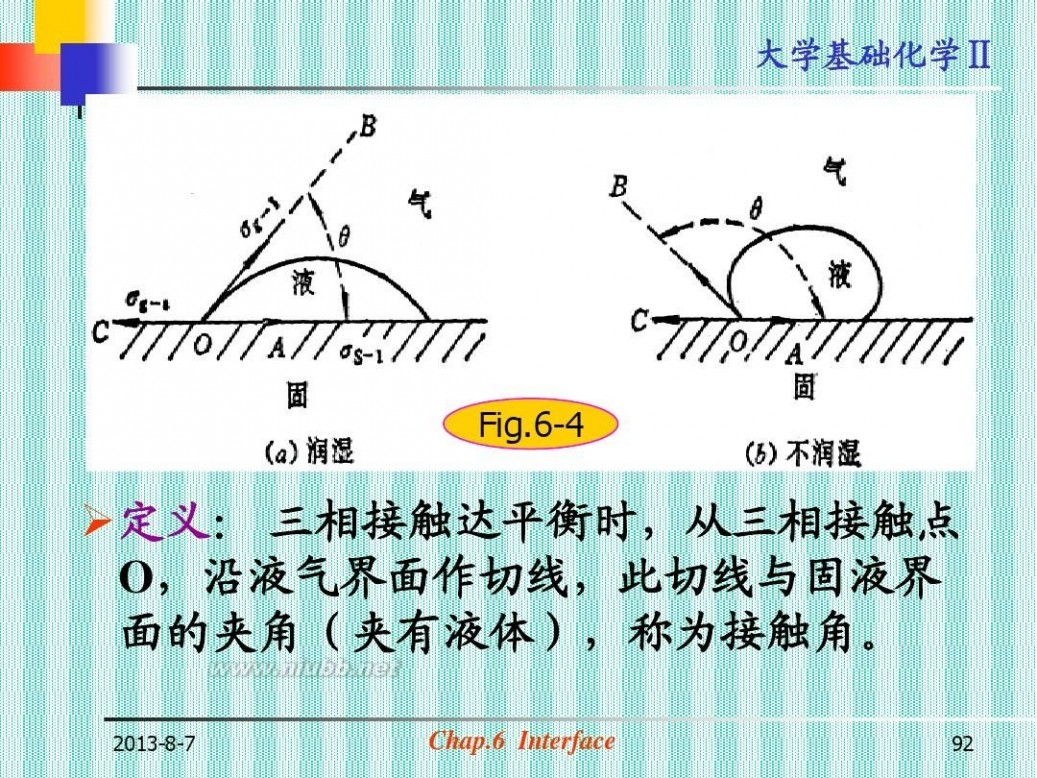
第四节 液-固界面 润湿现象
(Moist Phenomenon) 固体表面气体被液体自动取代的过程 (一)接触角和Young方程(图6-4) 定义: 三相接触达平衡时,从三相接触 点O,沿液气界面作切线,此切线与固液 界面的夹角(夹有液体),称为接触角。
2013-8-7
Chap.6 Interface
91
大学基础化学Ⅱ
Fig.6-4
?定义: 三相接触达平衡时,从三相接触点 O,沿液气界面作切线,此切线与固液界 面的夹角(夹有液体),称为接触角。
2013-8-7
Chap.6 Interface
92
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
93
大学基础化学Ⅱ
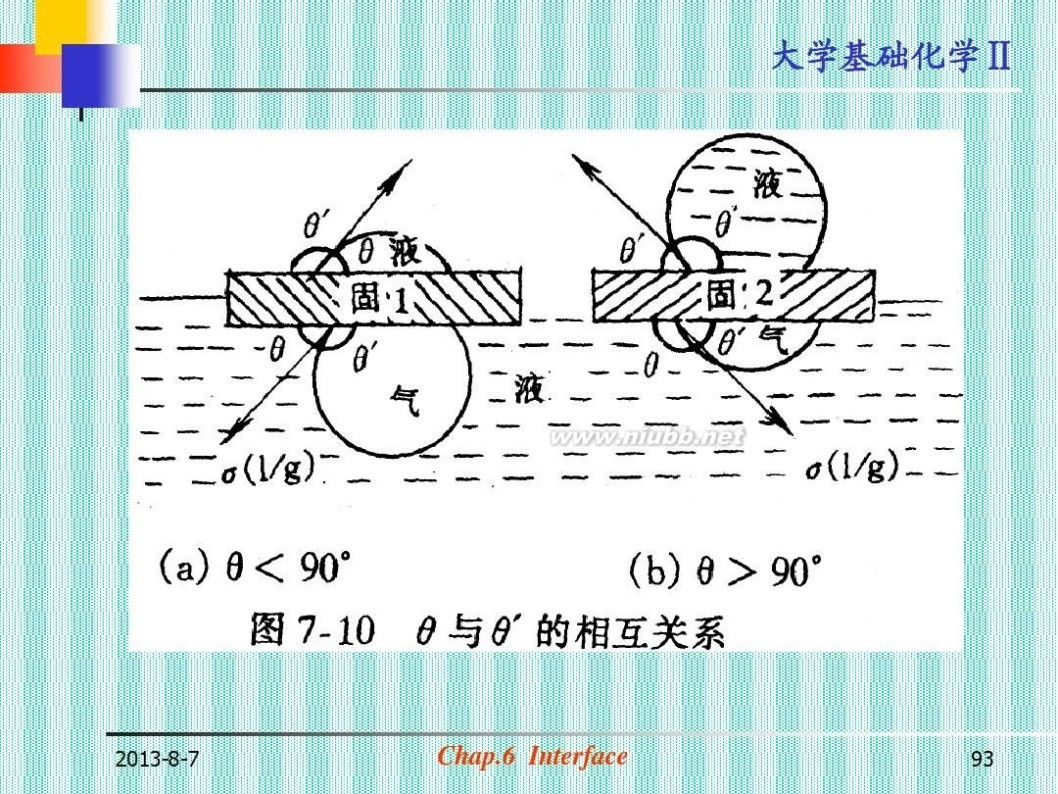
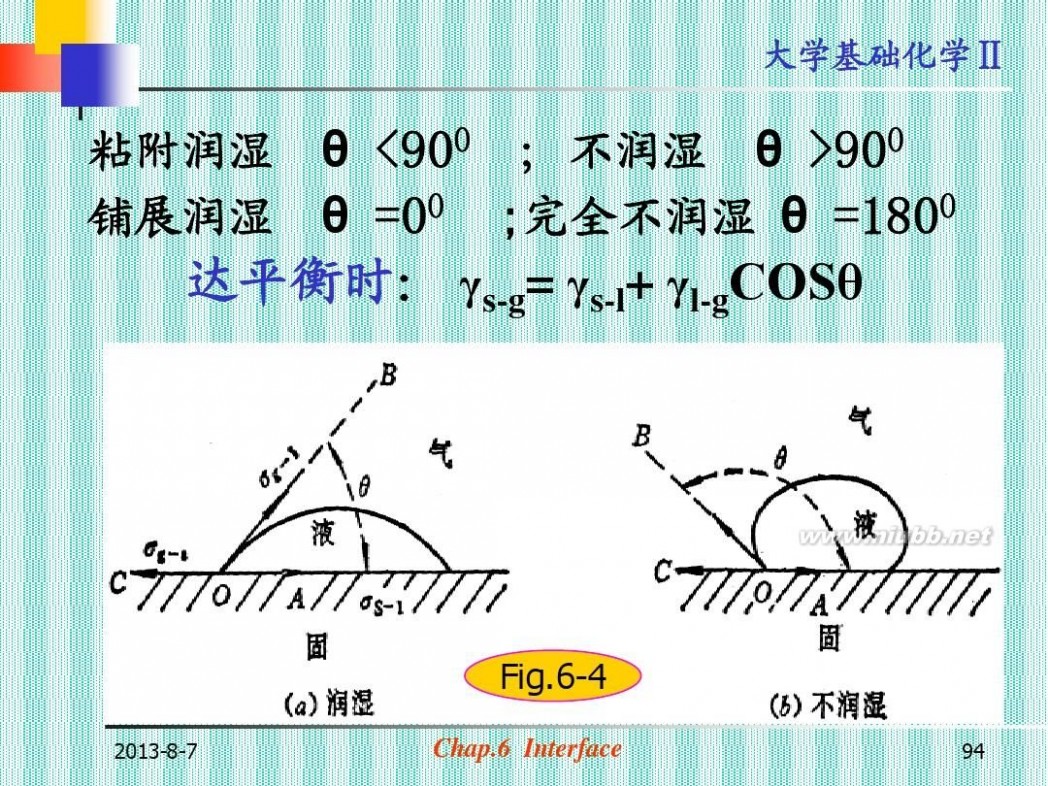
粘附润湿 铺展润湿
θ <900 ; 不润湿 θ >900 θ =00 ;完全不润湿 θ =1800 达平衡时: γs-g= γs-l+ γl-gCOSθ
Fig.6-4
2013-8-7
Chap.6 Interface
94
大学基础化学Ⅱ
COSθ =
? s ? g ? ? s ?l ? l?g
Young eq.
讨论:
? γs-g与γs-l; 决定润湿与否
? γl-g;
?
只决定润湿的程度
COSθ=1
Chap.6 Interface
95
θ=00
2013-8-7
大学基础化学Ⅱ
铺展系数 (Spread Coefficient)
S = γs-g - γs-l - γl-g=0
Young方程的极限 S >0,即γs-g> γs-l+ γl-g, 液体可呈单分子层分散在固体表 面上.
2013-8-7
Chap.6 Interface
96
大学基础化学Ⅱ
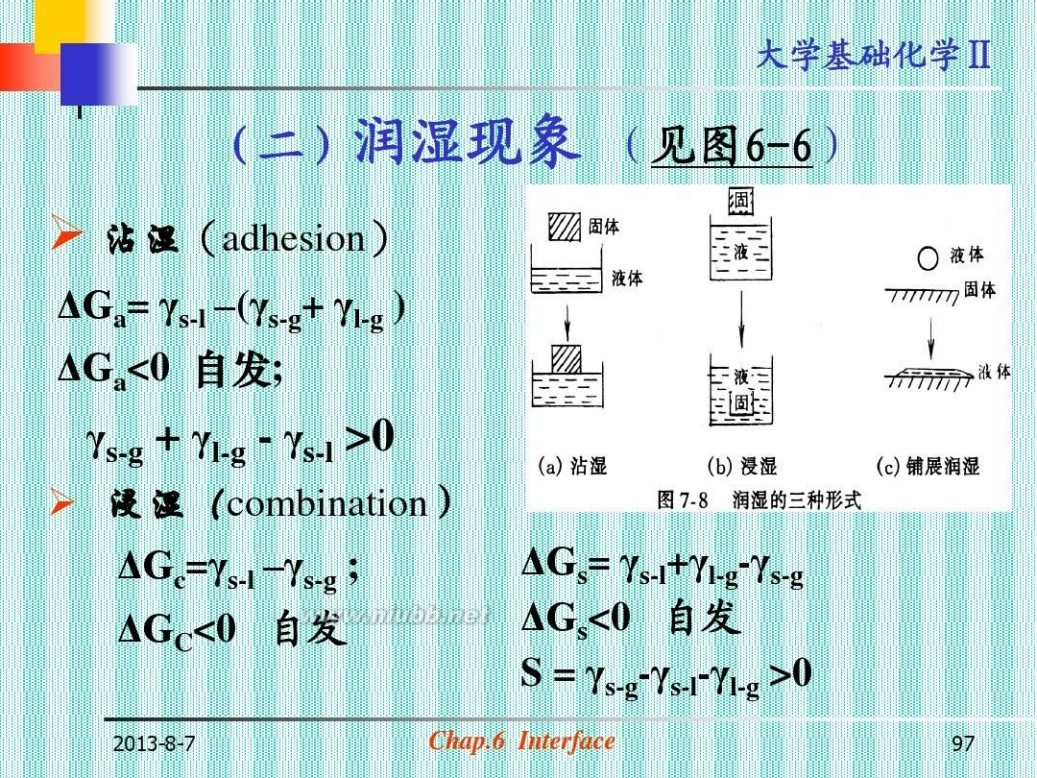
(二)润湿现象 (见图6-6)
? 沾湿(adhesion)
ΔGa= γs-l –(γs-g+ γl-g ) ΔGa<0 自发;
γs-g + γl-g - γs-l >0
? 浸湿(combination)
ΔGc=γs-l –
γs-g ;
ΔGC<0 自发
2013-8-7
ΔGs= γs-l+γl-g-γs-g ΔGs<0 自发 S = γs-g-γs-l-γl-g >0
Chap.6 Interface
97
大学基础化学Ⅱ
铺展(spread)
?
ΔGs=γs-l +γl-g-γs-g ΔGs<0 自发 S = γs-g - γs-l - γl-g >0
? 在液相中加入某些物质可改变γs-l和γl-g
? 铺展有时是希望的,有时是不希望的。
2013-8-7
Chap.6 Interface
98
大学基础化学Ⅱ
?34. 氧化铝瓷件上需要披银,当 烧至1000℃时,液态银能否在氧 化铝瓷件表面上铺展? 已知:1000℃时, ? ? Al O ( s ) ? 1.00×10-3N· -1, m σAg(l)= 0.92×10-3N· -1, m ? ? Ag ? Al2O3 ? 1.77×10-3N· -1 m
2 3
2013-8-7
Chap.6 Interface
99
大学基础化学Ⅱ
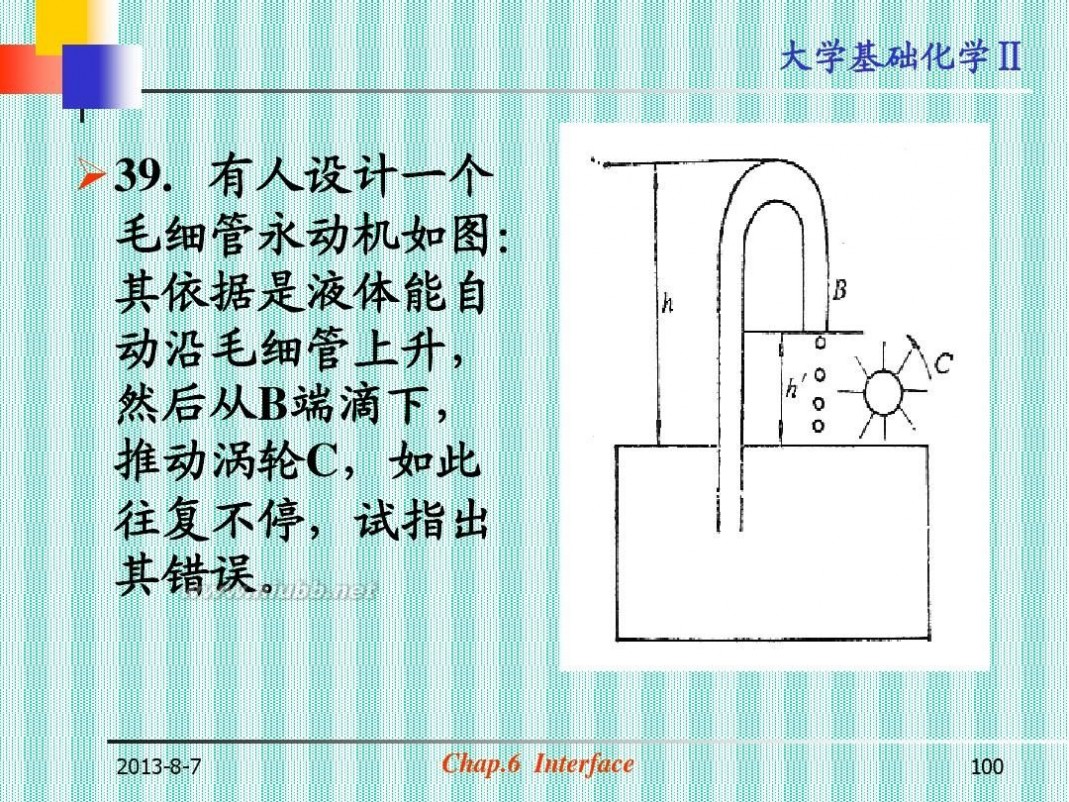
?39. 有人设计一个 毛细管永动机如图: 其依据是液体能自 动沿毛细管上升, 然后从B端滴下, 推动涡轮C,如此 往复不停,试指出 其错误。
2013-8-7
Chap.6 Interface
100
大学基础化学Ⅱ
? 40. 内径相同的玻璃毛细管1,2,3,4, 5 插入同一 水槽中,如图所示;1管中水面上升至h,若在2管 中的上半部(以a为界)以一段石蜡代替玻璃,问水 面上升高度是否改变?在3管有一扩大部分,其水面 上升高度是否改变?若在3管中先将水面吸至高于h 处,再让其自动下降,结果又将若何?
2013-8-7
Chap.6 Interface
101
大学基础化学Ⅱ
?10. 在空间轨道站中,飘浮着一个 足够大的水滴,当用一内壁干净, 外壁油污的毛细管接触水滴时 A. 水不进入毛细管 B. 水进入毛细管并达到一定的高度 C. 水进入直到毛细管另一端 D. 水部分进入毛细管并从另一端出 来,形成两端有两个水球
2013-8-7 102
Chap.6 Interface
大学基础化学Ⅱ
?11. 下列表达是否正确? A. 弯曲表面所产生的附加压力一定 大于零 ( ) B. 微小晶体与普通晶体相比,其溶 解度较小 ( ) C. 液体的表面张力一般随温度的降 低而增大 ( ) D. 表面张力为容量性质 ( )
2013-8-7
Chap.6 Interface
103
大学基础化学Ⅱ
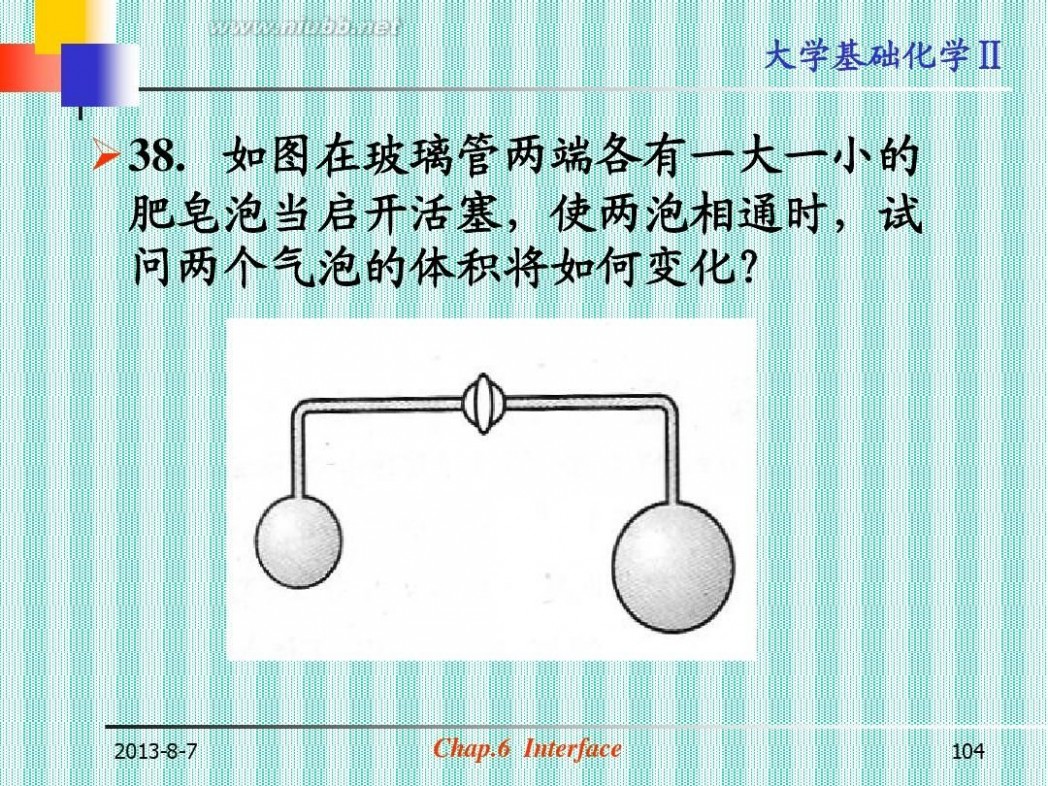
?38. 如图在玻璃管两端各有一大一小的 肥皂泡当启开活塞,使两泡相通时,试 问两个气泡的体积将如何变化?
2013-8-7
Chap.6 Interface
104
大学基础化学Ⅱ
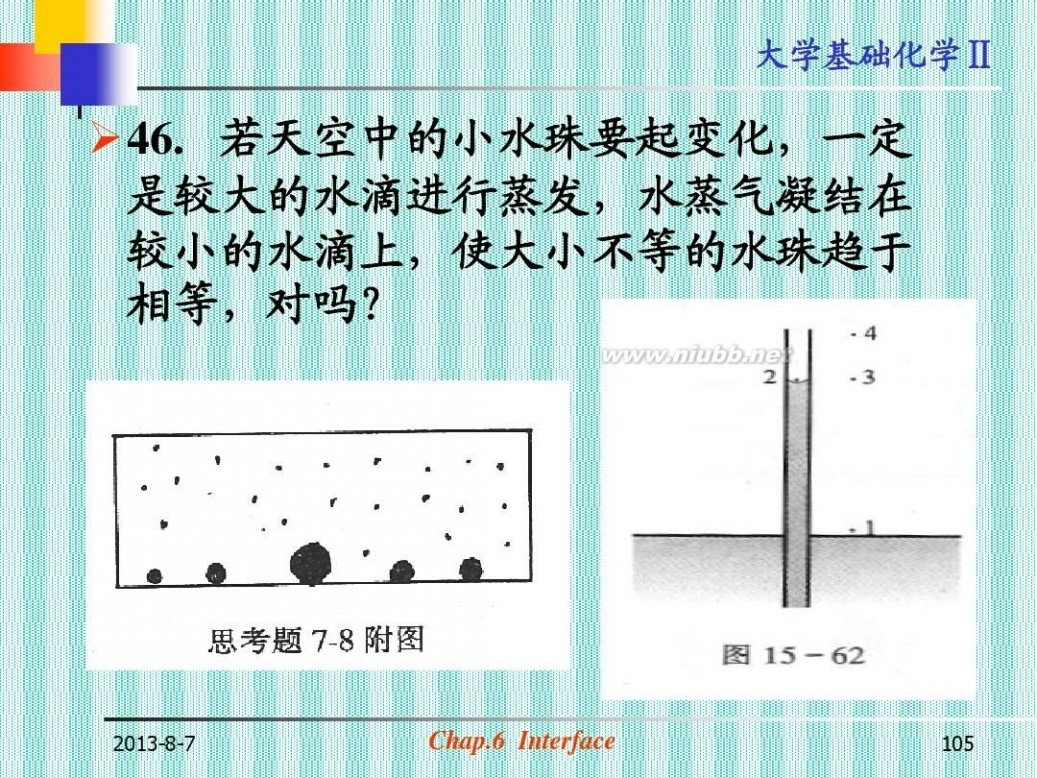
?46. 若天空中的小水珠要起变化,一定 是较大的水滴进行蒸发,水蒸气凝结在 较小的水滴上,使大小不等的水珠趋于 相等,对吗?
2013-8-7
Chap.6 Interface
105
大学基础化学Ⅱ
?Laplace方程 ps=2 γ/Υ
?Kelvin公式: ln(pr/p)=2 γM/ρRTr
?Langmuir 吸附等温方程
k1 p bp ?? ? k?1 ? k1 p 1 ? bp
bp ? ? ?? 1 ? bp
? s ? g ? ? s ?l ? COSθ = ? l?g
2013-8-7
Young eq.
106
Chap.6 Interface
大学基础化学Ⅱ
第五节
溶液表面的吸附
(一)溶液表面的吸附现象 (二)Gibbs吸附等温式: (三)表面活性剂Г与C的关系 (四)表
面活性物质
2013-8-7
Chap.6 Interface
107
大学基础化学Ⅱ
(一)溶液表面的吸附现象
(1)自发过程的方向性, dγ < 0;
? 正吸附, ? 表面活性物质,
负吸附; 表面惰性物质;
? 一般而言,所称表面活性剂是
对水而言的。
2013-8-7
Chap.6 Interface
108
大学基础化学Ⅱ
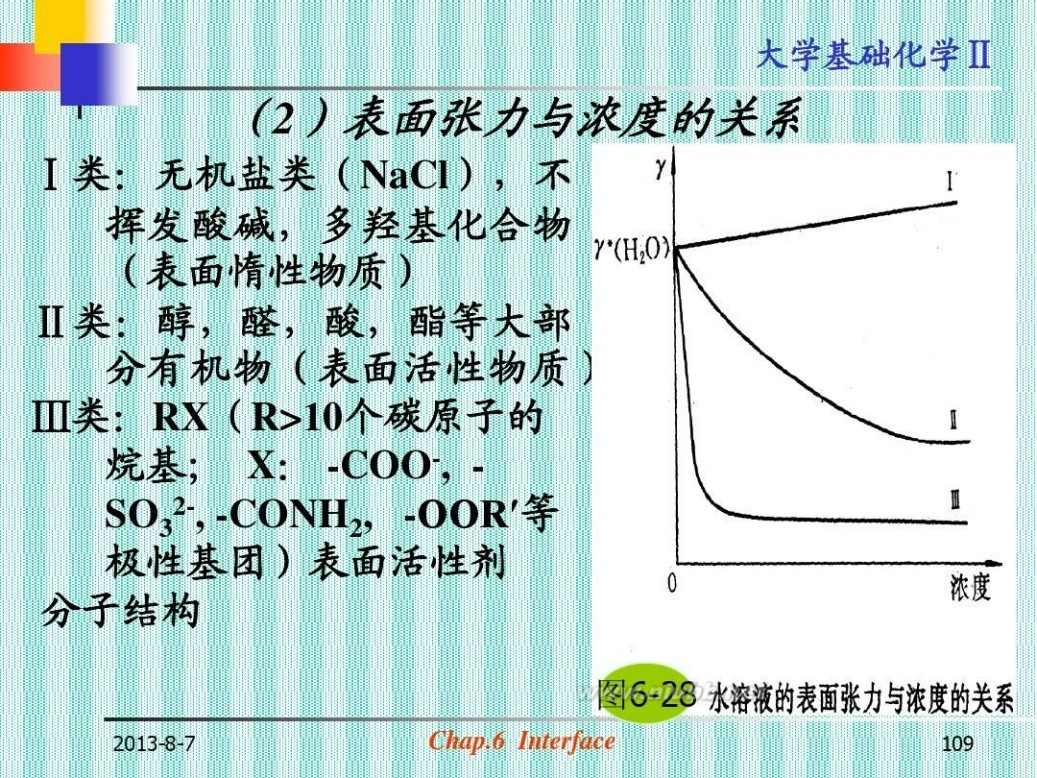
(2)表面张力与浓度的关系
Ⅰ类:无机盐类(NaCl),不 挥发酸碱,多羟基化合物 (表面惰性物质) Ⅱ类:醇,醛,酸,酯等大部 分有机物(表面活性物质) Ⅲ类:RX(R>10个碳原子的 烷基; X: -COO-, SO32-, -CONH2, -OOR′等 极性基团)表面活性剂 分子结构
图6-28
2013-8-7
Chap.6 Interface
109
大学基础化学Ⅱ
(二)Gibbs吸附等温式
(1)表面吸附量的定义: ?在单位面积的表面层中,所含溶质B的物质 的量(n0 )与同量溶剂在本体中所含溶质的 物质的量(nα)的差值。 Г= (n0-nα)/A=ΔnB/A ?意义:1m2 表面上溶质的量超过体相中同量 溶剂所溶解的物质的量。(表面浓度,表面 超量)
2013-8-7
Chap.6 Interface
110
大学基础化学Ⅱ
(2)Gibbs方程 ?在一定温度下,Gibbs Eq.为: c ?? ? ?? ( )T RT ?c
?式中c为吸附平衡时,溶液的体相浓度。 ?计算: (a)γ- c曲线,求浓度c时的斜率 ( ?? / ?c )T= fˊ(c) (b) γ=f(c),
2013-8-7
Chap.6 Interface
111
大学基础化学Ⅱ
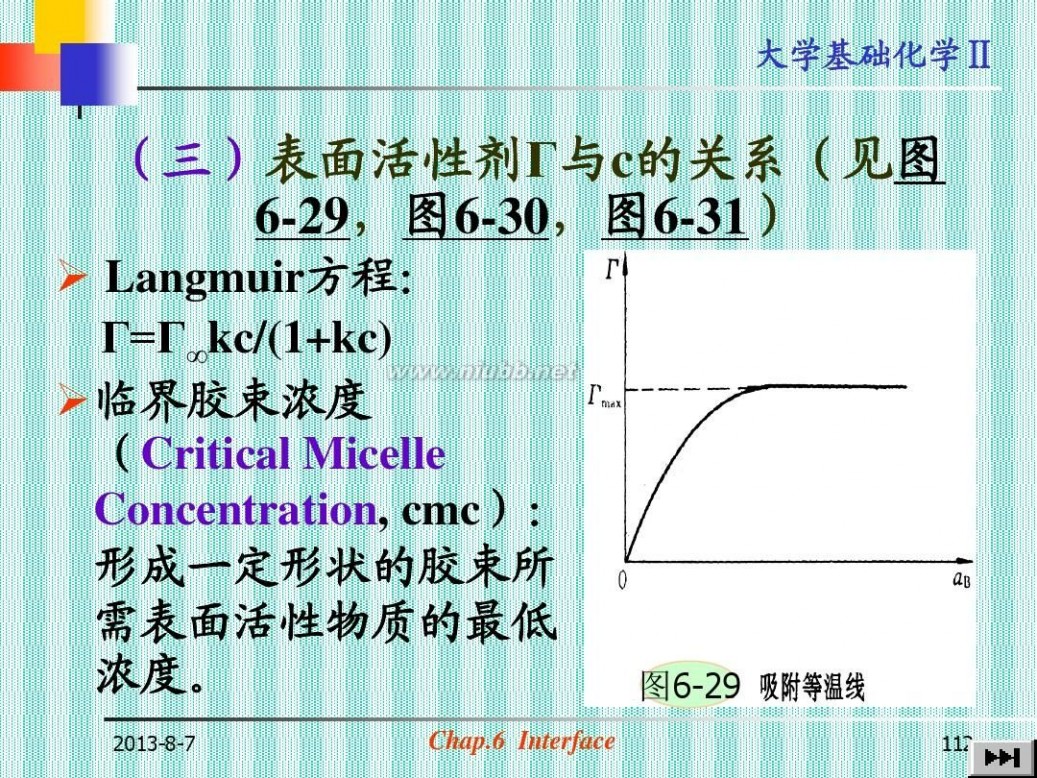
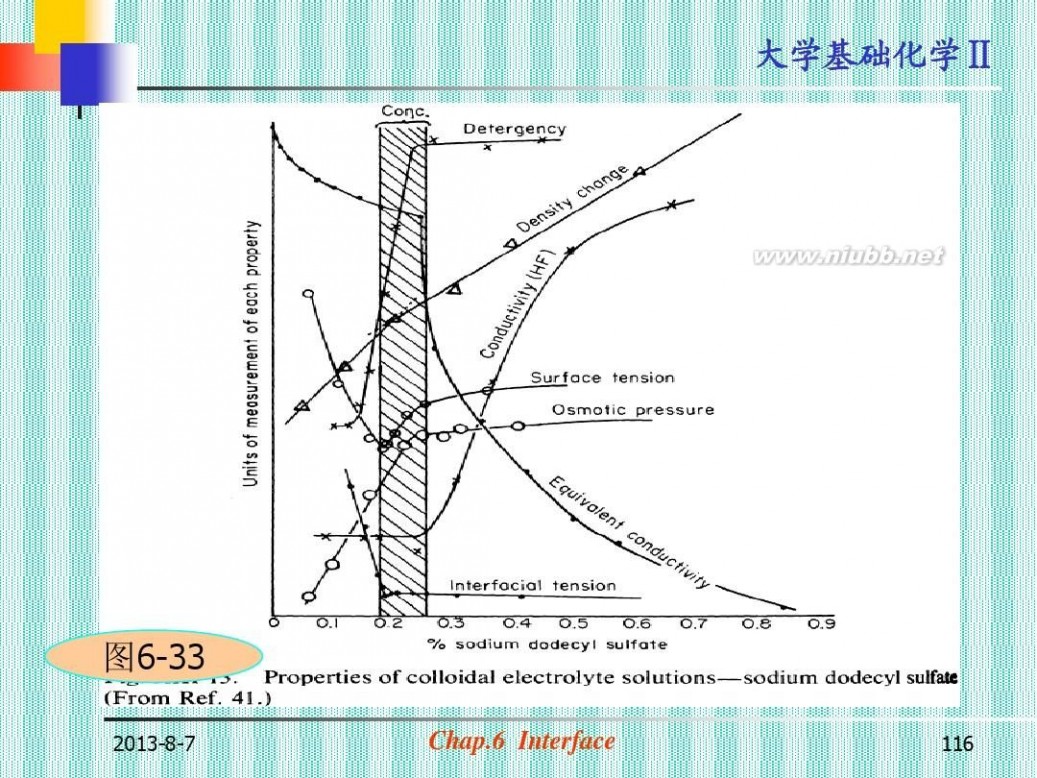
(三)表面活性剂Г与c的关系(见图 6-29,图6-30,图6-31)
? Langmuir方程: Г=Г∞kc/(1+kc) ?临界胶束浓度 (Critical Micelle Concentration, cmc): 形成一定形状的胶束所 需表面活性物质的最低 浓度。
2013-8-7
图6-29
112
Chap.6 Interface
大学基础化学Ⅱ
图6-30
2013-8-7
Chap.6 Interface
113
大学基础化学Ⅱ
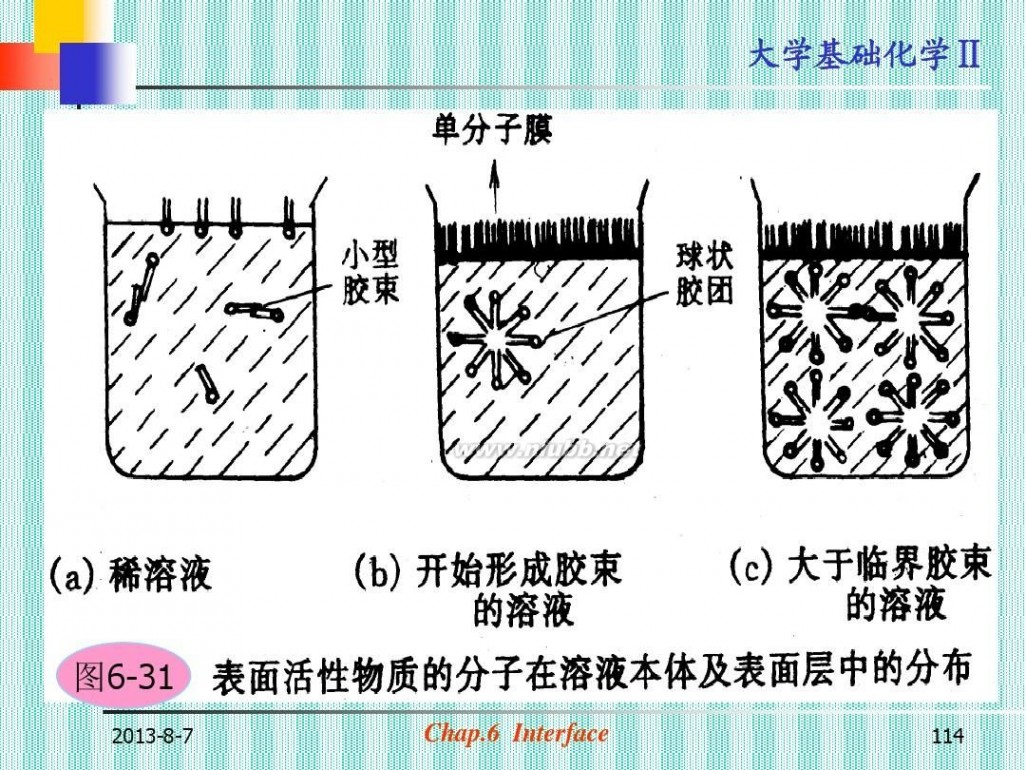
图6-31
2013-8-7
Chap.6 Interface
114
大学基础化学Ⅱ
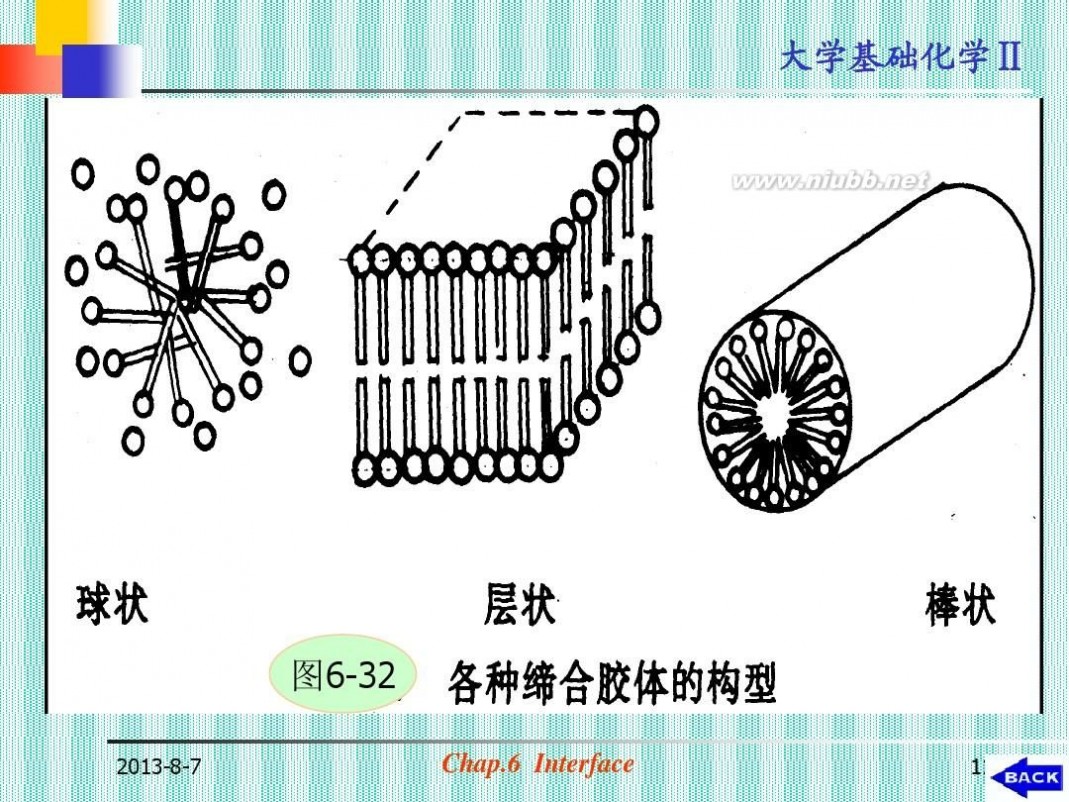
图6-32
2013-8-7
Chap.6 Interface
115
大学基础化学Ⅱ
图6-33
2013-8-7
Chap.6 Interface
116
大学基础化学Ⅱ
?离子型表面活性剂的cmc:
10-2 —10-3 mol· -3 (见图6-33) dm
?表面活性剂溶液的性质在cmc处发生 飞跃 ?表面活性剂分子的截面积:
A s·Г∞· L=1
2013-8-7
Chap.6 Interface
117
大学基础化学Ⅱ
291K时,丁酸水溶液的表面张力表示为:
? ? ? o ? a ln ?1 ? bc ?
? o 是纯水的表面张力, c为丁酸的浓度, a, b为常数, 若a=13.1? 10 ?3 N ? m ?1 ,
b=19.62dm3· -1, c=0.20 mol· -3 , 求 mol dm 表面吸附量 ? 以及饱和吸附量 ?m 。
2013-8-7
Chap.6 Interface
118
大学基础化学Ⅱ
?
? c ?? ?? ( )T RT ?c
? ( ?? ) ? ( ?[? 0 ? a ln( 1 ? bc)] ) T T ?c ?c ? ? ?? ? ? a b ? ab ? ?
? ?c ?T 1 ? bc 1 ? bc
? ?
?c ab ?? RT (1 ? bc) ?a 1 ? bc ? bc ?? ? RT
Chap.6 Interface
119
2013-8-7
大学基础化学Ⅱ
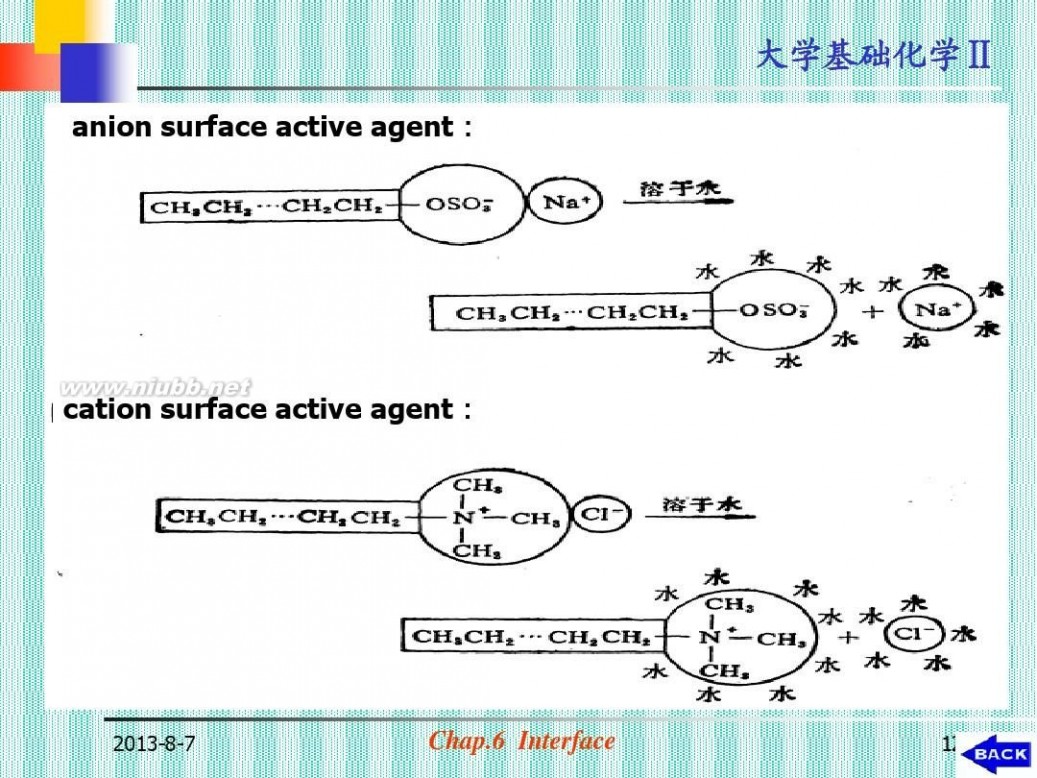
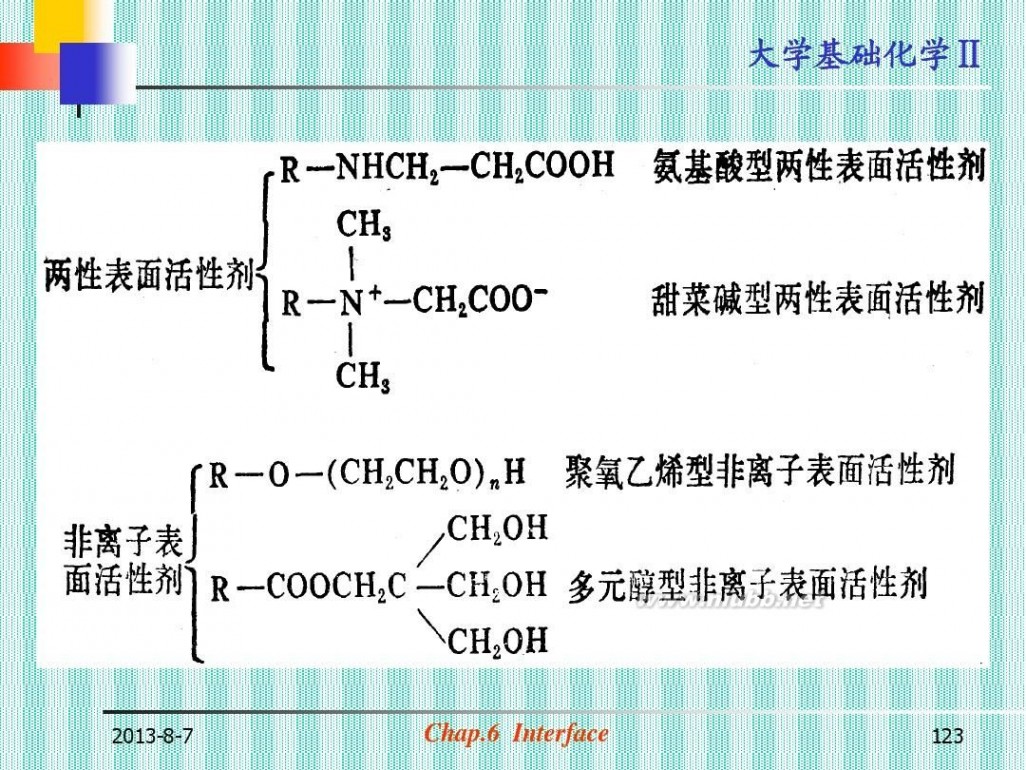
(四) 表面活性物
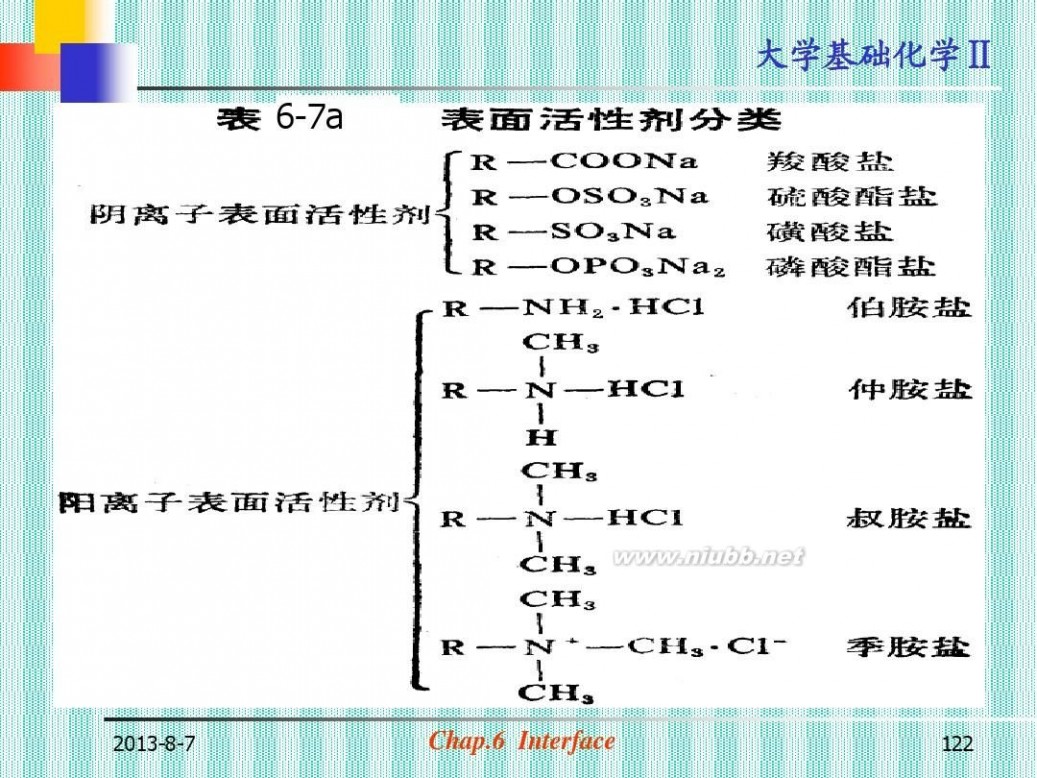
质
Surfactant Substance 1. 表面活性物质的分类(图6-34) 特点: ?极 性 大 分 子 , 亲 水 基 和 憎 水 基 (疏水基) σ表<<σH2O (表6-7a, 6-7b)
2013-8-7
Chap.6 Interface
120
大学基础化学Ⅱ
anion surface active agent :
cation surface active agent :
2013-8-7
Chap.6 Interface
121
大学基础化学Ⅱ
6-7a
2013-8-7
Chap.6 Interface
122
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
123
大学基础化学Ⅱ
2.表面活性剂的作用
(1)润湿
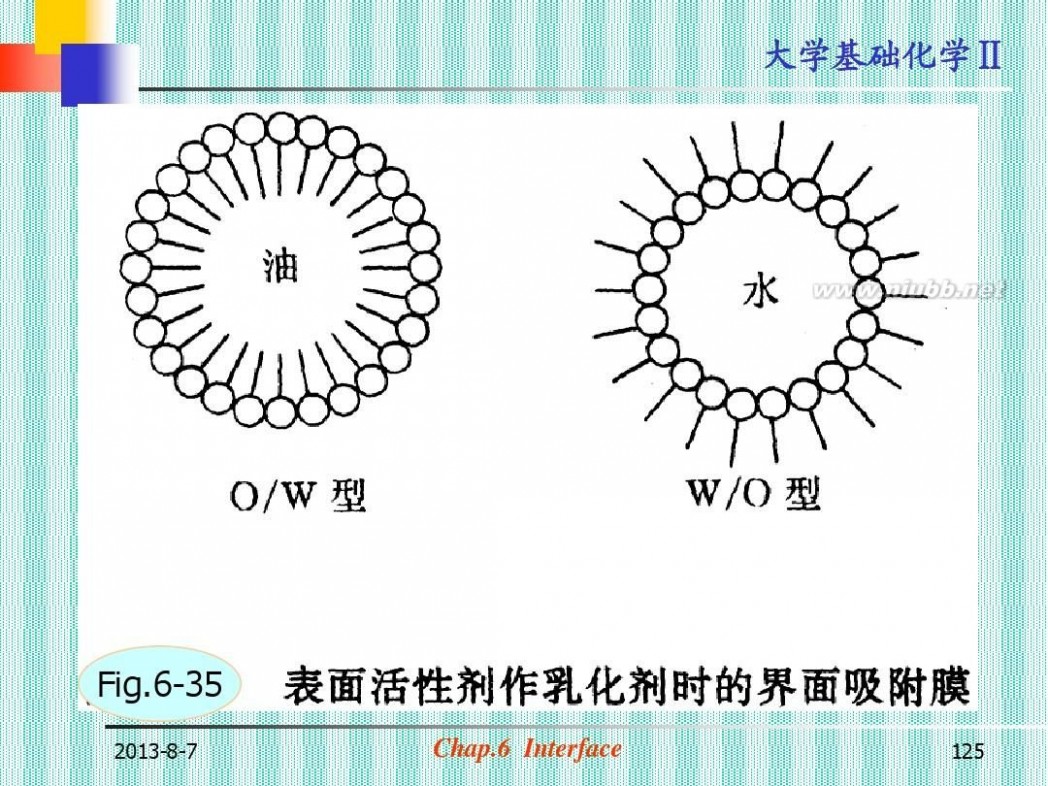
(2)乳化,分散,增溶(图6-35)
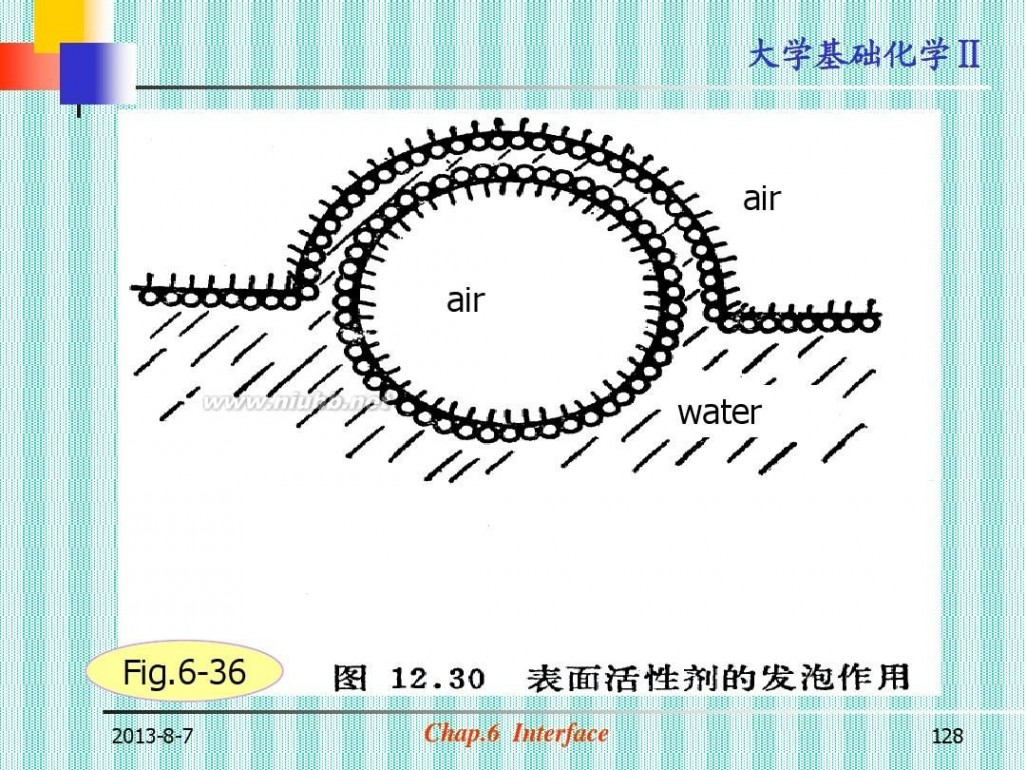
(3)起泡,消泡(图6-36)
(4)洗涤(图6-37)
2013-8-7
Chap.6 Interface
124
大学基础化学Ⅱ
Fig.6-35
2013-8-7
Chap.6 Interface
125
大学基础化学Ⅱ
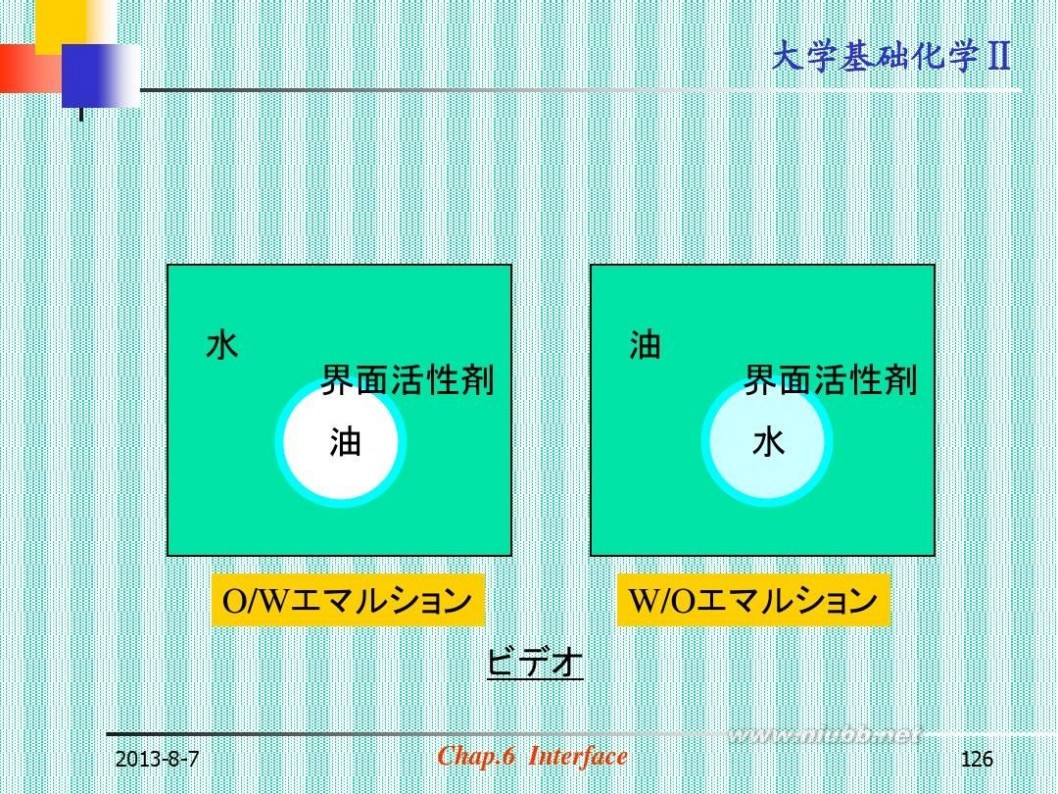
水
界面活性剤
油
油
界面活性剤
水
O/Wエマルション ビデオ
2013-8-7
W/Oエマルション
Chap.6 Interface
126
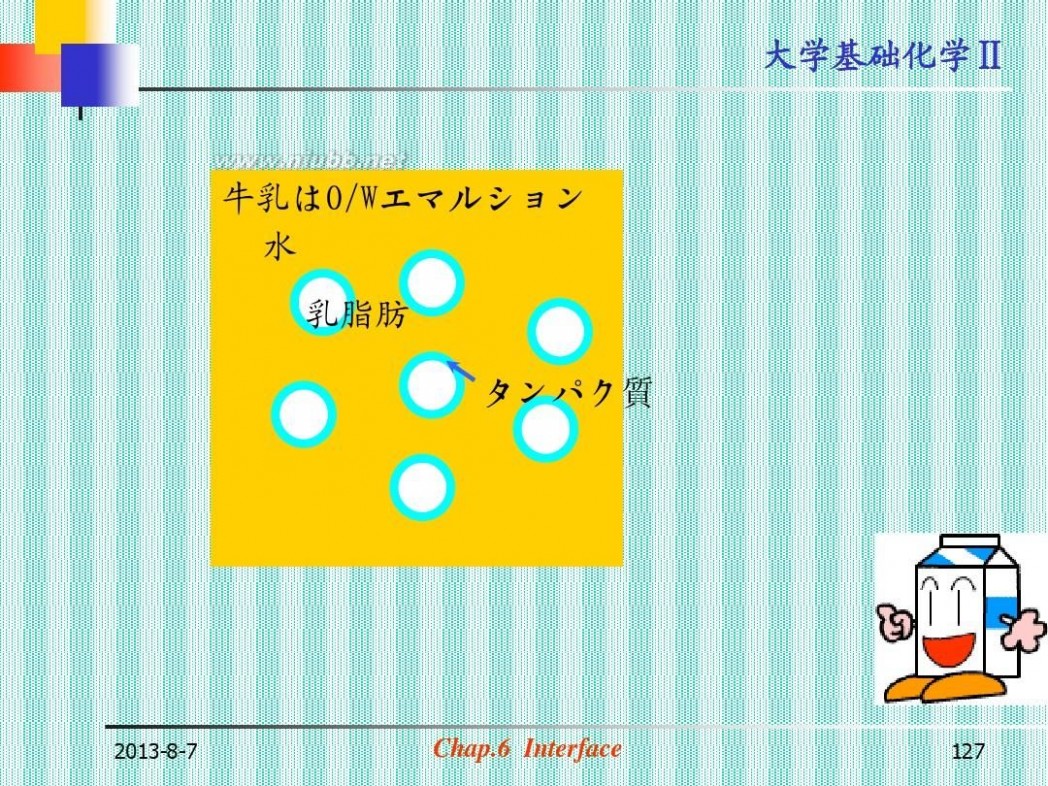
大学基础化学Ⅱ
牛乳はO/Wエマルション 水
乳脂肪
タンパク質
2013-8-7
Chap.6 Interface
127
大学基础化学Ⅱ
air air water
Fig.6-36
2013-8-7
Chap.6 Interface
128
大学基础化学Ⅱ
ore
Fig.6-37
2013-8-7
Chap.6 Interface
129
大学基础化学Ⅱ
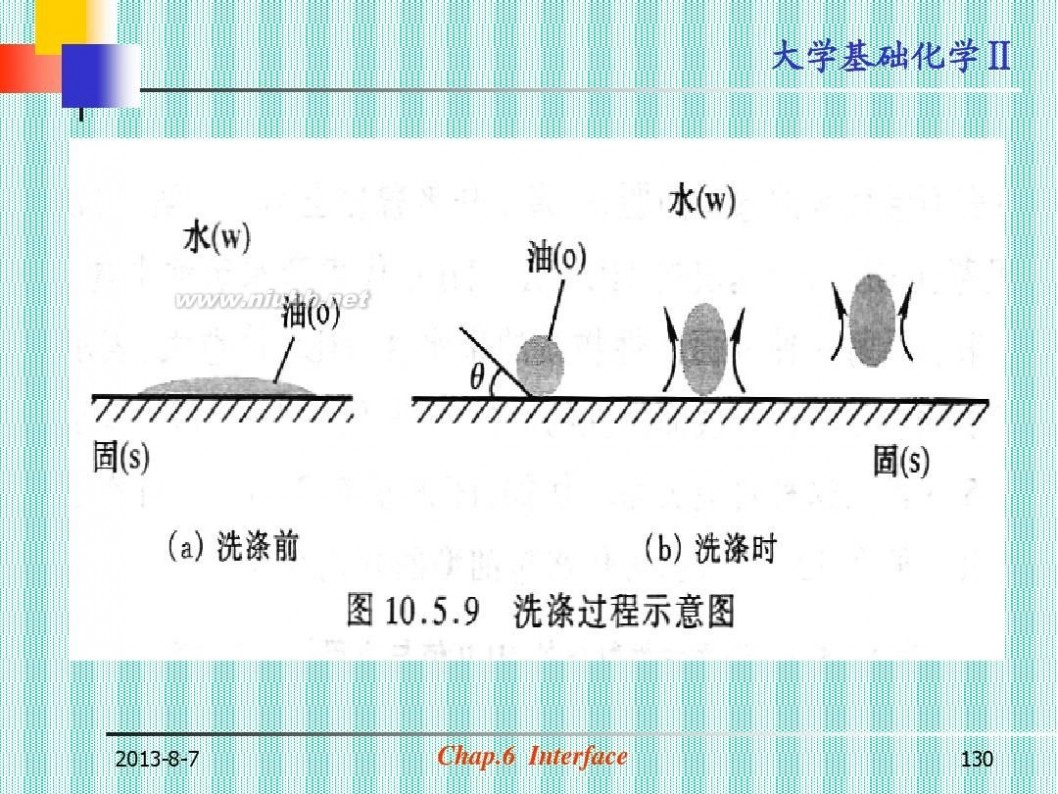
2013-8-7
Chap.6 Interface
130
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
131
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
132
大学基础化学Ⅱ
Do you know this label?
2013-8-7
Chap.6 Interface
133
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
134
大学基础化学Ⅱ
无磷洗涤剂技术内容(HJBZ 8-1999)
HJBZ 008-1999 1995
1 产品中总磷酸盐含量(以P2O5 计)≤1.1%
2 产品的LD50≥5000mg/Kg(体重) 3 产品中的Na2CO3含量≤25% 4 产品中不得使用四聚丙烯烷基苯 磺酸盐,烷基酚聚氧乙烯醚
同左
同左
5 去污力比值≥1.0
2013-8-7
Chap.6 Interface
135
大学基础化学Ⅱ
2013-8-7
Chap.6 Interface
136
大学基础化学Ⅱ
3.表面活性剂的选择与HLB法
(表6-8)
? Griffin提出HLB法:
Hydrophile--Lipophile Balance ? 亲水亲油平衡值:表示每一种表面活性物 质的亲水性。
2013-8-7
Chap.6 Interface
137
大学基础化学Ⅱ
表6-8
2013-8-7
Chap.6 Interface
138
大学基础化学Ⅱ
?18. 为什么泉水,井水都有比较 大的表面张力?将泉水小心注入 干燥的杯子,泉水会高出杯面, 此时加一滴肥皂液将会发生什么 现象?
2013-8-7
Chap.6 Interface
139
大学基础化学Ⅱ
?15. 纯液体,溶液和固体,它们 各采用什么方法来降低表面吉布 斯函数以达到稳定状态?
2013-8-7
Chap.6 Interface
140
四 : 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学
大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

大学化学 大学基础化学

61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1