一 : 反应速率常数:反应速率常数-基本概述,反应速率常数-基本定义
反应速率常数是指化学反应进行的快慢.用单位时间内反应物浓度的减少或生成物浓度的增加量来表示。也是对双分子反应A+B─→C+D,设A和B的相对运动速度为V, 则在长度为v,底面积为S(v)的圆筒内一个A分子与B分子碰撞的频率为ZB(v)=S(v)VnB,单位体积内所有A分子的碰撞频率为ZAB=ZB(v)nA,式中nA、nB分别为A分子和B分子的密度,S(v)为分子对的碰撞截面,若S(v)为有效截面。
化学反应速率常数_反应速率常数 -基本概述
反应速率常数:对 双分子反应A+B─→C+D,设A和B的相对运动速度为 , 则在长度为 ,底面积为 ( )的圆筒内1个A分子与B分子碰撞的频率为 B( )= ( ) B,单位体积内所有A分子的碰撞频率为 AB= B( ) A,式中 A、 B分别为A分子和B分子的密度, ( )为分子对的碰撞截面,若 ( )为有效截面,即每一碰撞均发生化学反应的反应截面,则反应速率为:
从 化学动力学可知:
所以 ( )= ( ) ,对速率求平均则得:
式中 ( )称为该给定反应在给定运动速率下的反应速率常数,而 ( )则称为给定温度 下的热平衡反应速率常数。
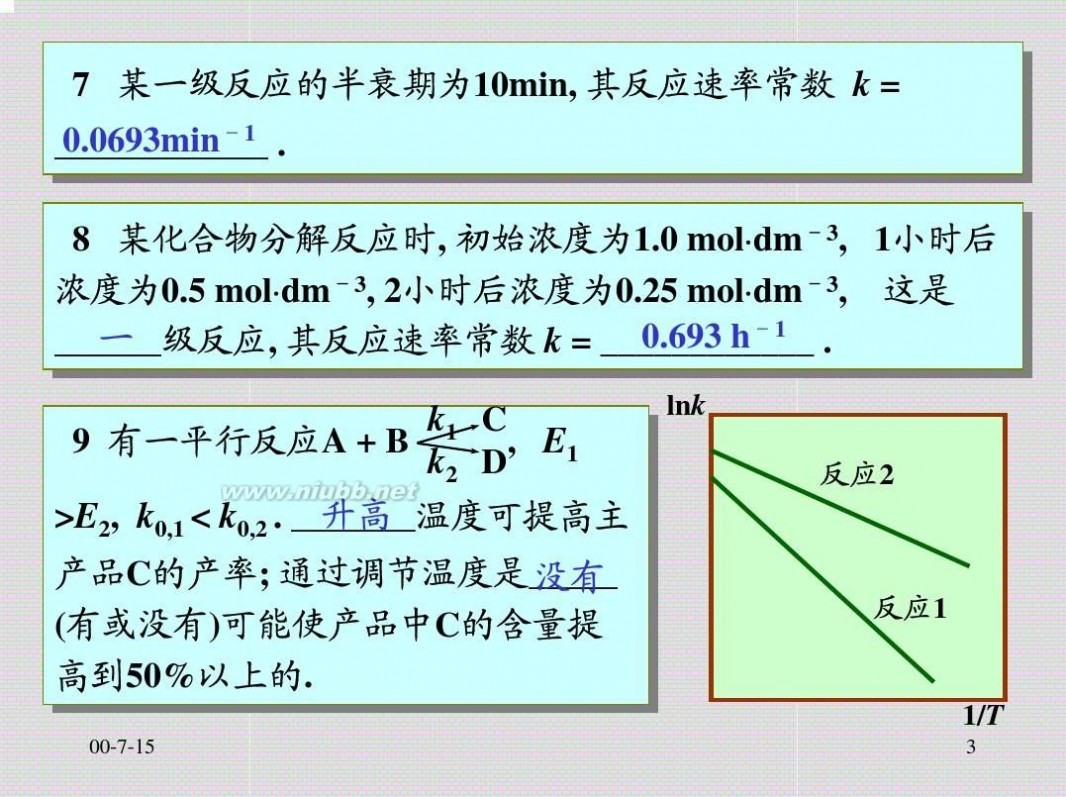
化学反应速率常数_反应速率常数 -基本定义
即 化学反应进行的快慢.用单位时间内反应物浓度的减少或生成物浓度的增加量来表示
化学反应速率常数_反应速率常数 -分类
. 化学反应并非均匀速率进行: 反应速率分为 平均速率(一定时间间隔里平均 反应速率)和 瞬时速率(给定某时刻的反应速率),
化学反应速率常数_反应速率常数 -因素机理
影响因素
可通过实验测定.除了反应物的性质以外,浓度、温度和催化剂也是影响反应速率的重要因素.气体还有压强
影响机理
气体反应的快慢还与压力有关.增加反应物的浓度,即增加了单位体积内 活化分子的数目,从而增加了单位时间内反应物分子有效碰撞的次数,导致反应速率加快.提高反应温度,即增加了 活化分子的百分数,也增加了单位时间内反应物分子有效碰撞的次数,导致反应速率加快.使用正催化剂,改变了反应历程,降低了反应所需的活化能,
二 : 反应速率常数

速率常数 反应速率常数

速率常数 反应速率常数
速率常数 反应速率常数

三 : 蔗糖水解反应速率常数的测定
一、 实验目的
1. 了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系;
2. 测定蔗糖水解反应的速率常数和半衰期;
3. 了解旋光仪器仪的基本原理,并掌握其正确的操作技术。[www.61k.com]
二、 实验原理
一级反应的速率方程可由下式表示: -dc?kc dt
积分可得: lnc=-kt + lnc0
式中c0为反应物的初始浓度,c为t时刻反应物的浓度,k为反应速率常数。
一级反应的半衰期为: t1/2=In20.693? kk
从上式可以看出,一级反应的半衰期与起始浓度无关。这是一级反应的一个特点。
若用lnc对t作图应为一直线。这是一级反应的另一个特点,由直线的斜率可求速率常数k。然 蔗糖在水中转化成葡萄糖与果糖,其反应为:
C12H22O11(蔗糖) + H2O?H??C6H12O6(葡萄糖) + C6H12O6 (果糖) 为使水解反应加速,常以酸为催化剂,故反应在酸性介质中进行。此反应的反应速率与蔗糖的浓度、水的浓度以及催化剂H+的浓度有关。但反应过程中,由于水是大量的,可认为水的浓度基本是恒定的,且H+是催化剂,其浓度也保持不变,故反应速率只与蔗糖的浓度有关,所以蔗糖水解反应可看作是一级反应。
蔗糖及水解产物均为旋光性物质,但他们的旋光能力不同,故可以利用体系在反应过程中旋光度的变化来度量反应进程,测量旋光度所用的仪器称为旋光仪。溶液旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、光源的波长及温度等均有关系。
在蔗糖水解反应中,反应物蔗糖是右旋性物质,比旋光度为[α]20D=66.6°,生成物中葡萄糖也是右旋性物质,比旋光度为[α]20D=52.5°,而果糖则是左旋性物质,[α]20D=-91.9°。随着反应的进行,右旋角不断减小。
当反应进行到某一时刻,体系的旋光度经过零点,然后左旋角不断增加。当蔗糖完全转化时,左旋角达到最大值α∞。设蔗糖尚未转化时,体系最初的旋光度为
α0=K反c0
最终系统的旋光度为
α∞=K生c0
当时间为t时,蔗糖浓度为c,此时旋光度为αt
αt= K反c+ K生(c0-c)
联立①、②、③式可得: ③ ② ① ?
蔗糖水解 蔗糖水解反应速率常数的测定
c0=?0???
K反?K生=K(α0-α∞) ④ c=?t???
K反?K生= K(αt-α∞) ⑤
将④、⑤两式代入速率方程即得:
ln(αt-α∞)=-kt+ln(α0-α∞)
我们以ln(αt-α∞)对t作图可得一直线,从直线的斜率可求得反应速率常数k,也可求反应的半衰期。[www.61k.com)
三、 实验仪器、试剂
仪器:旋光仪、恒温水槽一套、停表、50mL移液管、150mL锥形瓶、烧杯、天平、洗耳球
药品:蔗糖(AR) 、盐酸(3mol /L,AR)
四、 实验步骤
一、旋光仪的校正
1.了解和熟悉旋光仪的构造和使用方法。
2.开启水浴恒温槽的电源开关,并将水浴恒温槽的温度控制在60℃
3. 旋光仪零点的校正蒸馏水为非旋光性物质,可用来校正仪器的零点。将旋光管的一端盖子旋紧,
由其另一端加入蒸馏水,然后旋紧套盖,但不要过紧,以不漏水为准。如果管中有气泡,可将气泡导入
旋光管粗肚部分。用滤纸将旋光管外部擦干,旋光管两端的玻璃片可用擦镜纸擦净。打开光源,把旋光
管放入旋光仪内,调整目镜焦距使视野清楚。然后旋转检偏镜至视野中所观察到明暗相等的三分视野为
止。记下检偏镜的旋转角,重复数次,取其平均值。此值即为仪器的零点。
二、测定
1.配制蔗糖溶液:用天平称取10g蔗糖放入烧杯内,加少量蒸馏水溶解后转移到50ml容量瓶中,
稀释至刻度。
2.旋光度的测定:将50ml配制好的蔗糖溶液,置于干净的锥形瓶中,再用50ml移液管吸取
3mol·L-1HCL注入蔗糖溶液中。当HCL溶液流出一半时,开始计时(作为反应开始的时间)。HCL全加
入后混合均匀,迅速用少量的混合液洗涤旋光管两次,然后将反应液加入旋光管内,测定αt,5min、10min、
15min、20min、25min、30min、40min、50min、60min,依次各测一次旋光度。
3. α∞的测定:将剩余的反应混合物放入60℃恒温水浴中,加热60min,使反应充分后,冷却至室
温后装入旋光管测定α∞。
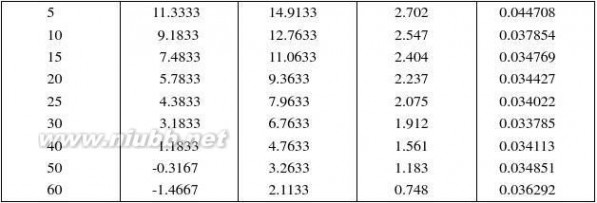
五、 数据记录与处理
实验温度:盐酸浓度:
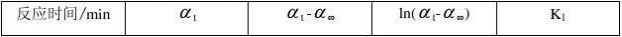
?∞: -3.58
2
蔗糖水解 蔗糖水解反应速率常数的测定
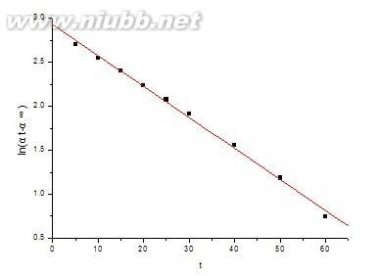
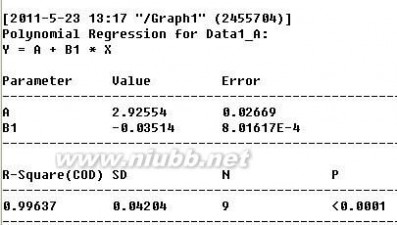
以ln(αt-α∞)对t作图得到如下结果:
由图可知直线的斜率为-0.03514, 所以反应的速率常数为k1=0.03514 截距c = 2.92554, 即c = In(α0-α∞)
蔗糖水解反应的半衰期 t1/2 = ㏑2/ k1 = 0.693 / k1=19.72 由各时间的k值可得速率常数的平均值为0.036091
相对误差=(实验值-理论值)/理论值=(0.036091-0.03514)/0.03514×100%=2.71%
六、 结果与讨论
误差分析:
由计算可得相对误差较小,实验较成功。(www.61k.com)可能存在的误差为:
1.用旋光仪读数时,通过检偏镜用肉眼判断三分视野明暗存在误差,导致实验数据误差。
2.以盐酸流出一半为反应开始计时,由于无法准确判断,所以导致反应时间存在误差。 3.旋光管内存在少许气泡,导致读数存在误差。 注意事项:
1.速度常数k与浓度有关,所以酸的浓度必须精确,以保证反应体系中H+浓度与实验要求的相一致。 2.在放置旋光管上的玻璃片时,将玻璃盖片沿管口轻轻推上盖好,再旋紧套盖,勿使其漏水或产生气泡。 3.旋光仪使用中,若两次测定中间间隔时间较长,则应切断电源,让灯管休息一会,在下次使用提前10分钟再开启。
4.对三分视野的明暗判断影响实验值的精度,因此要求判断时尽可能作到快而准。
3
四 : 蔗糖水解反应速率常数的测定
一、 实验目的
1. 了解蔗糖水解反应体系中各物质浓度与旋光度之间的关系;
2. 测定蔗糖水解反应的速率常数和半衰期;
3. 了解旋光仪器仪的基本原理,并掌握其正确的操作技术。
二、 实验原理
一级反应的速率方程可由下式表示: -dc?kc dt
积分可得: lnc=-kt + lnc0
式中c0为反应物的初始浓度,c为t时刻反应物的浓度,k为反应速率常数。
一级反应的半衰期为: t1/2=In20.693? kk
从上式可以看出,一级反应的半衰期与起始浓度无关。这是一级反应的一个特点。
若用lnc对t作图应为一直线。这是一级反应的另一个特点,由直线的斜率可求速率常数k。然 蔗糖在水中转化成葡萄糖与果糖,其反应为:
C12H22O11(蔗糖) + H2O?H??C6H12O6(葡萄糖) + C6H12O6 (果糖) 为使水解反应加速,常以酸为催化剂,故反应在酸性介质中进行。此反应的反应速率与蔗糖的浓度、水的浓度以及催化剂H+的浓度有关。但反应过程中,由于水是大量的,可认为水的浓度基本是恒定的,且H+是催化剂,其浓度也保持不变,故反应速率只与蔗糖的浓度有关,所以蔗糖水解反应可看作是一级反应。
蔗糖及水解产物均为旋光性物质,但他们的旋光能力不同,故可以利用体系在反应过程中旋光度的变化来度量反应进程,测量旋光度所用的仪器称为旋光仪。溶液旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、光源的波长及温度等均有关系。
在蔗糖水解反应中,反应物蔗糖是右旋性物质,比旋光度为[α]20D=66.6°,生成物中葡萄糖也是右旋性物质,比旋光度为[α]20D=52.5°,而果糖则是左旋性物质,[α]20D=-91.9°。随着反应的进行,右旋角不断减小。
当反应进行到某一时刻,体系的旋光度经过零点,然后左旋角不断增加。当蔗糖完全转化时,左旋角达到最大值α∞。设蔗糖尚未转化时,体系最初的旋光度为
α0=K反c0
最终系统的旋光度为
α∞=K生c0
当时间为t时,蔗糖浓度为c,此时旋光度为αt
αt= K反c+ K生(c0-c)
联立①、②、③式可得: ③ ② ① ?
c0=?0???
K反?K生=K(α0-α∞) ④ c=?t???
K反?K生= K(αt-α∞) ⑤
将④、⑤两式代入速率方程即得:
ln(αt-α∞)=-kt+ln(α0-α∞)
我们以ln(αt-α∞)对t作图可得一直线,从直线的斜率可求得反应速率常数k,也可求反应的半衰期。
三、 实验仪器、试剂
仪器:旋光仪、恒温水槽一套、停表、50mL移液管、150mL锥形瓶、烧杯、天平、洗耳球
药品:蔗糖(AR) 、盐酸(3mol /L,AR)
四、 实验步骤
一、旋光仪的校正
1.了解和熟悉旋光仪的构造和使用方法。
2.开启水浴恒温槽的电源开关,并将水浴恒温槽的温度控制在60℃
3. 旋光仪零点的校正蒸馏水为非旋光性物质,可用来校正仪器的零点。将旋光管的一端盖子旋紧,
由其另一端加入蒸馏水,然后旋紧套盖,但不要过紧,以不漏水为准。如果管中有气泡,可将气泡导入
旋光管粗肚部分。用滤纸将旋光管外部擦干,旋光管两端的玻璃片可用擦镜纸擦净。打开光源,把旋光
管放入旋光仪内,调整目镜焦距使视野清楚。然后旋转检偏镜至视野中所观察到明暗相等的三分视野为
止。记下检偏镜的旋转角,重复数次,取其平均值。此值即为仪器的零点。
二、测定
1.配制蔗糖溶液:用天平称取10g蔗糖放入烧杯内,加少量蒸馏水溶解后转移到50ml容量瓶中,
稀释至刻度。
2.旋光度的测定:将50ml配制好的蔗糖溶液,置于干净的锥形瓶中,再用50ml移液管吸取
3mol·L-1HCL注入蔗糖溶液中。当HCL溶液流出一半时,开始计时(作为反应开始的时间)。HCL全加
入后混合均匀,迅速用少量的混合液洗涤旋光管两次,然后将反应液加入旋光管内,测定αt,5min、10min、
15min、20min、25min、30min、40min、50min、60min,依次各测一次旋光度。
3. α∞的测定:将剩余的反应混合物放入60℃恒温水浴中,加热60min,使反应充分后,冷却至室
温后装入旋光管测定α∞。
五、 数据记录与处理
实验温度:盐酸浓度:

?∞: -3.58
2
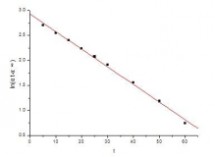

以ln(αt-α∞)对t作图得到如下结果:
由图可知直线的斜率为-0.03514, 所以反应的速率常数为k1=0.03514 截距c = 2.92554, 即c = In(α0-α∞)
蔗糖水解反应的半衰期 t1/2 = ㏑2/ k1 = 0.693 / k1=19.72 由各时间的k值可得速率常数的平均值为0.036091
相对误差=(实验值-理论值)/理论值=(0.036091-0.03514)/0.03514×100%=2.71%
六、 结果与讨论
误差分析:
由计算可得相对误差较小,实验较成功。可能存在的误差为:
1.用旋光仪读数时,通过检偏镜用肉眼判断三分视野明暗存在误差,导致实验数据误差。
2.以盐酸流出一半为反应开始计时,由于无法准确判断,所以导致反应时间存在误差。 3.旋光管内存在少许气泡,导致读数存在误差。 注意事项:
1.速度常数k与浓度有关,所以酸的浓度必须精确,以保证反应体系中H+浓度与实验要求的相一致。 2.在放置旋光管上的玻璃片时,将玻璃盖片沿管口轻轻推上盖好,再旋紧套盖,勿使其漏水或产生气泡。 3.旋光仪使用中,若两次测定中间间隔时间较长,则应切断电源,让灯管休息一会,在下次使用提前10分钟再开启。
4.对三分视野的明暗判断影响实验值的精度,因此要求判断时尽可能作到快而准。
3

61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1