一 : (12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。(1)碱式碳
| (12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。 (1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和。 (2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。 ![mga (12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。(1)碱式碳](http://p.61k.com/cpic/f7/a8/156a9c8993b2df0cecac20305037a8f7.png) |
阻止燃烧 2a+3b=c+2d (3) ![mga (12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。(1)碱式碳](http://p.61k.com/cpic/a7/a5/dc7d6a8eff14bde6ca7243e33b4ca5a7.jpg) |
试题分析:(1物受热分解为高熔点的氧化镁和氧化铝覆盖在可燃物表面,阻止燃烧;(2)物质中各元素的合价代数和为0,2a+3b=c+2d;(3)根据分解图像和已知信息,得出第一段是失去结晶水,第二段是分解为氧化物;应根据后一段计算OH-和CO32-的关系,加热时前者生成水,后者生成二氧化碳,二者的和可以根据图中的数据换算,再根据二氧化碳的质量计算出水的质量,进而得到OH-和CO32-的物质的量。 |
考点:
考点名称:单质铝铝的主要性质:
物理性质: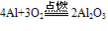 (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光) (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)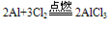
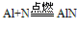 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑) 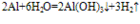
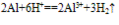
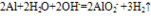
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: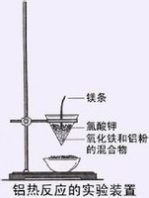
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 | 4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O | 2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) | 2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu | 2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是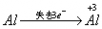 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: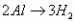 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。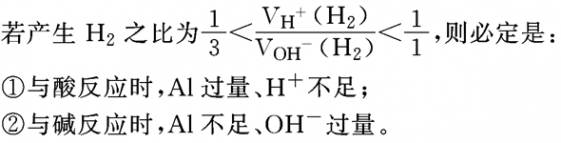
“铝三角”关系:
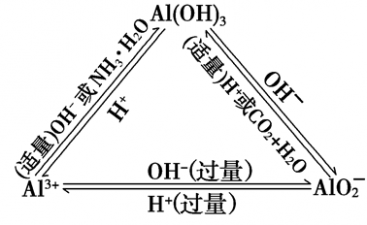
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
考点名称:铝盐(铝离子)铝盐:
铝盐是指正三价铝离子和酸根阴离子组成的盐,一般来说呈白色或无色晶体,溶于水,个别不溶于水。
常用的铝盐主要有三氯化铝、硫酸铝和明矾。
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)== AlO2-+2H2O
(2)Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐的性质:
Al3+易水解,显酸性Al3++3H2O==Al(OH)3+3H+
(1)与碱反应:Al3++3OH-(少量)==Al(OH)3↓
Al3++4OH-(过量)==AlO2-+2H2O
(2)易发生双水解:Al3++3AlO2-+6H2O==4Al(OH)3↓
铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=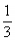 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)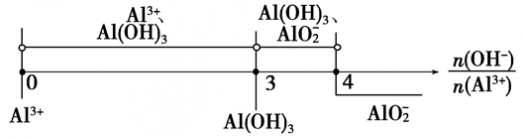
2、有关Al(OH)3的图像分析
①向 溶液中滴加
溶液中滴加 溶液
溶液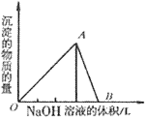
O~A段: 
A~B段: 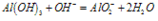
②向强碱溶液中滴入铝盐溶液 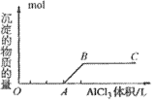
O~A段: 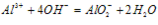
A~B段: 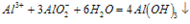
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到 时,产生最大沉淀量
时,产生最大沉淀量
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 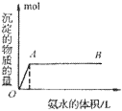
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸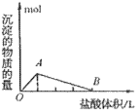
O~A段: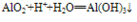
O~B段: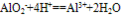
⑤向盐酸中滴加偏铝酸盐溶液 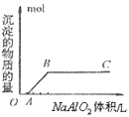
O~A段: 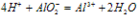
A~B段: 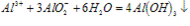
“铝三角”关系:

Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
典型例题解析:
在50mLbmol·L-1的AlCl3溶液中加入50mLamol·L-1NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
(2)当a、b满足________条件时,无沉淀产生。
(3)当a、b满足________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为________g。
解析:依题意知,在AlCl3溶液中加入NaOH溶液有如下两个反应发生: AlCl3+3NaOH===Al(OH)3↓+3NaCl ①
AlCl3+4NaOH===NaAlO2+3NaCl+2H2O ②
根据以上两反应可以看出:
(1)当a≤3b时,只发生第一个反应,此时NaOH不足量,产生沉淀的量取决于NaOH。3n[Al(OH)3]=n(NaOH)?。所以答案为0.05a/3mol。
(2)如果无沉淀生成,Al元素全部以AlO2-形式存在。 n(AlCl3)∶n(NaOH)≤1∶4,即a∶b≥4∶1,所以答案为a≥4b。
(3)此种情况应当是两个反应均发生,铝元素以Al(OH)3和AlO2-两种形式存在。符合关系: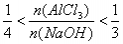 即
即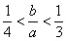 ,整理得:3b<a<4b或
,整理得:3b<a<4b或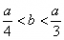 。
。
求沉淀的量的方法很多。
解法一:联立方程法。
设反应①中,AlCl3物质的量为x,则Al(OH)3为x,NaOH为3x。
反应②中AlCl3物质的量为y,NaOH为4y。 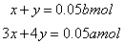
解得x=(0.2b-0.05a)mol=0.05(4b-a)mol。 m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol=3.9(4b-a)g。
解法二:守恒法。此种条件下,溶液中的离子有Na+、Cl-、AlO2-。
n(AlO2-)=n(Na+)-n(Cl-)=0.05amol-0.05×3bmol。
n[Al(OH)3]=n(Al3+)总-n(AlO2-)=0.05bmol-(0.05amol-0.15bmol)=(0.2b-0.05a)mol=0.05(4b-a)mol。
m[Al(OH)3]=78g·mol-1×0.05(4b-a)mol =3.9(4b-a)g。
【答案】 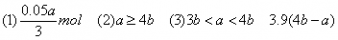
氢氧化铝的性质:
不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;既能与酸反应,又能与碱反应。
(1)与酸反应:Al(OH)3+3H+==Al3++3H2O
(2)与碱反应:Al(OH)3+OH-==AlO2-+2H2O
氢氧化铝的性质:
氢氧化铝是一种白色不溶于水的胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。氢氧化铝既能与强酸反应也能与强碱反应,是两性氢氧化物。氢氧化铝是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,是胃液酸度降低,起到中和过多胃酸的作用。氢氧化铝受热是分解成氧化铝和水。2Al(OH)3=(加热)=Al2O3+3H2O氢氧化铝的制备:
实验室制法:Al2(SO4)3+6NH3·H2O==(NH4)2SO4+Al(OH)3↓
其他制法:①AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
②2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
④3AlO2-+Al3++6H2O==4Al(OH)3↓
例题:用稀H2SO4、NaOH溶液和金属铝为原料制取Al(OH)3。
甲、乙、丙三个学生的制备途径分别是
甲: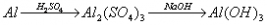
乙: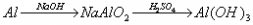
丙: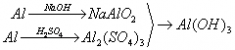
若要得到等量的Al(OH)3,则( B )
A.三者消耗的原料相同 B.甲消耗的原料的总物质的量最多 C.乙消耗的原料的总物质的量最少 D.丙消耗的原料的总物质的量最多
有关Al(OH)3的计算及图象分析:
解答有关Al(OH)3的图象和计算问题要注意以下三点:
(1)“铝三角”关系图中各物质转化方程式中的化学计量数关系。
(2)铝元素的存在形式。
(3)图象分析时:首先要看清横、纵坐标的含义,其次要对图象进行全面的分析,尤其需要关注的是特殊点(起点、折点、顶点、终点)的含义。
1、铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=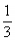 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
2、有关Al(OH)3的图像分析
①向 溶液中滴加
溶液中滴加 溶液
溶液
O~A段: 
A~B段: 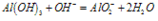
②向强碱溶液中滴入铝盐溶液 
O~A段: 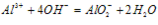
A~B段: 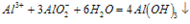
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到 时,产生最大沉淀量
时,产生最大沉淀量
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 
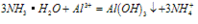
分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸
O~A段: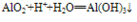
O~B段: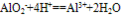
⑤向盐酸中滴加偏铝酸盐溶液 
O~A段: 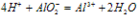
A~B段: 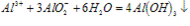
方法与技巧:
利用互滴顺序不同,现象不同可检验的溶液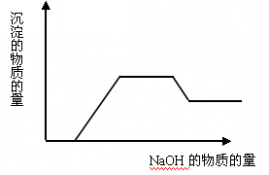 AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- 二 : 达喜铝碳酸镁片有哪些副作用

三 : 铝碳酸镁片的副作用是什么?
胃酸过多的患者服用一些抗酸药中和过多的胃酸即可减轻或缓解胃部不适,嗳气、吐酸水、恶心等症状即可消除。西药中含铝的抗酸药对胃溃、胃酸过多及其它胃肠疾病疗效确切、效力持久,并且价格低廉临床上一直作为抗溃疡的基本药物。那么,铝碳酸镁片的副作用是什么?
铝碳酸镁片具有抗酸、吸附、局部止血、保护溃疡面、促进溃疡愈合的作用,长期服用本品的情况比较普遍。
本品是非吸收性抗酸药,药物中含有难吸收的铝离子,口服后只能直接中和胃酸而有被胃肠道吸收。长期大量服用可在肠道内保留形成不溶性磷铝而沉积下来,并使得磷酸盐从粪便中丢失而导致低磷酸血症,进一步引起骨中钙的渗出丢失,最后引起代磷酸盐尿和高钙质尿,甚至铝中毒。
由此可见,为了避免铝中毒及钙流失,患者不宜长期大量服用本品。
为了您的健康,请在您的主治医生或者指导药师的指导下按疗程服用,并且同时随时接受随访,以便他们第一时间了解到您的用药情况,若期间有任何疑问或者不良反应,可第一时间向健客网在线医生进行咨询或者拨打
以上的内容仅是参考,犹豫药物的使用以及病情的不同性,在使用药物之前请登录健客网,在这里我们有专业的医生为您解答。
本文标题:铝碳酸镁片副作用-(12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。(1)碱式碳61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1