一 : 是什么组成了免疫系统?
我们生存在这个世界上,时时刻刻都在经受病毒、细菌的侵害,它们不断地危害着我们的健康。我们体内的免疫系统像一支装备精良的军队,不分昼夜,无时无刻不在保护着我们的健康。在每一秒钟,我们体内的免疫系统都在协调、调派不计其数且职能不同的免疫“部队”从事复杂的防护任务,它们是最尽职的士兵。它们不仅在时刻保护我们免受外来入侵物的危害,同时也能预防体内细胞突变而引发癌症的威胁。如果没有免疫系统的保护,即使是一粒灰尘也足以使我们付出生命的代价,这毫不夸张。未完待续,更多精彩请关注比比读微信公众号
二 : 免疫系统的组成
免疫系统的组成
在了解免疫系统之前,我想先让大家认识一下什么是细菌和病毒。您的身体是由大约100万亿个细胞组成的多细胞有机体。您体内的细胞是相当复杂的机器。每一个细胞都有其细胞核、能量产生装置等等。细菌是较之简单许多的单细胞有机体。例如,它们没有细胞核,它们可能只有人类细胞大小的1/100,大约1微米长。细菌是完全独立的有机体,它们能够进食及复制,它们在人的机体内有些像鱼在海洋中游。在适当的条件下,细菌复制得非常快,也许每20或30分钟一个细菌就会分裂成两个独立的细菌。以那样的速率,仅仅在几小时的时间内,一个细菌就会变成数百万个细菌。病毒总的来说是一种不同种类的有机体。一个病毒其实并不是真正地活着,一个病毒颗粒仅仅是包在一种保护性外衣中的一段DNA.病毒与一个细胞发生联系,将其粘附在细胞壁上并将其DNA注入细胞内。其DNA应用活细胞内的装置来复制新的病毒颗粒。最后,它侵犯的细胞死亡并崩解,释放出新的病毒颗粒;或者病毒颗粒会从细胞上伸出芽体以保持活性。也可以说,细胞是病毒的工厂。
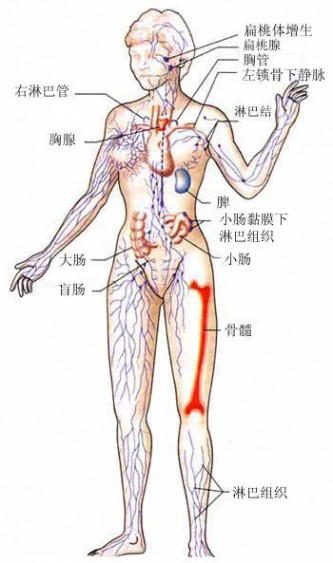
关于免疫系统,很有趣的一点是,尽管它终身都在人体内工作,但人们对其的认识可能很少甚至没有。例如,您可能知道在您的胸腔内有一个器官叫做心脏,谁不知道自己有心脏呢?你也可能知道您有肺、肝和肾。但是您听说过胸腺吗?也许您根本不知道您有一个胸腺,但是它就在您心脏的旁边。免疫系统中有许多其它像这样概念模糊的部分,因此让我们看一看免疫系统到底由哪些部分组成。
免疫系统中最明显的部分是你所能看见的。例如,皮肤是免疫系统中的一个重要组成部分,它作为病原体和机体之间的最基本的界限而发挥作用。皮肤作为屏障的部分功能很像我们用塑料来包裹并保护食物。对细菌和病毒来说,皮肤是坚韧的,并且是不能渗透的。表皮中含有一种特殊的细胞称为朗格罕斯细胞(在基底层中与黑色素细胞相混合),它们是免疫系统中一种重要的早期警报组分。皮肤同时也分泌抗细菌的物质,这些物质的存在就可以解释为什么清晨起床前您皮肤上会有一层物质——大多数落在皮肤上的细菌和孢子都会很快的死亡。
您的鼻、嘴和眼睛也是明显的细菌进入的通道。眼泪和粘液中都含有一种酶(溶菌酶),能降解许多细菌的细胞壁,唾液也有抗菌的功能。由于鼻道和肺的内表面附有一层粘液,所以许多未被立刻杀死的细菌都被粘液俘获并迅速被吞咽。巨噬细胞也排列在鼻道、咽喉、肺及皮肤的表面。任何试图进入体内的细菌或病毒都必须首先越过这些屏障。
一旦进入体内,病原体将在不同的水平上与免疫系统发生作用。免疫系统的主要组分有:。胸腺、脾、淋巴系统、骨髓、白细胞、抗体、补体系统、激素,让我们详细地看看其中的每一种组分。
三 : 免疫系统:免疫系统-简介,免疫系统-组成
免疫系统是生物体内一个能辨识出“非自体物质”(通常是外来的病菌)、从而将之消灭或排除的整体工程之统称。它能从自身的细胞或组织辨识出非自体物质(小从病毒,大至寄生虫)。所有植物与动物都具有先天免疫系统。人体内的免疫系统是人体抵御病原菌侵犯最重要的保卫系统。这个系统由免疫器官(骨髓、胸腺、脾脏、淋巴结、扁桃体、小肠集合淋巴结、阑尾等)、免疫细胞(淋巴细胞、单核吞噬细胞、中性粒细胞、嗜碱粒细胞、嗜酸粒细胞、肥大细胞、血小板等),以及免疫分子(补体、免疫球蛋白、干扰素、白细胞介素、肿瘤坏死因子等细胞因子等)组成。免疫系统是机体防卫病原体入侵最有效的武器,但其功能的亢进会对自身器官或组织产生伤害。
免疫系统_免疫系统 -简单介绍
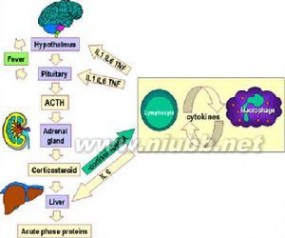 免疫系统流程图
免疫系统流程图免疫系统(immunesystem)免疫系统是生物体内1个能辨识出“非自体物质”(通常是外来的病菌)、从而将之消灭或排除的整体工程之统称。它能从自身的细胞或组织辨识出非自体物质(小从病毒,大至寄生虫)。所有植物与动物 都具有先天免疫系统。免疫系统并非完全有效,因为病菌或寄生虫能不断演化来感染宿主。
是机体保护自身的防御性结构,主要由淋巴器官(胸腺、淋巴结、脾、扁桃体)、其它器官内的淋巴组织和全身各处的淋巴细胞、抗原呈递细胞等组成;广义上也包括血液中其它白细胞及结缔组织中的浆细胞和肥大细胞。构成免疫系统的核心成分是淋巴细胞,它使免疫系统具备识别能力和记忆能力。淋巴细胞经血液和淋巴周游全身,从一处的淋巴器官或淋巴组织至另一处的淋巴器官或淋巴组织,使分散各处的淋巴器官和淋巴组织连成1个功能整体。免疫系统是生物在长期进化中与各种致病因子的不断斗争中逐渐形成的,在个体发育中也需抗原的刺激才能发育完善。
免疫系统各组分功能的正常是维持机体免疫功能相对稳定的保证,任何组分的缺陷或功能的亢进都会给机体带来损害。
免疫系统_免疫系统 -组成
 扫描电子显微镜下流动的人体血液。我们可以看见红血球、一些长像“突出”的白血球(包含淋巴球)、1个单核球、1个中球性以及许多盘状的血小板。
扫描电子显微镜下流动的人体血液。我们可以看见红血球、一些长像“突出”的白血球(包含淋巴球)、1个单核球、1个中球性以及许多盘状的血小板。人体内有1个免疫系统,它是人体抵御病原菌侵犯最重要的保卫系统。这个系统由免疫器官(骨髓、胸腺、脾脏、淋巴结、扁桃体、小肠集合淋巴结、阑尾等)、免疫细胞(淋巴细胞、单核吞噬细胞、中性粒细胞、嗜碱粒细胞、嗜酸粒细胞、肥大细胞、血小板等),以及免疫分子(补体、免疫球蛋白、细胞因子等)组成。
免疫系统是机体防卫病原体入侵最有效的武器,它能发现并清除异物、外来病原微生物等引起内环境波动的因素。但其功能的亢进会对自身器官或组织产生伤害。在很多由于自身免疫引起的疾病中,CD4+T细胞起着重要的作用。免疫系统分为固有免疫和适应免疫,其中适应免疫又分为体液免疫和细胞免疫。
免疫系统_免疫系统 -结构
免疫系统(immunesystem)是机体保护自身的防御性结构,主要由淋巴器官(胸腺、淋巴结、脾、扁桃体)、其它器官内的淋巴组织和全身各处的淋巴细胞、抗原呈递细胞等组成;广义上也包括血液中其它白细胞及结缔组织中的浆细胞和肥大细胞。构成免疫系统的核心成分是淋巴细胞,它使免疫系统具备识别能力和记忆能力。淋巴细胞经血液和淋巴周游全身,从一处的淋巴器官或淋巴组织至另一处的淋巴器官或淋巴组织,使分散各处的淋巴器官和淋巴组织连成1个功能整体。免疫系统是生物在长期进化中与各种致病因子的不断斗争中逐渐形成的,在个体发育中也需抗原的刺激才能发育完善。
机体执行免疫功能的器官、组织、细胞和分子的总称。器官包括胸腺、法氏囊或囊类同器官、淋巴结、脾脏、扁桃体;组织指机体内(特别是消化道、呼吸道粘膜内)存在的许多无被膜的淋巴组织;细胞主要指淋巴细胞、单核吞噬细胞、粒细胞;分子主要指免疫球蛋白、补体、淋巴因子以及特异性和非特异性辅导因子、抑制因子等参与机体免疫应答的物质。免疫系统各组分功能的正常是维持机体免疫功能相对稳定的保证,任何组分的缺陷或功能的亢进都会给机体带来损害。
免疫系统_免疫系统 -分布
免疫系统各组分广布全身,错综复杂,特别是免疫细胞和免疫分子在机体内不断地产生、循环和更新。免疫系统具有高度的辨别力,能精确识别自己和非己物质,以维持机体的相对稳定性;同时还能接受、传递、扩大、储存和记忆有关免疫的信息,针对免疫信息发生正和负的应答并不断调整其应答性。因此,免疫系统在功能上与神经系统和内分泌系统有许多相似之处。
然而,免疫系统功能的失调也会对人体极为不利:人体的识别能力异常容易导致过敏现象的发生(使用某种食物、注射药物出现过敏反应,甚至导致休克),反之则会引起反复感染;人体的自我稳定能力异常,会使免疫系统对自身的细胞作出反应,引发自身免疫疾病,诸如风湿性关节炎、风湿性心脏病等;人体的免疫监视的功能降低,如同失去了一位“警卫员”,使肿瘤有了可乘之机。由此可见,人体免疫系统对人类的健康起着举足轻重的作用,如果它的功能不稳定,人类很有可能会被病毒、细菌这些病原体侵害、折磨。
免疫系统_免疫系统 -组织
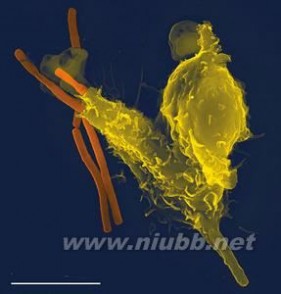 扫描电子显微镜图像1个中性粒细胞(黄色),吞噬了炭疽热细菌(橙色)。
扫描电子显微镜图像1个中性粒细胞(黄色),吞噬了炭疽热细菌(橙色)。骨髓是主要的造血器官,是各类血细胞的发源地。胚胎期血细胞生成场所最早在卵黄囊,后移至胚肝和胚脾,最后由骨髓替代。成年期造血功能主要发生在胸骨、脊椎、骼骨和肋骨等扁骨的红髓。血细胞的祖先是多能干细胞,继而增殖分化为淋巴系和髓系干细胞,再进1步增殖分化为单能干细胞或前体细胞进入血流。禽类的前体B细胞进入法氏囊成熟,哺乳类包括人类的前体B细胞仍继续留在骨髓内直至成熟。
胸腺是T细胞分化和成熟的场所,因而T细胞亦称胸腺依赖性T淋巴细胞。骨髓中的T淋巴系前体细胞(前体T细胞)经血循环进入胸腺后,也称胸腺细胞。它们在胸腺激素影响下,最终分化为成熟T细胞,随后释放入血液循环中。
成熟T细胞和B细胞通过血液循环到达淋巴结、脾脏和扁桃体等组织或器官,它们分别定居在固定的部位,成为机体的常驻警卫部队。若遇到病原体等抗原物质入侵,就能发生特异性免疫应答反应,产生免疫物质与之对抗。我们身体某个部位发生创伤炎症时,该部位附近的淋巴结便会肿大,这就是这些部位增加了“警卫部队”并在和病原体作战。
人类的吞噬细胞有大、小2种。小吞噬细胞是外周血中的中性粒细胞。大吞噬细胞是血中的单核细胞和多种器官、组织中的巨噬细胞,两者构成单核吞噬细胞系统。当病原体穿透皮肤或粘膜到达体内组织后,吞噬细胞首先从毛细血管中逸出,聚集到病原体所在部位。多数情况下,病原体被吞噬杀灭。若未被杀死,则经淋巴管到附近淋巴结,在淋巴结内的吞噬细胞进1步把它们消灭。淋巴结的这种过滤作用在人体免疫防御能力上占有重要地位,一般只有毒力强、数量多的病原体才有可能不被完全阻挡而侵入血流及其它脏器。但是在血液、肝、脾或骨髓等处的吞噬细胞会对病原体继续进行吞噬杀灭。
免疫系统_免疫系统 -免疫机制
为了解决这困难,宿主演化出能辨识并有效中和病菌的机转。
原始免疫机制
即使单细胞生物如细菌也有特别的酵素来对抗病毒的感染。基本免疫机制还保留在如植物、鱼类、爬行类及昆虫的后代;其演化自古代真核生物,该机制包含抗微生物肽的防御素、模式识别受体,及补体系统。
脊椎动物免疫机制
而最复杂精巧及近晚演化的免疫机制,则为脊椎动物[所拥有。像人体这般的脊椎动物,其免疫系统包含许多种类的蛋白质、细胞,器官及组织,形成一繁复互动的系统。这系统的其中一部分则随时间的演进能对特定的病菌产生更有效率的辨识能力。这对病菌的适应过程能产生免疫记忆,从而对将来重复感染的病菌有着更强的保护能力。这后天免疫的产生过程即是疫苗的基本原理。
免疫系统_免疫系统 -重要物质
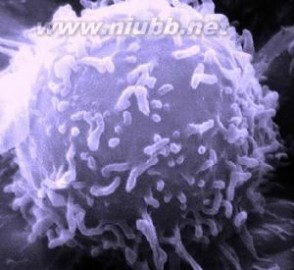 电子显微镜下的淋巴细胞,是人体免疫系统的主要组成。
电子显微镜下的淋巴细胞,是人体免疫系统的主要组成。人体与外界环境接触的表面,覆盖着一层完整的皮肤和粘膜。皮肤由多层扁平细胞组成,能阻挡病原体的穿越,只有当皮肤损伤时,病原体才能侵入。粘膜仅有单层柱状细胞,机械性阻挡作用不如皮肤,但粘膜有多种附件和分泌液。例如呼吸道粘膜上皮细胞的纤毛运动、口腔唾液的吞咽和肠蠕动等,可将停留在粘膜表面的病原体驱赶出体外。当宿主受寒冷空气或有害气体等刺激,上呼吸道粘膜屏障受损伤时,就易患气管炎、支气管炎和肺炎等。
皮肤和粘膜能分泌多种杀菌灭毒物质。例如皮肤的汗腺能分泌乳酸使汗液呈酸性(pH5.2-5.8),不利于细菌生长。皮脂腺分泌的脂肪酸,有杀细菌和真菌作用。不同部位的粘膜腺体能分泌溶菌酶、胃酸、蛋白酶等各种杀菌物质。
人体的正常菌群也有拮抗病原体的作用。例如口腔中的唾液链球菌产生的过氧化氢能杀死脑膜炎奈瑟氏菌、金黄色葡萄球菌、白假丝酵母菌等;咽喉部的甲型链球菌能抑制肺炎链球菌生长等。
免疫系统_免疫系统 -免疫屏障
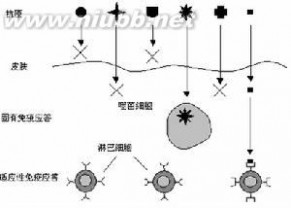 免疫系统的体系结构
免疫系统的体系结构人体为避免感染所提供的保护包括:物理屏障、化学屏障及生物性屏障。
物理屏障
叶子的腊状角质层、昆虫的外骨骼、蛋的壳膜与皮肤等都属于物理屏障,这是第一层抵御。然而,人体不可能与外界百分百隔离,所以我们需要其它方式来保护像肺、肠子及泌尿生殖道等人体的“漏洞”。以肺为例,咳嗽与打喷嚏就能将致病源与刺激物排出呼吸道。眼泪与尿液可以将致病源冲洗出去,而由呼吸道与泌尿生殖道所分泌的黏液则能将微生物给黏附起来。
化学屏障
同样也能防止感染。皮肤与呼吸道能分必抗生素胜肽,如β-defensins。唾液、眼泪与乳汁中的酵素,如溶解酶与A型磷脂质酶具有抗菌的效果。 月事后的女性靠著微酸性的阴道分必物提供化学屏障,男性精液则靠防御素与锌离子来杀死致病菌。 致病源随食物下肚后,胃中的胃酸与蛋白酶能提供强力的保护作用。
生物性屏障
在泌尿生殖道与肠胃道内,共生菌会和入侵的致病菌争抢食物与生存空间,有时它们也会改变所处环境的pH值或铁含量以增加自己的优势——那就是生物性屏障。借此,致病菌无法达到足够数量来造成疾病。然而,大部分抗生素只能(非特异地)消灭细菌,而对霉菌完全无效,所以口服抗生素可能反而使霉菌“过度滋长”,造成所谓的阴道念珠菌感染症(酵母菌感染)。 证据指出,将益生菌(如优格中常见的纯种培养乳酸菌)引入小孩体内,受感染的肠道能很快再次恢复得健康而平衡。近期对细菌性肠胃炎、发炎性肠疾病、尿道感染及手术后感染的研究更指出,同样的方法应用在这些疾病上也有异曲同工之效。
血脑屏障
血脑屏障不是1个特殊的解剖学上专有的结构,一般认为由软脑膜、脉络丝、脑血管和星状胶质细胞等组成。发育不够完善,所以容易发生脑膜炎、脑炎等疾患。
胎盘屏障
由母体子宫内膜的基蜕膜和胎儿绒毛膜组成。正常情况下,母体感染的病原体及其毒性产物难于通过胎盘屏障进入胎儿体内。但若在妊娠三个月内,此时胎盘结构发育尚不完善,则母体中的病原体等有可能经胎盘侵犯胎儿,干扰其正常发育,造成畸形甚至死亡。药物也和病原体一样有可能通过母体侵犯胎儿。因此,在孕期内,尤其是早期,应尽量防止发生感染,并尽可能不用或少用副作用较大的各类药物。
免疫系统_免疫系统 -功能
 免疫系统
免疫系统在感染过程中,各免疫器官、组织、细胞和分子间互相协作、互相制约、密切配合,共同完成复杂的免疫防御功能。病原体侵入人体后,首先遇到的是天然免疫功能的抵御。一般经7-10天,产生了获得性免疫;然后两者配合,共同杀灭病原体。免疫系统具有以下的功能:
保护
使人体免于病毒、细菌、污染物质及疾病的攻击。
清除
新陈代谢后的废物及免疫细胞与敌人打仗时遗留下来的病毒死伤尸体,都必须藉由免疫细胞加以清除。
修补
免疫细胞能修补受损的器官和组织,使其恢复原来的功能。健康的免疫系统是无可取代的,虽然它的力量令人赞叹,但仍可能因为持续摄取不健康的食物而失效。研究已证实,适当的营养可强化免疫系统的功能,换言之,影响免疫系统强弱的关键,就在于精确平衡的营养,不均衡的营养会使免疫细胞功能减弱,不纯净的营养会使免疫细胞产生失调,导致慢性疾病。营养免疫学的研究焦点就在于如何藉着适当的营养滋养身体,以维持免疫系统的最佳状态,进而使我们的免疫系统更强健,这是由陈昭妃博士撷取中国人对本草植物的使用心得,并融合对于营养免疫学的深入研究所创造的,是一门新世纪的健康科学,更是新时代的健康主流。
免疫系统_免疫系统 -职责
天然免疫是人类在长期的种系发育和进化过程中,逐渐建立起来的防御病原体的一系列功能。其特点是人人生来就有,并能遗传给下一代,而且不同种的生物免疫系统有差异。例如人不会得鸡霍乱也不会被犬瘟病毒感染;同样,动物不会患麻疹。然免疫与人体的组织结构和生理功能有密切联系。
士兵工厂
骨髓红血球和白血球就像免疫系统里的士兵,而骨髓就负责制造这些细胞。每秒钟就有800万个血球细胞死亡并有相同数量的细胞在这里生成,因此骨髓就像制造士兵的工厂一样。训练场地:胸腺就像为赢得战争而训练海军、陆军和空军一样,胸腺是训练各军兵种的训练厂。胸腺指派T细胞负责战斗工作。此外,胸腺还分泌具有免疫调节功能的荷尔蒙。
战场
淋巴结是1个拥有数十亿个白血球的小型战场。当因感染而须开始作战时,外来的入侵者和免疫细胞都聚集在这里,淋巴结就会肿大,甚至我们都能摸到它。肿胀的淋巴结是1个很好的信号,它正告诉你身体受到感染,而你的免疫系统正在努力地工作着。作为整个军队的排水系统,淋巴结肩负着过滤淋巴液的工作,把病毒、细菌等废物运走。人体内的淋巴液大约比血液多出4倍。
血液过滤器
脾脏脾脏是血液的仓库。它承担着过滤血液的职能,除去死亡的血球细胞,并吞噬病毒和细菌。它还能激活B细胞使其产生大量的抗体。
咽喉守卫者
扁桃体扁桃体对经由口鼻进入人体的入侵者保持着高度的警戒。那些割除扁桃体的人患上链球菌咽喉炎和霍奇金病的机率明显升高。这证明扁桃体在保护上呼吸道方面具有非常重要的作用。
免疫助手:盲肠盲肠能够帮助B细胞成熟发展以及抗体(IgA)的生产。它也扮演着交通指挥员的角色,生产分子来指挥白血球到身体的各个部位。盲肠还能“通知”白血球在消化道内存在有入侵者。在帮助局部免疫的同时,盲肠还能帮助控制抗体的过度免疫反应。
肠道守护者
病原微生物最易入侵的部位是口,而肠道与口相通,所以肠道的免疫功能非常重要。集合淋巴结是肠道黏膜固有层中的1种无被膜淋巴组织,富含B淋巴细胞、巨噬细胞和少量T淋巴细胞等。对入侵肠道的病原微生物形成一道有力防线。
免疫系统_免疫系统 -工作过程
免疫系统的工作过程
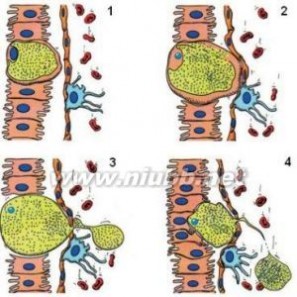 疟原虫劫持肝细胞躲避免疫系统当病菌、病毒等致病微生物进入到人体后,免疫系统中的巨噬细胞首先发起进攻,将它们吞噬到“肚子“里,然后通过酶的作用,把他们分解成1个个片断,并将这些微生物的片断显现在巨噬细胞的表面,成为抗原,表示自己已经吞噬过入侵的病菌,并让免疫系统中的T细胞知道。
疟原虫劫持肝细胞躲避免疫系统当病菌、病毒等致病微生物进入到人体后,免疫系统中的巨噬细胞首先发起进攻,将它们吞噬到“肚子“里,然后通过酶的作用,把他们分解成1个个片断,并将这些微生物的片断显现在巨噬细胞的表面,成为抗原,表示自己已经吞噬过入侵的病菌,并让免疫系统中的T细胞知道。免疫系统_免疫系统 -过敏反应
免疫系统功能过于强烈也能导致疾病,这是因为过度反应的免疫会将自身组织当成外来的病菌而攻击所产生,此即为自体免疫性疾病。常见的自体免疫疾病包含类风湿性关节炎,第一型糖尿病及红斑性狼疮。人体免疫对疾病所扮演的重要角色是目前科学研究的重点。
先天免疫
后天免疫
非专一性反应
致病源与抗原专一性反应
病源曝露后立即有强烈反应病源曝露后须过一段时间才有强烈反应细胞性和体液性物质
细胞性和体液性物质
无免疫记忆
具免疫记忆
可在所有生物体内发现
仅可在具有下颔之脊椎动物体内发现
无论先天免疫或后天免疫都必须懂得如何分辨自体及非自体分子。在免疫学里,自体物质是指那些免疫系统能在陌生物质中辨识出的自体分子。相反地,非自体分子是指被辨识为外来物的物质。部分的非自体分子被称作抗原(刺激人体产生抗体的物质),被认为能够与特异的免疫受体产生键结,从而刺激免疫反应的发生。免疫系统_免疫系统 -历史年表
1798年 Jenner尝试接种法从而开启了遗传学的大门
1881-1885年 Pasteur制出抵御霍乱,炭疽病,狂犬病的疫苗
1882年 Mechnikov发现了巨噬细胞的噬菌性
1890年 Behring尝试使用被动免疫疗法治疗破伤风
1900年 Landsteiner发现了ABO血型.红十字会建立
1906年 Pirquet发现了过敏症
1910年 Dale发现了组胺并建立了抗组胺剂工业
1922年 Fleming发现了溶菌酶和青霉素
1944年 Medawar尝试皮肤移植(但排斥反应剧烈)
1947年 Owen发现了孪生子间相互不产生排斥
1957年 Isaacs和Lindemann发现了干扰素
1959年 Gowans发现了淋巴循环
1960年 淋巴细胞修饰
1961年 发现了免疫反应和甲状腺之间的关系
1966年 发现了T-B细胞关联反应
1971年 发现了T细胞抑制效应
1974年 Jerne推断出免疫控制的整套理论构架
1975年 Milstein及Kohler制出单克隆抗体
1981年 天花绝了,爱滋来了
1984年 发现T细胞受体结构
1987年 发现I型MHC结构
四 : 免疫:免疫-免疫系统组成,免疫-免疫小结
免疫指生物机体识别和排除抗原物质的一种保护性反应,是人体的一种生理功能,人体依靠这种功能识别“自己”和“非己”成分,从而破坏和排斥进入人体的抗原物质,或人体本身所产生的损伤细胞和肿瘤细胞等,以维持人体的健康。同时,可以抵抗或防止微生物或寄生物的感染或其它所不希望的生物侵入的状态。免疫涉及特异性免疫(后天免疫系统)与非特异性免疫(先天免疫系统),非特异性成分不需要事先暴露,可以立刻响应,可以有效地防止各种病原体的入侵。特异性免疫是在主体的寿命期内发展起来的,是专门针对某个病原体的免疫。
免疫_免疫 -免疫系统组成
免疫系统是由免疫器官、免疫细胞和免疫活性物质组成的。
免疫器官
免疫细胞生成、成熟或集中分布的场所,包括骨髓、胸腺、脾、淋巴结等
免疫细胞
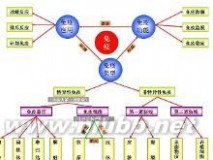 免疫树形图
免疫树形图(发挥免疫作用的细胞):
1.吞噬细胞2.淋巴细胞起源:骨髓中的造血干细胞
T细胞(在胸腺中成熟)
B细胞(在骨髓中成熟)
免疫活性物质
由免疫细胞或其他细胞产生的发挥免疫作用的物质,包括抗体、淋巴因子、溶菌酶 等。
免疫_免疫 -免疫小结
人们经常听到"免疫"一词,一般会简单地认为免疫就是指人体的抵抗力,但对免疫的真正含义并不十分了解。从本质上讲,免疫是指机体的1种生理性保护功能。它包括机体对异物( 病原生物性或非病原生物性的)的识别、排除或消灭等一系列过程。这种过程可能引起自身组织损伤,也可能没有组织损伤。概括起来说,免疫系统的功能主要表现为三方面,即防御功能、稳定功能及免疫监视作用,这些功能一旦失调,即产生免疫病理反应。当自我稳定功能过高时,会可能患类风湿关节炎等;当防御保护功能过高时,会出现过敏反应,过低则会得免疫缺陷综合症;免疫监视功能过低时,可能会形成肿瘤等。
机体的免疫能力可大致分为特异性免疫与非特异性免疫2种,两者是密切联系的。非特异性免疫是生物在种系发展过程中不断与病原微生物斗争中形成的,并可遗传给后代的1种免疫功能。它是与人体的组织结构和生理机能密切相关的。特异性免疫是机体在后天受内外环境因素的刺激而获得的免疫功能,它能识别再次接触的相同抗原,并作出相应的反应,它需要在高度分化的组织和细胞的参与下才能完成。
免疫通常对机体是有利的,但在某些条件下也可对机体造成损害(例如:过敏是由免疫系统对外来物质过度敏感引起的。)
能提高免疫力的食品
1.灵芝:灵芝可增强人体的免疫力,这是因为灵芝含有抗癌效能的多糖体,此外,还含有丰富的锗元素。锗能加速身体的新陈代谢,延缓细胞的衰老,能通过诱导人体产生干扰素而发挥其抗癌作用
2.新鲜萝卜:因其含有丰富的干扰素诱导剂而具有免疫作用;
3.人参蜂王浆:能提高机体免疫力及内分泌的调节能力,并含具有防癌作用的蜂乳酸
4.蘑菇、猴头菇、草菇、黑木耳、银耳、车养、百合等:都有明显增强免疫力的作用
5.香菇:香菇所含的香菇多糖能增强人体免疫力。
6. 蜂胶:在保健食品中多用于增强免疫力功能。
7,松花粉:国珍松花粉富含200多种营养元素,可以满足人体的需求,特别是微量营养元素的需求,有效提高人体的免疫力,可以有效解决人体的细胞潜饥饿,有效解决人体的酸性体质。
免疫_免疫 -精神、心理、意识免疫
精神免疫学是研究心理活动过程对免疫功能的影响,并利用心理治疗方法增强免疫应答能力或预防疾病的发生。
20世纪80 年代,人们对神经内分泌免疫网络的研究取得了重要进展 ,并由此开创了精神免疫学。21世纪初,为了有效的遏制癌症,各国科学家联合开展了生命方舟计划,其原理就是研究社会- 环境- 情绪的相互关系。实践证明:社会- 环境- 情绪是诸多疾病的致病因素,有人将此类因素概括为:身心医学。例如:在第二次世界大战期间 ,胃溃疡的发病率较和平时期高出数倍,这是由于战时的精神紧张、恐惧、悲痛等因素 ,破坏了体内各系统功能平衡的结果。近10 年的研究表明,免疫反应是人体生理反应的一个环节 ,它受控于神经系统,神经系统的变化必然影响到人体的免疫功能.
精神免疫学是研究机体在面临紧张刺激的情况下,高级中枢神经系统与免疫系统的相互作用以及这种作用在情绪致病中的地位和机制。它是近年来新兴的医学边缘学科之一,它将医学、免疫学、生理学、神经内分泌学等相关生物科学与心理学、社会学、文化学,乃至哲学等人文科学有机地结合在一起,在生物-心理-社会医学模式的指导下,精心培育并发展壮大的一门新型学科。
免疫_免疫 -饮食调理提高免疫力
免疫力是指机体抵抗外来侵袭,维护体内环境稳定性的能力。空气中充满了各种各样的微生物:细菌、病毒、支原体、衣原体、真菌等等。在人体免疫力不足的情况下,它们都可以成为感早班的病原体。虽然人体对不同的病原体会产生相应的抗体,以抵御再次感染,但抗体具有专一性和时限性,比如链球菌抗体只能在较短时期内保护机体不受链球菌的再次侵犯,也并不能抵御其他病毒的感染。免疫力低下的人根本无法抵御感冒病毒的侵袭,这才是他频繁感冒的真正原因。日常饮食调理是提高人体免疫能力的最理想方法:
1、多喝酸奶:坚持均衡饮食,如果人出现酗酒、精神紧张或饮食不平衡等情况,会使人的抗病能力削弱。要纠正这种失衡,必须依靠养生细菌,酸奶中就含有这类细菌。
2、多饮开水:记住,是白开水!这样能使鼻腔和口腔内的黏膜保持湿润;多喝水还能让人感觉清新,充满活力。研究证明,白开水对人体的新陈代谢有着十分理想的生理活性作用。水很容易透过细胞膜而被身体吸收,使人体器官中的乳酸脱氢酶活力增强,从而有效地提高人体的抗病能力和免疫能力。特别是晨起的第一杯凉开水,尤为重要。
3、多吃海鲜:海鲜中含有丰富的铁、锌、镁、硒、铜等,经常食用能促进免疫功能。
4、经常喝茶:科学家发现,茶叶中含有1种名叫茶氨酸的化学物质。由于它能够调动人体的免疫细胞去抵御细菌、真菌和病毒,因此,可以使人体抵御感染的能力提高5倍以上。
5、不妨饮点红酒:大部分酒精饮料会对人体的免疫系统起到抑制作用,但红酒恰恰相反,它含有的一些抗氧化物质对增强免疫功能很有好处,而且还有利于保护心脏。
6、吃些动物肝脏:动物肝脏含有叶酸、硒、锌、镁、铁、铜,以及维生素B6、B12等,这些物质有助于促进免疫功能。
7、研究发现,冬虫夏草能有效增加免疫系统细胞、组织数量,促进抗体产生,增加吞噬、杀伤细胞数量、又可以调低某些免疫细胞的功能,是增强人体免疫力的首选。配方:选用天然虫草素含量较高的福临门冬虫夏草粉碎后服用,每次1.5克,每日2次,连续服用10天大部分免疫力低下的患者均可取得显着的疗效。
8、适当补充铁质:铁可以增强免疫力;但铁质摄取过量对身体有害无益,每天不能超过45毫克。
9、补充谷氨酰胺:它是人体不可或缺的非必需氨基酸,堪称强化免疫系统的“利器”之一。经常感冒或腹泻的人,可将谷氨酰胺粉剂加入果汁或凉开水中服用。
10、补充精氨酸:海参、鳝鱼、泥鳅、墨鱼以及山药、黑芝麻、银杏、豆腐皮、冻豆腐、葵花子、榛子富含这种物质,多食用有助于增强免免疫力。
五 : 硬骨鱼免疫系统的组成与免疫应答机制研究进展70
第28卷第2期
2010年4月海洋科学进展ADVANCESINMARINESCIENCEVol.28??No.2April,2010
硬骨鱼免疫系统的组成与
免疫应答机制研究进展*
王卫卫,吴谡琦,孙修勤,樊廷俊1,22*21
(1.中国海洋大学海洋生命学院,山东青岛266001;2.国家海洋局第一海洋研究所,山东青岛266061)
摘??要:硬骨鱼是最低等的兼具固有与适应性免疫系统的脊椎动物。文章分别就硬骨鱼免疫系统的组织结构与细
胞组成、主要免疫细胞的特性与功能以及抗原诱导的固有与适应性免疫应答等方面概括了近年来的主要研究进
展。在与哺乳类等高等动物免疫系统比较异同的基础上,概括出硬骨鱼免疫系统所具有的基本特征:1)鱼类在免
疫基因、细胞与功能上较为保守,在免疫器官形态和结构上差异较大;2)鱼类具有完全的固有与获得性免疫应答体
系,但其固有免疫作用可能更为重要,主要表现在胚系基因编码受体的种类与抗原识别范围更广,应答启动条件相
对较低而免疫效应则相对强化;3)鱼类获得性免疫组成与结构较为简单,获得性免疫应答的发生相对滞后,应答效
能较低。硬骨鱼免疫系统的组成与功能特性与其自身所处的环境和变温性质密不可分。
关键词:鱼类;免疫系统;综述
中图分类号:Q952.5??????????文献标示码:A??????????文章编号:1671??6647??(2010)02??0257??09
鉴于鱼类所处的进化地位以及水产养殖业的高速发展,鱼类免疫系统日益为人所关注。对鱼类免疫系统的研究不仅为高等生物免疫演化途径提供重要的参考,同时也为日趋严重的养殖鱼类的病害防治提供必要的免疫理论与应用基础。本文概括了近年来在鱼类免疫学研究所取得的进展,就鱼类(主要是硬骨鱼类)免疫系统的器官、细胞组成与结构及其功能作一概述。
1??免疫系统的器官组成与结构
目前的研究证据证明鱼类与哺乳类在免疫的分子组成与功能上都相当接近,然而在形态结构上存在显著的分化。即使鱼类自身,由于种类繁多(超过23000种),形态各异,免疫器官及其结构也不尽相同。总体而言,鱼类的主要免疫器官为头肾、脾脏和粘膜相关淋巴组织(MALT),但不具备高等脊椎动物(如哺乳类)的骨髓和淋巴结。这种结构并没有明显影响免疫系统的功能,但生血过程发生了显著的改变。
目前已知的鱼类一级淋巴器官只有胸腺,但功能至今仍未得到直接证实,推测也是T细胞成熟与分化的场所。虽然其结构和形态在鱼类中存在很大差异,但细胞组成基本相近,特别是巨噬细胞的大量聚集、DC样细胞、特化的上皮细胞以及胸腺小体等组成都提示其功能与哺乳类相似,鲫鱼的Rag??1基因在受精卵发育的第4天最早在胸腺表达,提示淋巴细胞在此区域的富集及重排事件的发生,而一周后形成的Rag+、Rag??区域说明皮髓质的早期分化[1??3]。头肾相当于一种二级淋巴器官,在免疫应答发生过程中有关键作用。虹鳟鱼在注射放射性标记的细菌后,70%以上的细菌驻留在头肾,说明这里是抗原捕获与启动免疫应答的主要部位。我们对牙鲆进行攻毒(LCDV??cn)的免疫组化和免疫印迹的研究结果也表明,头肾是病毒抗原的识别与*收稿日期:2009??03??27
资助项目:国家重点基础研究计划项目??????鱼类多价疫苗的设计与应用策略(2006CB101807);中央级公益性科研院所基本科研业务费
专项资金??????牙鲆主要免疫细胞的功能鉴定与抗原识别和提呈机制的研究(GY??2008T31)
作者简介:王卫卫(1983??),女,山东青岛人,硕士研究生,主要从事细胞免疫方面研究.E??mail:woshiluwei06@163.com
????*通讯作者,E??mail:wusuqi@fio.org.cn????)
加工部位。此外,头肾中大量的巨噬细胞、内皮细胞与黑色素巨噬细胞也可能对抗原的捕获与免疫记忆有重要作用,因而被称为网状内皮系统。头肾同时也是生血中心,类似于哺乳类的骨髓,但由于缺乏特异性抗体,各种前体细胞和干细胞无法识别,因此生血过程仍不明[4]。多数鱼类的脾脏与高等动物类似,由红髓和白髓组成,前者占据了脾脏的绝大部分,主要包含巨噬细胞和淋巴细胞;而后者则主要为黑色素巨噬细胞中心和椭球体。黑色素巨噬细胞中心是裂解红细胞的主要组织,而且能以免疫复合体的形式长期驻留抗原,因而被认为是高等动物生发中心的类似结构。椭球体为小动脉的末端,含有网织细胞和巨噬细胞,可能与血液携带抗原的捕获有关。粘膜相关淋巴组织包括皮肤、肠和鳃淋巴组织,但鱼类尚未发现与哺乳类派尔氏结相似的组织。在这些淋巴组织中可见淋巴细胞、巨噬细胞、粒细胞、浆细胞等,在固有免疫和获得性免疫应答中具有一定的作用[5??7]。
2??主要免疫细胞的特性与功能
鱼类主要的免疫细胞包括淋巴细胞、单核/巨噬细胞、粒细胞、血栓细胞、树突状细胞(DC)、黑色素巨噬细胞等。由于鱼类普遍缺乏各种免疫相关的特异性抗体,因此细胞的生物学鉴定基本是参照高等动物相关细胞以间接方式开展的。目前研究较为深入的有巨噬细胞、T/B淋巴细胞。金鱼由于成功构建了肾脏原代巨噬细胞系从而为鱼类巨噬细胞的鉴定提供了最为可信的证据。金鱼的巨噬细胞在形态(包括显微与超微结构)、吸附特性、多核巨细胞的形成、非特异性酯酶活性、趋化性等方面均有着哺乳动物巨噬细胞的特征,特别是具有吞噬利什曼原虫(哺乳动物巨噬细胞的专性胞内病原体)和绵羊红细胞的能力证明了金鱼巨噬细胞的生物学特性。同时金鱼巨噬细胞也能够对脂多糖(LPS)和巨噬细胞活化因子(MAF)产生应答,生成活性O2与NO中间体。此外,与哺乳动物相类似,金鱼的巨噬细胞集落刺激因子(M??CSF)是活化巨噬细胞并使其增殖最重要的细胞因子,其受体CSF??1R仅在巨噬细胞谱系中表达。M??CSF还对巨噬细胞的功能有重要的调节作用,能有效活化单核/巨噬细胞并增强其趋化性、吞噬性和抗菌性,促进纤维酶原、前列腺素E、活性氧与NO中间体的合成,还能诱导其它细胞因子如G??CSF、GM??CSF、Il??1/6/8、TNF??、IFN的合成。这些功能充分说明了鱼类巨噬细胞的免疫学活性。
B细胞是介导体液免疫应答的主要效应细胞,其标志为抗体的合成与分泌能力与MHCII的限制性。通过对重组基因RAG??1/2、TdT、转录因子Ikaros的表达研究,已经确定虹鳟鱼B细胞在头肾中发育形成,而且在不同组织中的B细胞存在异质性。哺乳动物B细胞已知存在不同的发育阶段,从而形成不同的B细胞组成。静息期B细胞高水平表达mIg、MHCII以及转录因子的主要调节分子B细胞特异性活化蛋白Pax??5,与抗原或丝分裂原共存时进入活化阶段,标志为sIg合成水平较低、MHCII表达的上调以及原癌基因c??cmy的激活。活化后的B细胞增殖成为浆细胞,MHCII与mIg表达均下调,Blimp??1起始表达,并下调Pax??5的表达从而增强Ig的合成,同时终止c??cmy的表达,使细胞不再进入分裂周期。目前硬骨鱼(虹鳟鱼、斑点叉尾鮰、鲫鱼等)的研究资料表明鱼类的B细胞的成熟、分化与应答与哺乳类的相似[7,15]。比较特殊的是,虹鳟鱼经过抗原(LPS)诱导静息期B细胞发现,头肾和脾脏均能产生大量的浆细胞,而血液中(PBMC)却未检测到浆细胞的存在。由于鱼类LPS的识别主要依赖于模式识别受体PAMP(如TLR9)[16,17][14][8??13],因此这一现象提示鱼类B细胞对抗原的识别与哺乳类有所差异,这与我们在牙鲆的多肽免疫研究中的发现有一定的相似性。此外,近来还发现虹鳟B细胞具有很强的吞噬能力,而且吞噬后通过降解途径形成融合的吞噬溶酶体,进而杀灭其中的细菌。鱼类的B细胞功能上类似于哺乳类的B??1,膜表面表达单体IgM,以五聚体IgM形式分泌。哺乳类的B??1在发育中的前体细胞??双能B巨噬细胞??及鱼类B细胞的吞噬活性有力的说明B细胞与巨噬细胞在进化中的关联性[18]。
T细胞是适应性免疫应答中关键的效应细胞。在哺乳类等高等动物中已鉴定出至少2种表面标记与表达谱式各不相同的主要亚群,即CD4+和CD8+T细胞,前者为辅助性T细胞,参与免疫应答的几乎每个过程
CD4+为MHCII类限制性,而CD8+为MHCI类限制性。活化的CD4+T细胞有2个亚群,Th1、Th2,主导免疫应答的发展方向??????体液的抗体应答或细胞免疫应答。Th1可调节致炎症细胞介导的免疫应答并产生DTH反应,主要分泌Il??2、IFN??、TNF??等细胞因子;Th2主要可促进B细胞增殖并分化为浆细胞、分泌特异性抗体介导体液免疫和I型超敏反应,分泌的细胞因子主要有Il??4/5/6/10/13等。Il??4/10/12与IFN的共同调节驱使Th0(初始CD4+T细胞)向Th1或Th2的转化。
鱼类由于缺乏T细胞表面的有效标记,因此至今仍未鉴定出与哺乳动物相对应的T细胞及其亚群。实际上,与哺乳类已确定细胞免疫依赖于T细胞不同,目前鱼类T细胞定义是在哺乳动物T细胞特异性有丝分裂原(ConA、PHA)刺激下能够增殖的sIg??细胞[19]。鱼类T细胞的细胞免疫能力是通过体外的混合淋巴细胞反应(磁珠分离胸腺sIg??细胞T细胞丝分裂原的刺激与MLR反应中均能显著提升CD4mRNA的转录水平)、细胞因子的合成、T细胞有丝分裂原的诱导增殖(ConA、PHA)与体内的移植排斥反应和DTH反应得到证明的[21]。随着基因组资料的累积,近年来在T细胞基因的克隆方面进展迅速,已经克隆出包括牙鲆、虹鳟、鲫鱼、斑马鱼等多种鱼类的T细胞表达的主要基因,如TCR(包括??、??、??和??)、Ikaros(T细胞早期表达的转录因子)、p56(T细胞特异性激酶)、MHCI/II、CD3、CD4、CD8等。从这些基因的组成及其表达蛋白的结构预测中可以推定鱼类具有与哺乳类相仿的T细胞组成与功能。lck[22??26][20]
3??固有免疫与获得性免疫
鱼类是已知兼具固有与获得性免疫最低等的脊椎动物,也具有完全的体液和细胞免疫应答。与哺乳类不同,鱼类的固有免疫系统在抵抗病原体感染的免疫应答中作用更为重要,主要是因为鱼类属于变温动物,淋巴细胞的增殖较为缓慢,获得性免疫应答的发生相对滞后(可长达12周);其次,在进化上鱼类的免疫系统也不如高等动物完善,抗体的亲和力、抗体库的大小均明显低于哺乳类。
3.1??抗原的识别、加工与呈递
抗原识别是启动免疫应答的关键,其实质就是识别自我与非我的过程。对不同性质抗原的识别与加工决定了免疫应答的发展方向。
3.1.1??固有免疫系统的抗原识别
抗原识别是启动免疫应答的关键,其实质就是识别自我与非我的过程。高等脊椎动物固有免疫系统主要通过胚系基因编码的模式识别受体PRR识别多细胞生物通常不表达的保守分子,包括病原体相关分子模式PAMP,如细菌DNA中的CpG、细菌的脂多糖LPS、RNA病毒等等。此外,PRR还可识别宿主自身受损、炎症或凋亡细胞释放的危险信号(包括DNA、RNA、热激蛋白等),以维持免疫自稳。PRR可分为可溶性与膜结合受体两类,前者在鱼类中已分离出补体分子C3、凝集素等等,而后者则有巨噬细胞和中性粒细胞的????1,3??葡聚糖受体以及TLR。目前已知这些受体可活化的信号通路与哺乳类相似,如补体的经典、凝集素与替代途径、Toll通路等,相应的基因在鱼类中也已克隆出不少于十几种(TLR、I??B??、TIR、Nkamp等)[27??30],说明鱼类固有免疫的抗原识别、信号传导与免疫应答具有高度的保守性。但鱼类也有其自身的特性,例如鱼类的补体系统在低温时就可活化,而且替代途径的效价高出哺乳类数个数量级。同时通过替代途径,鱼类可裂解多种动物的红细胞,而人类则仅限于兔红细胞,提示鱼类能够识别更多的外源细胞表面。其原因可能在于,与人类不同,鱼类的补体存在多种亚型,其中最显著的是C3,可由多个基因编码产生不同的亚型。据此推测鱼类C3结构与功能多样性使之能够识别更多的微生物,因而扩大了固有免疫的识别能力。高效价、活化的温度范围广以及关键成分的多样性使补体成为鱼类强有力的防御体系,也是鱼类对环境的适应结果[31,32]。此外,鱼类的TLR与哺乳类也有显著差异,如TLR5只在鱼类中存在,TLR19??23在哺乳类中也未发现同源基因,虽然有些TLR可能识别的PAMPs与哺乳类相近(如TLR4),但众多的TLR受体也说明鱼
3.1.2??获得性免疫系统的抗原识别、加工与呈递
诱导获得性免疫应答的TD抗原(T细胞依赖抗原)通过APC(抗原呈递细胞,如B细胞、单核/巨噬细胞、DC细胞等)加以识别,一般存在内外源抗原两种呈递途径。内源性抗原经APC识别后,通过蛋白酶体和泛素的酶解、转运呈递到细胞表面,形成MHCI??抗原多肽复合体,并在CD3等共刺激分子的共同作用下与TCR、CD8形成非共价连接从而为CD8+T细胞所识别,进而产生CTL等细胞免疫应答。外源性抗原则通过内体(内吞小泡)途径形成MHCII??抗原多肽复合体,呈递给CD4+T细胞,通过信号传导与细胞因子的合成诱发相应的应答。
鱼类目前已确定单核/巨噬细胞、B细胞(或淋巴细胞)具有相似的抗原识别与加工呈递能力,斑点叉尾鮰的单核细胞系通过内吞摄取蛋白抗原,加工后再次将免疫原性肽呈递到细胞表面(类似于外源途径)。同时在大黄鱼中已克隆出蛋白酶体活化因子PA28????,并证明在病毒感染下其表达与MHCI的??链、??2m微球蛋白的表达同步增强,这与哺乳类的内源性呈递途径是一致的[35,36]。我们制备了LCDV的多肽疫苗并免疫牙鲆发现,免疫原性肽不仅能诱导牙鲆产生特异性体液免疫应答,同时也能产生细胞免疫应答,但其原因是抗原呈递到CD4+T细胞继而引发的CTL应答,或是CD8+T细胞通过其它途径加以识别尚不得而知。哺乳类的T????亚群可直接识别抗原,而鱼类也已克隆出??和??,提示鱼类可能也存在这种途径。近来发现鱼类表达MHCII分子的黑色素巨噬细胞、上皮细胞与嗜酸性粒细胞(功能上等同于哺乳类的中性粒细胞)也具有抗原识别与加工能力[26][33,34],提示鱼类拥有更多的APC细胞类群,其呈递方式也可能更为多样化。已知鱼类APC加工抗原的效率与温度有关,斑点叉尾鮰单核细胞在适温条件(27??)下二次淋巴细胞增殖的响应速度与强度均优于低温条件(11??、17??),但生理极限低温(4??)并不会对APC的抗原呈递功能造成损伤,这与高等动物是不同的[37]。
脊椎动物MHC基因是已知最具多态性的基因,也是抗原呈递途径中的关键基因。MHC基因中最富于多态的部分集中于多肽结合区域(PBR),PBR的多样性使其产生不同的等位基因从而呈递不同的抗原多肽,抗原呈递的这种变异就可能在功能上导致抗病力的差异[38]。MHCI/II分子呈递经蛋白水解的抗原多肽至I类限制性CD8T细胞或II类限制性CD4T细胞。I类分子几乎表达于所有有核细胞表面,而II类则仅限于在淋巴/骨髓系细胞(主要为单核/巨噬细胞、B细胞、DC细胞)中表达。
与人类不同,通常认为硬骨鱼的MHC基因相对简单,在这一??简单的??MHC基因中最为特殊之处就在于缺乏I、II基因之间的连锁,有可能有助于两类MHC之间相互独立的进化[39]。细胞因子是诱导MHC表达重要的调控因子,IFN介导的MHCI、II表达上调被认为可诱导抗病毒感染的细胞免疫应答。成纤维细胞与其他细胞分泌的IFN??、??以及NK、T细胞表达的IFN????能迅速诱导哺乳类表达MHCI分子。IFN同样也能诱导MHCII的表达,特别是IFN????可活化II类反式作用因子CIITA。I类IFN通过IFN诱导基因因子复合体3(ISGF??3)与IFN受激反应元件(ISRE)的启动子相结合而活化,而IFN????诱导基因的活化则是通过??活化因子复合体(GAF)与??活化位点(GAS)启动子的结合形成的。虽然鱼类MHC结构上比较简单(因而有人建议以MH命名),但抗原呈递中关键基因以及多种免疫基因启动子调控元件的克隆,说明鱼类拥有与高等生物相似的抗原呈递途径和活化机制。
3.2??固有免疫应答
抗原识别后诱导的体液与细胞免疫应答已在鱼类中得到明确界定。鱼类的固有免疫系统也具有天然的物理、化学屏障,如鱼鳞、皮肤、鳃粘膜(含凝集素、正五聚蛋白、溶菌酶、补体蛋白、抗菌肽、天然抗体IgM),上皮组织等。体液中存在的诸多化学因子也有重要的抗感染作用,如转铁蛋白(也可在诱导后发挥急性期蛋白作用并活化巨噬细胞)、溶菌酶(也具有调理作用,可活化补体系统和吞噬细胞)、抗菌肽等,无须诱导即产生抗感染作用[31]。与哺乳类相同,鱼类诱导产生的固有免疫应答主要也依赖于细胞因子和趋化因子。现在已经分离出具有生物学活性的鱼类细胞因子和趋化因子包括TNF????
([44][41][40]、IL??6[42]、I/II类IFN[43]及其诱导表达[45]??[46]I[47,48]
的相关基因则数以百计,其中的一些基因在结构上虽然与哺乳类有很大差异,如所有鱼类I类IFN基因在结构上与哺乳类II类IFN极其相似(5个外显子与4个内含子),在序列上却与II类IFN更为接近,但在功能上仍然相同[49]。这些细胞与趋化因子的作用机理也类似于高等动物,将吞噬细胞招募至感染部位,引发炎症反应、活化补体系统,进而吞噬或裂解侵入的病原体。
3.3??获得性免疫应答
虽然目前还不清楚鱼类T细胞的组成,但T和B细胞介导的获得性免疫应答已经得到证实。高等动物获得性免疫应答的启动是通过T细胞识别抗原多肽与协同刺激分子B7.1、B7.2开始的,活化后的致敏T细胞产生IL??2引起淋巴细胞增殖并分化。感染早期巨噬细胞、NK、DC细胞和T细胞分泌的细胞因子决定了细胞与体液免疫的取向。一般Th1细胞因子(包括IL??2、IFN????、IL??12、TNF????)通过活化巨噬细胞产生抗胞内病原体的免疫应答,同时强化抗原呈递并诱导T细胞分化。而Th2细胞因子则有IL??4、5、6、10、13,主要抗外源病原体,强化抗体的形成。
低等脊椎动物是否也具有Th1、2免疫应答几十年来一直有争议,近来已证明鱼类具有细胞介导的免疫应答。如上所述,许多抗原呈递途径的关键分子如MHCI、II、TCR、CD3、CD4、CD8都已在鱼类中发现[50],而一些驱使Th1应答的关键细胞因子,如IL??12、18也已在鱼类中克隆,特别是鱼类IFN????的生物学活性已得到确认,说明鱼类可能同样具有CD4亚群。
IFN????主要由Th1T细胞和NK细胞合成、分泌,作用于多种细胞类型,包括巨噬细胞、T细胞、NK细胞,调节固有与细胞介导的免疫应答。其活化形式为一非共价连接的同二聚体,结合到含IFN????受体R1、R2的受体复合体,从而活化胞内的JAK??STAT信号途径,启动核内许多基因的转录。其重要作用还在于使巨噬细胞产生毒性成分如活性氧和氮中间体杀灭胞内细菌,并通过诱导许多宿主抗病毒蛋白如2??,5????寡腺苷酸合成酶(OAS)、dsRNA依赖的蛋白激酶PKR、鸟苷酸结合蛋白、腺苷脱氨酶。同时还有调节T细胞增殖与分化、介导白细胞运输、强化抗原呈递等作用。IFN????的结构在脊椎动物间高度保守,共有一个签名基序,同时在C末端也有一个对其生物学活性至关重要的核定位序列。PHA刺激以及肾、脾注射PolyI:C均可诱导头肾表达IFN????。重组的rIFN????能显著诱导IFN????诱导基因蛋白10(??IP??10,CXC趋化因子)、MHCII??、STAT1,并可强化巨噬细胞的呼吸爆发。缺失核定位序列的重组蛋白不能诱导??IP??10,同时,IFN????诱导表达的??IP??10可被蛋白激酶C抑制剂星状孢子素完全阻断,而U0126(ERK的特异性抑制剂)则起部分抑制作用,因此证明这是鱼类IFN????的同源基因,并说明在低等脊椎动物中也有保守的Th1应答[43]。
鱼类体液免疫应答已积累了丰富的资料,虽然其Th2诱导细胞的类型与作用机制并未阐明。IL??4是主要由Th2细胞分泌的细胞因子,其主要作用在于介导B细胞和Th2T细胞的分化与增殖。近期已首次克隆出鱼类(河豚)IL??4样基因,虽然表达谱式与高等动物不同,但经丝分裂原诱导后IL??4样基因在免疫器官表达的显著提升提示该基因参与的免疫调节作用[51]。鱼类抗体具有与哺乳类相同调理、中和与补体活化作用,但是不同鱼类的体液免疫应答过程存在差异。与其它鱼类不同,大西洋鳕鱼免疫后抗体不发生变化,抗体生成细胞也不增加。研究发现,鳕鱼中性粒细胞的数量异常之多,在PBL中占84%(虹鳟22??36%),头肾、脾脏分别为48%、18%,这也在某种程度上反映出鱼类体液免疫应答的特点。
鱼类同种型抗体主要为IgM,除此以外还有IgD(鳕鱼、鲑鱼、牙鲆)、IgZ(斑马鱼)、IgT(鲑鱼,IgM??IgZ的嵌合体)以及新发现的IgH。IgH与已知的哺乳类及其它脊椎动物的Ig基因结构有很大差异,有分泌与膜结合形式,也是抗体的主要组成。在脾脏、鳃和肠杯状上皮的表达量很高,此类上皮细胞能连续不断的分泌粘液层保护机体不受感染,而此类抗体在粘膜表面的高表达提示其具有GALT相类似的功能[53]。
特异性细胞毒性细胞(CTL)及其应答也是鱼类具备的获得性免疫应答功能。斑点叉尾鮰混合淋巴细胞中建立了多种细胞毒性细胞系,包括CTL、NK样细胞系。其中的两种同种异型抗原依赖型的CTL(TCR????+),[52]
硬骨鱼免疫系统的组成与免疫应答机制研究进展70_免疫系统的组成
同种异型特异性,另一种(II)则有广泛的特异性并能杀死多种靶细胞。前者能够被蛋白酶抑制剂或EDTA抑制,说明可能同样利用Ca2+依赖的穿孔素、粒酶介导的裂解途径。而后者则只被蛋白酶抑制剂部分抑制,说明还有其他途径的存在,可能包括FasL/Fas、TNF/TNF??R[21],杀伤靶细胞的机制可能与哺乳类相同。
鲫鱼的CTL应答表现在培养效应细胞克隆再次接触相同的供者细胞株后,在增殖同时还产生相应的杀伤活性[20]。虹鳟鱼在同种异体免疫应答中的效应细胞是阴性选择富集的淋巴细胞,而其它所有磁化富集的组分(B细胞、单核细胞、粒细胞、血栓细胞)均无杀灭能力。进一步的RT??PCR结果表明,sIgM??淋巴细胞是PBL中唯一的TCR、CD8表达细胞,而且,经同源同种异体细胞体外再次诱导,此类细胞CD8的表达会再次提升,提示为自体细胞反应性细胞毒性T细胞[54]。
通过注射表达不同MHCI等位基因的红细胞,已发现虹鳟鱼MHCI连锁群是体内移植排斥的决定因素。移植物抗宿主反应(GVHR)在鱼类(鲫鱼、鲑鱼)中也存在,反应与环境温度相关,这与鱼类的变温属性和免疫系统的特性是一致的。大西洋虹鳟已分离出MHCI途径所包含的I类抗原多肽加工呈递的蛋白,其中的PSMB8、9、10(MECL??1)构成了多催化性免疫蛋白水解酶复合体,将抗原降解为8??10aa的多肽通过抗原呈递转运相关蛋白(ABCB2、3)转运至ER并与I类分子(含I类重链与??2微球蛋白,??2m)装配,最后通过高尔基体转运至细胞表面供CD8T细胞识别。目前已经在鱼类中克隆到CD8??、??(鲫鱼、鲑鱼、鲈鱼)、IL??
2、IL??6同源基因(河豚)以及蛋白酶体基因[25]。此外,通过鲷鱼相关分子模拟CD8??MHCI??TCR复合体的结构与功能结果说明,CD8????与MHCI的结合可提高V??与MHCI的亲和力并强化MHCI/V??复合体的稳定性。CD8、TCR与MHCI的结合部位在空间上是不同的,但对MHC??3结构域的空间取向要求是相似的,这种结构与人类一致
途径。[55][40]。结合功能与分子克隆研究结果,可以明确鱼类具有与哺乳类相似的CTL免疫
4??结语与展望
与哺乳类等高等生物的免疫系统相比,鱼类在免疫功能上保守,在形态上存在较大的差异。为了更好的适应环境,鱼类演化出自身的免疫特性,概括如下:1)鱼类具有完全的固有与获得性免疫应答体系,但其固有免疫作用可能更为重要,主要表现在胚系基因编码受体的种类与抗原识别范围更广,应答启动条件相对较低而免疫效应则相对强化;2)鱼类获得性免疫组成与结构较为简单,应答效率较低,获得性免疫应答的发生相对滞后。这种免疫系统的组成与功能特性与其自身所处的环境和变温性质密不可分。
当前的免疫学体系是建立在哺乳类研究的基础之上的,鱼类免疫学研究基础还十分薄弱。鱼类高度多样化的种类组成、特定的进化地位及其免疫系统的特性,为人类了解自身免疫系统的演化规律以及补充、丰富免疫效应分子、受体等组成与生物学活性有重要意义。鱼类免疫系统所展现出与高等动物不同的独特性质(如补体系统的多样性、MH连锁群结构、????淋巴细胞、NITR受体等),不仅扩充了免疫学的研究范围,其深入研究也必将为更深层次揭示人类的免疫系统提供科学依据。同时,鱼类免疫学研究对于养殖病害的免疫防治也具有指导意义,因此,人们对鱼类免疫系统组成与功能研究的重视程度正在不断加大。
随着分子生物学、基因组学的飞速发展,斑马鱼、河豚的基因组测序相继完成,同时至少还有4种鱼类的基因组测序正在进行当中,这为免疫相关基因的比较基因组学、基因的结构功能鉴定、基因表达的调控等研究奠定了良好的分子基础。在此基础上,诸如基因芯片等高通量基因表达分析技术的应用,对鱼类免疫系统的网络调节研究产生了极大的推动作用。近十年鱼类免疫学研究的主要成果大都源自分子克隆技术,但基因克隆技术对于从根本上认识鱼类免疫系统还远远不够,各种淋巴/效应细胞系、单克隆抗体(特别是能够明确鉴定对应与哺乳类CD系统免疫细胞的抗体)等细胞、蛋白质水平适当工具的开发应用,成为鱼类免疫研究的当务之急。
参考文献(References):
[1]??PRESSC,EVENSEN??.Themorphologyoftheimmunesysteminteleostfishes[J].FishShellfishImmunol.,1999,9:309??318
[2]??BOWDENTJ,COOKP,ROMBOUT.Developmentandfunctionofthethymusinteleosts[J].Fish&ShellfishImmunol.,2005,19:413??
427.
[3]??HUTTENHUISAHBT,HUISINGAMO,VANDERMEULENT,etal.RahexpressionidentifiesBandTcelllymphopoietictissues
duringthedevelopmentofcommoncarp(Cyprinuscarpio)[J].Dev.Comp.Immunol.,2005,29:1033??1047.
[4]??ZAPATAA,DIEZB,CEJALVOT,etal.Ontogenyoftheimmunesystemoffish[J].Fish&ShellfishImmunol.,2006,20:126??136.
[5]??PRESSCM,DANNEVIGBH,LANDSVERKT.Immuneandenzyme??histochemicalphenotypesoflymphoidandnonlymphoidcells
withinthespleenandheadkidneyofAtlanticsalmon(SalmosalarL.)[J].Fish&ShellfishImmunol.,1994,4:79??93.
[6]??GROVES,JOHANSENR,REITANLJ,etal.Immune??andenzymehistochemicalcharacterisationofleukocytepopulationswithin
lymphoidandmucosaltissueslfAtlantichalibut(Hippoglossushippoglossus)[J].Fish&ShellfishImmunol.,2006,20:693??708.
[7]??ZWOLLOP,COLES,BROMAGEE,etal.Bcellheterogeneityintheteleostkidney:evidenceforamaturationgradientfromanteriorto
prsteriorkidney[J].J.Immunol.,2005,174:6608??6616.
[8]??FRANCISCH,ELLISAE.Productionofalymphokine(macrophageactivatingfactor)bysalmon(Salmosalar)leucocytesstimulated
withoutermembraneproteinantigensofAeromonassalmonicida[J].Fish&ShellfishImmunol.,1994,4:489??497.
[9]??NORUMM,B??GWALDJ,DALMORA.Isolationandcharacterisationlfspottedwolfish(AnarhichasminorOlafsen)macrophages[J].
Fish&ShellfishImmunol.,2005,18:381??391.
[10]??ROMANON,PICCHIETTIS,TAVERNE??THIELEJJ,etal.Distributionofmacrophagesduingfishdevelopment:animmunohisto??
chemicalstudyincarp(Cyprinuscarpio,L.)[J].Anat.Embryol.,1998,198:31??41.
[11]??BELOSEVICM,HANINGTONPC.BARREDADR.Developmontofgoldfishmacrophageinvitro[J].Fish&ShellfishImmunol.,
2006,20:152??171.
[12]??GOETZFW,ILIEVDB,MCCAULEYLAR,etal.Analysisofgenesisolatedfromlipopolysaccharide??stimulatedrainbowtrout(On??
corhynchusmykiss)macrophages[J].Mol.Immunol.,2004,41:1199??1210.
[13]??MACKENZIES,ILIEVD,LIARTEC,etal.TranscriptionalanalysisofLPS??stimulatedactivationoftrout(Oncorhynchusmykiss)
monocyte/macrophagecellsinprimaryculturetreatedwithcortisol[J].Mol.Immunol.,2006,43:1340??1348.
[14]??NAKAMURAO,KUDOR,AOKIH,etal.IgMsecretionandabsorptioninthematerno??fetalinterfaceofaviviparousteleost,Neodi??
tremaransonneti(Perciformes;Embiotocidae)[J].Dev.Comp.Immunol.,2006,30:493??502.
[15]??HIKIMAJ,LENNARDML,WILSONMR,etal.Regulationoftheimmunoglobulinheavychainlocusexpressionatthephylogenetic
levelofabonyfish:Transcriptionfactorinteractionwithtwovariantoctamermotifs[J].Gene,2006,377:119??129.
[16]??TAKANOT,KONDOH,HIRONOI,etal.MolecularcloningandcharacterizationofToll??likereceptor9inJapaneseflounder,
Paralichthysolivaceus[J].Mol.Immunol.,2007,44:1845??1853.
[17]??ROACHJC,GLUSMANG,ROWENL,etal.TheevolutionofvertebrateToll??likereceptors[J].Proc.Natl.Acad.Sci.,2005,102:
9577??9582.
[18]??LIJ,BARREDADR,ZHANGYA,etal.Blymphocytesfromearlyvertebrateshavepotentphagocyticandmicrobicidalabilities[J].
Nat.Immunol.,2006,7:1116??1124.
[19]??PARTULAS.SurfacemarkersoffishT??cells[J].Fish&ShellfishImmunol.,1999,9:241??257.
[20]??SOMAMOTOT,SATOA,NAKANISHIT,etal.Specificcytotoxicactivitygeneratedbymixedleucocytecultureinginbunacrucian
carp[J].Fish&ShellfishImmunol.,2004,17:187??191.
[21]??YODERJ.Investigatingthemorphology,functionandgeneticsofcytotoxiccellsinbonyfish[J].Comp.Biochem.Physiol.C,2004,
138:271??280.
[22]??KUROBET,YASUIKEM,KIMURAT,etal.Expressionprofilingofimmune??relatedgenesfromJapaneseflounderParalichthysoli??
vaceuskidneycellsusingcDNAmicroarrays[J].Dev.Comp.Immunol.,2005,29:515??523.
[23]??LANGENAUDM,ZONLI.TheZebrafish:anewmodelofT??cellandthymicdevelopment[J].Nat.Rev.Immunol.,2005,5:307??
317.
[24]??TAYLORAIS,ADAMAB,VEVERKOV??M,etal.T??cellantigenreceptorgenesinturbot(ScophthalmusmaximusL.)[J].Fish&
ShellfishImmunol.,2005,18:445??448.
[25]??BUONOCOREF,RANDELLIE,BIRDS,etal.TheCD8??fromseabass(DicentrarchuslabraxL.):Cloning,expressionand3D]S
[26]??CUESTAA,ESTEBANM??,MESEGYERJ.Cloning,distributionandup??regulationoftheteleostfishMHCclassIIalphasuggestsa
roleforgranulocytesasantigen??presentingcells[J].Mol.Immunol.,2006,43:1275??1285.
[27]??CHENSL,WANGZJ,XUMY,etal.Molecularidentificationandexpressionanalysisofnaturalresistanceassociatedmacrophage
protein(Nramp)cDNAfromJapaneseflounder(Paralichthysolivaceus)[J].Fish&ShellfishImmunol.,2006,20:365??373.
[28]??BAOPRAWERTKULP,XUP,PEATMANE,etal.DivergentToll??likereceptorsincatfish(Ictaluruspunctatus):TLR5S,TLR20,
TLR21[J].Fish&ShellfishImmunol.,2007,23:1218??1230.
[29]??YAZAWAR,KONDOH,HIRONOI,etal.CloningandcharacterizationoftheIkBagenefromJapaneseflounder,Paralichthysoliva??
ceus[J].Fish&ShellfishImmunol.,2007,23:808??814.
[30]??CHENJSC,WANGTY,TZENGTD,etal.EvidenceforpositiveselectionintheTLR9geneofteleosts[J].Fish&ShellfishImmu??
nol.,2008,24:234??242.
[31]??MAGNAD??TTIRB.Innateimmunityoffish(overview)[J].Fish&ShellfishImmunol.,2006,20:137??151.
[32]??BOSHRAH,LIJ,SUNYERJO.Recentadvancesonthecomplementsystemofteleostfish[J].Fish&ShellfishImmunol.,2006,20:
239??262.
[33]??VALLEJOAN,MILLERNW,JBRGENSENT,etal.PhylogenyofimmuneRecognition:AntigenProcessing/PresentationinChan??
nelCatfishImmuneResponsestoHemocyanins[J].Cell.Immunol.,1990,130:364??377.
[34]??VALLEJOAN,MILLERNW,CLEMLW.Phylogenyofimmunerecognition:roleofalloantigensinantigenpresentationinchannel
catfishimmuneresponses[J].Immunol.,1991,74:165??168.
[35]??LOVYJ,WRIGHTGM,SPEAREDJ.Morphologicalpresentationofadendritic??likecellwithinthegillsofchinooksalmoninfected
withLomasalmonae[J].Develop.Comp.Immunol.,2006,30:259??263.
[36]??LIUG,ZHENGW,CHENX.MolecularcloningofproteasomeactivatorPA28????subunitoflargeyellowcroaker(Pseudoscianacrocea)
anditscoordinatedup??regulationwithMHCclassI????chainand??2??microglobulininpolyI:C??treatedfish[J].Mol.Immunol.,2007,44:1190??1197.
[37]??VALLEJOAN,MILLERNW,CLEMLW.Cellularpathway(s)ofantigenprocessinginfishAPC:effectofvaryinginvitrotempera??
turesonantigencatabolism[J].Dev.Comp.Immunol.,1992,16:367??381.
[38]??WYNNEJW,COOKMT,NOWAKBF,etal.Majorhistocompatibilitypolymorphismassociatedwithresistancetowardsamoebicgill
diseaseinAtlanticsalmon(SalmosalarL.)[J].Fish&ShellfishImmunol.,2007,22:707??717.
[39]??TSUKAMOTOK,HAYASHIS,MATSUOMY,etal.UnprecedentedintraspecificdiversityoftheMHCclassIregionofateleost
medaka,Oryziaslatipes[J].Immunogenetics.,2005,57:420??431.
[40]??J??RGENSENSM,HETLANDDL,PRESSCM,etal.Effectofearlyinfectioussalmonanaemiavirus(ISAV)infectiononexpres??
sionofMHCpathwaygenesandtypeIandIIinterferoninAtlanticsalmon(SalmosalarL.)tissues[J].Fish&ShellfishImmunol.,2007,23:576??588.
[41]??HIRONOI,NAMBH,KUROBET,etal.Molecularcloning,characterization,andexpressionofTNFcDNAandgenefromJapanese
flounderParalychthysolivaceus[J].J.Immunol.,2000,165:4423??4427.
[42]??NAMBH,BYONJY,KIMYO,etal.Molecularcloningandcharacterisationoftheflounder(Paralichthysolivaceus)interleukin??6
gene[J].Fish&ShellfishImmunol.,2007,23:231??236.
[43]??ZOUJ,CARRINGTONA,COLLETB,etal.IdentificationandbioactivitiesofIFN????inrainbowtroutOncorhynchusmykiss:thefirst
Th1??TypeCytokinecharacterizedfunctionallyinfish[J].J.Immunol.,2005,175:2484??2494.
[44]??CAIPANGCMA,HIRONOI,AOKIT.InvitroinhibitionoffishrhabdovirusesbyJapaneseflounder,ParalichthysolivaceusMx[J].
Virol.,2003,317:373??382.
[45]??YASUIKEM,KONDOH,HIRONOI,etal.DifferenceinJapaneseflounder,Paralichthysolivaceusgeneexpressionprofilefollowing
hiramerhabdovirus(HIRRV)GandNproteinDNAvaccination[J].Fish&ShellfishImmunol.,2007,23:531??541.
[46]??KIMHJ,YASUIKEM,KONDOH,etal.MolecularcharacterizationandgeneexpressionofaCXCchemokinegenefromJapanese
flounderParalichthysolivaceus[J].Fish&ShellfishImmunol.,2007,23:1275??1284.
[47]??SANTOSMD,YASUIKEM,KONDOH,etal.Anoveltype??1cytokinereceptorfromfishinvolvedintheJanuskinase/Signaltrans??
ducersandactivatorsoftranscription(Jak/STAT)signalpathway[J].MolImmunol.,2007,44:3355??3363.
[48]??LUTFALLAG,CROLLIUSHR,STANGE??THOMANNN,etal.Comparativegenomicanalysisrevealsindependentexpansionofa
lineage??specificgenefamilyinvertebrates:TheclassIIcytokinereceptorsandtheirligandsinmammalsandfish[J].BMCGenomics,2003,4:29.
[49]??ROBERTSENB.Theinterferonsystemofteleostfish[J].Fish&ShellfishImmunol.,2006,20:172??191.
[??p:ing,
2期王卫卫,等:硬骨鱼免疫系统的组成与免疫应答机制研究进展
tionandgeneexpressionduringviralandbacterialinfection[J].Fish&ShellfishImmunol.,2008,25:570??580.??265
[51]??LIJH,SHAOJZ,XIANGLX,etal.Cloning,characterizationandexpressionanalysisofpufferfishinterleukin??4cDNA:Thefirst
evidenceofTh2??typecytokineinfish[J].Mol.Immunol.,2007,44:2078??2086.
[52]??R??NNEDETHA,WERGELANDHI,PETTERSENEF.NeutrophilsandB??cellsinAtlanticcod(GadusmorhuaL.)[J].Fish&
ShellfishImmunol.,2007,23:493??503.
[53]??SAVANR,AMANA,SAOTK,etal.Discoveryofanewclassofimmunoglobulinheavychainfromfugu[J].Eur.J.Immunol.,
2005,35:3320??3331.
[54]??FISCHERU,UTKEK.SOMAMOTOT,etal.Cytotoxicactivitiesoffishleucocytes[J].Fish&ShellfishImmunol.,2006,20:209??
226.
[55]??COSTANTINIS,BUONOCOREF,FACCHIANOAM.Molecularmodellingofco??receptorCD8aaanditscomplexwithMHCclassI
andT??cellreceptorinseabream(Sparusaurata)[J].Fish&ShellfishImmunol.,2008,25:782??790.
ProgressinResearchforComponentsoftheImmuneSystemand
MechanismoftheImmuneResponseinTeleost
WANGWei??wei,WUSu??qi,SUNXiu??qin,FANTing??jun
2.FirstInstituteofOceanography,SOA,Qingdao266061,China)1,2221(1.CollegeofMarineLifeSciences,OceanUniversityofChina,Qingdao266001,China;
Abstract:Teleostisofthelowestvertebrateswhichpossessestheinnateandadaptiveimmunesystem.Re??centprogressissummarizedinstudiesoftheorganicstructureandcellcompositionofthefishimmunesys??tem,thecharacteristicsandfunctionsofthemajorimmunocytes,theantigen??inducedresponsesofboththeinnateandtheadaptiveimmunities.FromthecomparisonwiththoseoftheHigher??levelvertebratessuchasmammals,theteleostimmunesystemcanbecharacterizedasfollows.1)Teleostkeepsimmunologicallyconservativeinitsimmunegenes,theimmunacytes,andtheirfunctions,andthereexistthedistinctdiffer??encesfromeachotherinthemorphologyandstructureofimmuneorgansandtissues.2)Teleostpossessesaperfectinnateandadaptiveimmuneresponsesystem,anditsinnateimmunitymayplayamoreimportantroleasthegerm??lineencodedreceptorsrecognizeawiderrangeofantigenswithalowerthresholdofinitia??tionandastrongereffectforimmuneresponses.3)Theadaptiveimmunityisofacomparativelysimplercomponentsandorganizationhierarchy,itsimmuneresponseinitiationfurtherlagsbehind,andthere??sponseeffectisweaker.Thecharacteristicsofteleostimmunecomponentsandthefunctionsreflectthena??tureofitspoikilothermyandtheadaptationtoenvironments.
Keywords:fish;immunesystem;review
Received:March27,2009
本文标题:免疫系统的组成-是什么组成了免疫系统?61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1