一 : Fe2+与H2O2反应的离子方程式

Fe2+与H2O2反应的离子方程式
与足量的H2O2溶液反应的离子方程式 6Fe2+ + 3H2O2 === 2Fe(OH)3↓+ 4Fe3+ 这是在碱性条件下 H2O2 + 2Fe2+ +2H+ = 2Fe3+ + 2H2O 这
二 : 高一化学在一定的条件下,RO3^n-和I-发生反应的离子方程式如
高一化学
在一定的条件下,RO3^n-和I-发生反应的离子方程式如下:RO3^n-+6I-+6H+=R-+3I2+3H2O,问(1)RO3^n-中R元素的化合价是多少
(2)R元素的最外层电子数是多少
在一定的条件下,RO3^n-和I-发生反应的离子方程式如下:RO3^n-+6I-+6H+=R-+3I2+3H2O,问(1)RO3^n-中R元素的化合价是多少
(2)R元素的原子最外层电子数是多少
==由RO3^n-+6I-+6H+=R-+3I2+3H2O,知,按氧化还原反应的是电子相等,RO3^n-中R元素的化合价是+5(I-共得到6mol电子)
2、由于I-的还原性比较强,R元素被还原为-1价,可以看作最低价态,所以,R元素的原子最外层电子数是多少 ==7===
三 : 高考常见离子反应方程式总结
百度搜索:61阅读,发现并分享更多精彩生活。

1.钠与水的反应2Na+ 2H2O = 2Na+ + 2OH- + H2↑
2.碳酸钠溶液与盐酸的反应CO32- + 2H+= H2O + CO2↑
3.碳酸氢钠溶液与氢氧化钠溶液的反应HCO3- + OH-= H2O + CO32-
4.二氧化碳通入碳酸钠溶液中CO32- + H2O+ CO2 = 2HCO3-
5.碳酸氢钠溶液与盐酸溶液的反应HCO3- + H+ =H2O + CO2↑
6.Na2O2分别与水、二氧化碳反应
2Na2O2 + 2H2O = 4NaOH +O2↑ 2Na2O2 + 2CO2 =2Na2CO3 + O2
7.少量CO2与NaOH反应CO2+ 2OH— = CO32— + H2O
8.过量CO2与NaOH反应CO2+ OH— = HCO3—
9.碳酸钙与盐酸的反应CaCO3 + 2H+ = Ca2++ CO2↑+H2O
10.碳酸钙与醋酸的反应CaCO3 + 2CH3COOH =Ca2+ + 2CH3COO-+CO2↑+H2O
11.碳酸氢钙与过量NaOH溶液应Ca2+ + 2HCO3-+ 2OH- = CaCO3↓+ CO32- + 2H2O
12.碳酸氢钙与少量NaOH溶液反应Ca2+ + HCO3-+ OH- = CaCO3↓+ H2O
13.碳酸氢铵与足量NaOH溶液共热NH4+ +HCO3-+2OH- NH3↑+ CO32- + 2H2O
14.实验室制氯气4H++2Cl-+MnO2 Mn2+ + Cl2↑+ 2H2O
15.氯气与烧碱溶液的反应Cl2 + 2OH- = Cl-+ ClO- + H2O
16.氯气与水反应Cl2 + H2O =H+ + Cl- + HClO
17.NaBr溶液与Cl2反应2Br—+ Cl2 = 2Cl— + Br2
18.电解饱和食盐水2Cl—+2H2O H2↑+Cl2↑+2OH—
19.SO2与氯水的反应2H2O+ Cl2 + SO2 = 4H+ + SO42-+ 2Cl-
20.SO32—的检验(与稀硫酸反应)2H++ SO32- =2H2O + SO2↑
21.Cu与浓硫酸的反应Cu +2H2SO4(浓)CuSO4 +SO2↑+2H2O
22.硫酸与氢氧化钡溶液的反应2H++SO42-+Ba2++2OH--= BaSO4↓+ 2H2O
23.烧碱与石英的反应SiO2 + 2OH-= SiO32- + H2O
24.水玻璃溶液与稀硫酸反应SiO32- + H2O+2H+ = H4SiO4↓
25.二氧化氮与水反应3NO2 + H2O = 2H++2NO3- + NO
26.铵根离子的检验NH4+ + OH—= NH3↑ + H2O
27.氨水吸收少量二氧化硫
2NH3·H2O + SO2 = 2NH4++ SO32- + H2O或2NH3 + H2O +SO2 = 2NH4+ + SO32-
28.氨水吸收过量二氧化硫
NH3·H2O + SO2 = NH4++ HSO3- 或NH3 + H2O + SO2= NH4+ + HSO3-
29.铜与浓硝酸的反应Cu + 4H+ + 2NO3-= Cu2+ + 2NO2↑+ 2H2O
30.铜与稀硝酸的反应3Cu + 8H+ +2NO3-= 3Cu2+ +2NO↑+ 4H2O
31.醋酸钠水解CH3COO-+ H2O CH3COOH + OH-
32.氯化铵水解NH4+ + H2O NH3.H2O+ H+
33.碳酸钠水解CO32- + H2O HCO3- +OH-
34.明矾水解Al3+ + 3H2O Al(OH)3 +3H+
35.铁与盐酸反应Fe + 2H+ =Fe2++ H2↑
36.铝与盐酸反应2Al + 6H+ = 2Al3++ 3H2↑
37. 铝与氢氧化钠溶液反应2Al + 2OH- + 2H2O= 2AlO2- + 3H2↑
38.镁与二氧化碳反应2Mg + CO2 2MgO + C
39.铝热反应2Al + Fe2O3 2Fe +Al2O3
40.氧化铝与盐酸的反应Al2O3 + 6H+= 2Al3+ + 3H2O
41.氧化铝与烧碱的反应Al2O3 + 2OH- =2AlO2- + H2O
42.氢氧化铝与盐酸的反应Al(OH)3 + 3H+ = Al3++ 3H2O
43.氢氧化铝与烧碱的反应Al(OH)3 + OH- =AlO2-+ 2H2O
44.氯化铝溶液与过量氨水反应Al3+ + 3NH3·H2O= Al(OH)3↓+ 3NH4+
45.氯化铝溶液与偏铝酸钠溶液反应Al3+ +3AlO2-+ 6H2O = 4Al(OH)3↓
46.偏铝酸钠溶液中滴加少量盐酸AlO2- + H+ +H2O = Al(OH)3↓
47.偏铝酸钠溶液中通入过量二氧化碳AlO2- + CO2+ 2H2O = Al(OH)3↓+ HCO3-
48.苯酚钠中通入二氧化碳O- +CO2+ H2O OH + HCO3-
49.氯化铁溶液与铁反应2Fe3+ + Fe = 3Fe2+
50.氯化铁溶液与铜反应2Fe3+ + Cu =2Fe2++ Cu2+
51.氯化铁溶液与氢硫酸反应2Fe3+ + H2S = 2Fe2++ S↓+ 2H+
52.氯化亚铁溶液与氯水反应2Fe2+ + Cl2 = 2Fe3++ 2Cl-
53.溴化亚铁溶液与过量氯水反应2Fe2+ + 4Br- + 3Cl2= 2Fe3+ + 6Cl- + 2Br2
54.溴化亚铁溶液与少量氯水反应2Fe2+ + Cl2 = 2Fe3++ 2Cl-
55.硫酸铝溶液与小苏打溶液反应Al3+ + 3HCO3-= Al(OH)3↓+ 3CO2↑
56.硫酸氢钠溶液与氢氧化钡溶液混合呈中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
57.硫酸氢钠溶液与氢氧化钡溶液反应后,硫酸根离子完全沉淀
H++SO42-+Ba2++OH-=BaSO4↓+H2O
58.明矾溶液与过量氢氧化钡溶液反应
Al3++ 2SO42- + 2Ba2+ + 4OH- =2BaSO4↓+AlO2- +2H2O
59.明矾与氢氧化钡溶液混合呈中性
2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 3BaSO4↓+ 2Al(OH)3↓
60.碳酸氢镁与过量Ca(OH)2溶液反应
Mg2+ + 2HCO3- + 2Ca2++ 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
61.氢钙与过量Ca(OH)2溶液反应
Ca2+ + HCO3- + OH-= CaCO3↓+ H2O
62.等浓度氢氧化钡与碳酸氢铵反应
Ba2+ + 2OH- + NH4++ HCO3- = BaCO3↓+ 2H2O + NH3
喜欢本篇文章,请随手点赞,欢迎分享到朋友圈
文章转自网络,因无法查询出处无法标注来源,如有侵权,请联系管理员删除。(www.61k.com)
联系我们
关注高化学公众号请扫描此二维码
?高中化学QQ:1656784903

四 : 离子反应方程式书写
61阅读/ www.61k.net
离子反应方程式书写
复习回顾 什么叫强电解质,什么叫弱电解质 什么叫强电解质, 什么叫离子反应 什么叫离子方程式 离子方程式的书写步骤
写出下列电解质电离方程式
氢氧化钡 硫酸钡 CH3COOH NH3H2O HClO
书写离子方程式的步骤: 书写离子方程式的步骤: (1)正确书写化学方程式。 )正确书写化学方程式。 (2)把可溶性强电解质拆写成离子符号, )把可溶性强电解质拆写成离子符号, 弱电解质、难溶物、气体、 弱电解质、难溶物、气体、单质和氧化物 仍写为化学式 化学式。 仍写为化学式。 (3)删去方程式两边相同的离子。 )删去方程式两边相同的离子。 (4)检查离子方程式两边的原子数和电荷数 ) 是否守恒。 是否守恒。
书写下列离子反应方程式
碳酸钙与盐酸 氢氧化钡和稀硫酸 氯化铵与氢氧化钠溶液加热 氯气和水反应 碳酸氢钠与盐酸 氢氧化 和稀硫酸 氢氧化 与 酸 硫酸 溶液与 反应
强 酸 、 强 碱 和 可 溶 性 盐
。
可 溶 性 强 电 解 质 包 括 :
表 示 , 其 余 均 用 化 学 式 表 示 。
号 只 把
书 可 溶 性 强 电 解 质 写 要 领 是 :
用 离 子 符
离子方程式的意义
(1)表示离子反应的本质 ) (2)表示同一类型的反应 )
H+ + OH- = H2O Ca2+ +CO2-3=CaCO3↓
判断下列离子方程式是否正确
1.铁与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑ 铁与稀硫酸反应: 铁与稀硫酸反应 2. 氯气与澄清石灰水:2Cl+ 4OH- = 2Cl- + 2ClO-+2H2O 氯气与澄清石灰水: 3.钠与水的反应:Na + 2H2O = 2 Na+ + 2OH- + H2↑ 钠与水的反应: 钠与水的反应 4.硫酸铜溶液与氢氧化钡溶液:Ba2+ + SO42- = BaSO4↓ 硫酸铜溶液与氢氧化钡溶液: 硫酸铜溶液与氢氧化钡溶液 5.碳酸钙与稀盐酸反应:CO32- + 2H+ = H2O +CO2 碳酸钙与稀盐酸反应: 碳酸钙与稀盐酸反应 6.碳酸钠与醋酸反应:CO32- + 2H+= H2O + CO2↑ 碳酸钠与醋酸反应: 碳酸钠与醋酸反应
判断离子方程式正确与否的方法: 判断离子方程式正确与否的方法: (1)检查反应能否发生。 )检查反应能否发生。 (2)检查反应物、生成物是否正确。 )检查反应物、生成物是否正确。 (3)检查各物质拆分是否正确。 )检查各物质拆分是否正确。 (4)检查是否符合守恒关系(如:原子守恒和电荷 )检查是否符合守恒关系( 守恒等) 守恒等)。 (5)检查是否符合原化学方程式。 )检查是否符合原化学方程式。
离子反应发生的条件和本质 1.条件: 条件: 条件 难溶物生成(CaCO3,Cu(OH) 2等) 气体生成(CO2,H2等)
难电离物质生成(H2O,HClO, NH3H2O
等)
2.本质:反应物某些离子减少 本质: 本质
判断下列各组离子在溶液中能
否共存
A. B. C. D. E. F. G. Ca2+,Na+, SO42- ,Cl-
+,H+,SO 2-,OHK 4 +,H+,Cl-,CO 2Na 3 NH4+,K+,Cl-, OHNa+,Ag+,Cl-,NO3H+,Na+,HCO3-,NO3Cu2+,K+,Cl-,OH-
五 : 离子反应与离子方程式
离子反应
一、强电解质和弱电解质
电解质:在水溶液里或熔融状态下能够导电的化合物。如, 酸、碱、盐等 非电解质:在水溶液里和熔融状态下能够导电的化合物。
强电解质:在水溶液里能全部电离成离子的电解质。
强电解质:在水溶液里只有部分电离成离子的电解质。
二、离子反应和离子方程式:
离子反应:有离子参加的反应叫离子反应。
思考:
在Na2SO4+BaCl2的反应中,BaSO4是怎样生成?Na+ 、Cl-在反应前后有无变化? Na2SO4+BaCl2在溶液中是以以下四种离子存在:Na+、 SO42- 、Ba2+、Cl- ,其中SO42-和Ba2+ 结合生成BaSO4 。 即:
2Na++ SO42- +Ba2++2Cl- =BaSO4?+2Na++ 2Cl-
由此可见反应前后,Na+、Cl-没有变化,象数学方程式一样将两边相同的部分去掉,即得: SO42- +Ba2+=BaSO4?
结论:
(1)两种电解质溶液间的反应并不是两种物质分子间的反应,而是首先电离成离子,然后离子间发生反应。即电解质溶液间的反应实质是离子间的反应。
(2)离子之间的反应,并非所有的离子参加,如上述反应中,就只有Ba2+、SO42-参加。 离子方程式:用实际参加反应的离子符号,来表示离子反应的式子叫离子方程式。离子方程式表示一类反应,如:
SO42- +Ba2+=BaSO4
即表示可溶性钡盐与可溶性硫酸盐或硫酸之间的反应。
三、怎样书写离子方程式:
1、写出正确的化学方程式;
2、把能电离的物质写成离子形式[强酸、强碱、易溶盐完全电离];难溶的物质或难电离的物质以分子式表示。难溶的物质或难电离的物质有:
非电解质:如CH3CH2OH
弱电解质:
弱酸——H2SO3、H3PO4、CH3COOH、H2CO3、HClO、H2S
弱碱——NH3·H2O
弱酸酸式酸根:HCO3-、HSO3-、H2PO4- 氧化物:如Na2O、MgO
难溶物:Cu(OH)2、BaSO4
气体:NO、H2S 、NH3、Cl2
3、删去不参加反应的离子(即相同的离子)
4、检查两边各元素的原子个数和电荷数是否相等。
练习:1、 写出下列反应的离子方程式:
CaCl2+AgNO3?
H2SO4+KOH?
CaCO3+HCl?
H2SO4+NaOH?
H2SO4+CuO?
HCl+AgNO3?
Na2SO3+HCl?
CaSO3+HCl?
FeS+HCl?
CuSO4+H2S?
CuSO4+KOH?
NaOH+HCl?
NH4Cl+ NaOH?
Zn+ H2SO4?
BaCO3+H2SO4?
2、判断下列反应是否正确
K++NO3- = KNO3
Fe3++3OH- = Fe(OH)3↓
Al+2H+=Al3++H2↑
Fe+Cu2+=Fe+2+Cu
四、离子方程式书写的注意事项
(1)固体间的反应、非水溶剂中的反应和特浓溶液参加的反应均不写离子反应方程式(如氨的
实验室制取、铜与浓硫酸反应、石灰乳中通入CO2等无离子方程式)(2)微溶物质的处理
(3)一些特殊的反应(不同的量会生成不同的产物)要注意反应物的配比,少量的物质在离子
方程式中的两离子应满足其组成中的系数比。如:向氢氧化钠溶液中加入少量的碳酸氢钙溶液
2OH-+Ca2++2HCO3-=CaCO3↓+CO32-+2H2O碳酸氢钙溶液加入少量的氢氧化钠溶液
OH-+Ca2++HCO3-=CaCO3↓+H2O解题原则:“量少全反应”,如把量少的物质设定为
1mol,再结合参加反应的其它离子判断产物.
五、离子共存
离子共存就是离子间不发生反应。
例1 写出下列反应的离子方程式
(1)NaHCO3溶液和稀H2SO4反应 (2)NaHSO4溶液和Mg(OH)2反应 (3)CO2气体通入过量的NaOH溶液中 (4)向NaOH溶液中通入过量CO2气体
(5) Al(OH)3与稀H2SO4反应
(6) 向碳酸钠溶液种滴加盐酸
(7) 向盐酸中滴加碳酸钠溶液
例2 已知硫酸铅难溶于水,也难溶于硝酸,但可溶于醋酸铵(NH4Ac)溶液形成无色溶液,其化
学方程式为:PbSO4?2NH4Ac???Pb(Ac)2?(NH4)2SO4.当在Pb(Ac)2溶液中通入H2S时,有黑色PbS生成。表示这个反应的有关离子反应方程式正确的是( )
A.Pb(Ac)2?H2S???PbS??2HAc B.PbC.Pb2??H2S???PbS??2H? ?2Ac??H2S???PbS??2HAc 2?D.Pb2??2Ac??2H??S2????PbS??2HAc
【练习】
1.在强酸性且含有Ba2?离子的溶液中,还能大量存在的离子是( )
2???A.AlO?2 B.ClO C.Cl D.SO4
2.下列反应的离子方程式不正确的是( )
?
(A)向烧碱溶液中滴加少量氯化铝溶液: Al3??4OH??AlO2?2H2O
(B)物质的量相等的溴化亚铁跟氯气反应: 2Fe2??2Br??2Cl2?2Fe3??Br2?4Cl? (C)碘化钾溶液与过氧化氢溶液混合 2I+2H2O2+4H=I2+4H2O
??(D)向碳酸钠溶液中滴加过量的稀硫酸: CO23?2H?CO2??H2O
-
+
3.下列离子方程式正确的是( )
A.氯气水反应:Cl2 + H2O 2H +Cl +ClO
+
+
-
-
B.氢氧化钡溶液中加入稀硫酸: Ba2 + SO42BaSO4↓ C.往小苏打溶液中滴加足量氢氧化钙溶液:
2HCO3+Ca2+2OH3↓+CO3 2+2H2O
-
+
-
D.侯德榜制碱的主要反应原理:CO2+NH3+Na+H23↓+NH4
++
4.在强酸性的无色溶液中能大量共存的离子组是( )
A.K、Na、HCO3、NO3 C.K、Na、Cl、Cu
?
?
?
2?
?
?
?
?
B.Na、Mg、Cl、SO4D.Na、Ba、Cl、SO4
?
2?
?
?2??2?
2?
5.下列离子方程式正确的是( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2?2H???CaB.钠与水的反应Na?2H2O???Na?2OH?H2? C.铜片插入硝酸银溶液中Cu?Ag???Cu
?
2?
?
??
2?
?2H2O
?Ag
2?
D.大理石溶于醋酸的反应CaCO3?2CH3COOH???Ca
?2CH3COO??CO2??H2O
6.下列各组离子能大量共存的是( )
A.HCO3、Na、CH3COO、OH C.K、Cl、NO3、CO3
?
?
?
2?
?
?
?
?
B.Ba、Cu、Cl、SO4D.S、SO3、SO4、H
2?
2?
2?
?
2?2??2?
7.下列反应的离子方程式正确的是( )
(A)硫酸亚铁酸性溶液中加入过氧化氢: 2Fe2+ + 2H2O2 + 4H+ = 2Fe3+ + 4H2O (B)氯化铝溶液通入过量氨水: Al3+ + 4OH = AlO2 + 2H2O
-
-
(C)碳酸钙溶于醋酸: CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO + H2O + CO2?
-
(D)次氯酸钙溶液中通入过量二氧化碳: Ca2+ + 2ClO + H2O + CO2 = CaCO3? + 2HClO -
8.巳知某溶液中存在较多的H、SO42、NO3,则该溶液中还可能大量存在的离子组是( ) +——
A.Al3+、CH3C00、Cl B.Mg2+、Ba2+、Br——
——— C.Mg2+、Cl、I D.Na+、NH4+、Cl —
9.向稀NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出所发生反应的离子方程式
在以上溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
10.用离子方程式表示下列物质间的反应:
(1)钠与稀醋酸反应
(2) 氨水与盐酸反应
(3) 饱和石灰水与硝酸反应;
(4) 用食醋除去热水瓶胆内的水垢
(5) Ca(HCO3)2溶液中加入盐酸;
(6) 向亚硫酸氢钠溶液中通入氯气
(7) 等体积的氯气与二氧化硫混合气体溶液于水
(8) 澄清的石灰水中加入少量的碳酸氢钠溶液
(9) 澄清的石灰水中加入足量的碳酸氢钠溶液
(10) 向碳酸氢镁溶液中加入足量的氢氧化钠溶液
11.写出与下列离子方程式相对应的化学方程式
(1)2H?BaCO3???Ba?H2O?CO2?
2???(2)Zn?Cu
???Zn2??Cu ?2?(3)SO2?2OH???SO3
?H2O ??(4)Ag?Cl???AgCl?
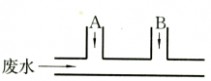
2?(5)Ba?SO42????BaSO4?
12.某工厂排出的废水中含有氯气,为了除去废水中的游离氯,且使废水变为中性,有人提出如图所示的方案:在废水排出管的A、B处分别注入一定量的废烧碱溶液和亚硫酸钠溶液,已知氯气和亚硫酸钠溶液的反应如下:Cl2?Na2SO3?H2O???Na2SO4?2HCl
试写出:
(1)A、B处应加入的物质的化学式依次为 和 ;
(2)A、B处发生的反应的离子方程式是:A ;B .
13.有六种无色溶液,已知它们分别是Na2CO3、Na2SO4、NaClO、KI、BaCl2和HCl的溶液,要求不用试剂把它们鉴别出来。为了鉴别它们各贴以标签a、b、c、d、e、f,然后进行下列实验,实验现象记录如下:
试判断a为 ;b为 ;C为 ;d为 ;e为 ;f为 溶液。
氧化还原反应
第一节 氧化还原反应
【学习要点】
一、氧化还原反应
物质跟氧发生的反应(或物质得到氧的反应)叫氧化反应。如:
C+O2 CO2
CuO+H2


Cu+H2O
中的C和H2都发生了氧化反应。
含氧化合物里的氧被夺去的反应叫做还原反应,例如
CuO+H2 Cu+H2O,
CuO中的氧被H2夺去了,CuO发生的就是还原反应。
有氧得失的反应叫做氧化还原反应。
有元素化合价升降的反应叫氧化还原反应。如: △ △ 点燃
Zn?H2SO4?ZnSO4?H2?
CuO?H2 Cu?H2O
CuO失去了氧,铜元素化合价降低了,发生了还原反应,CuO是氧化剂,具有氧化性,H2得到了氧,氢元素化合价升高了,发生了氧化反应,H2是还原剂,具有还原性。它们的关系可表示如下:
得氧,化合价升高,被氧化
?200?1?20△ 0?1
CuO?H2 Cu?H2O
失氧,化合价降低,被还原 ?20△ 0?1
有电子转移(得失或偏移)的反应叫氧化还原反应。
氧化还原反应概念的发展
二、氧化剂和还原剂
1、氧化剂:在氧化还原反应中,得到电子的物质较氧化剂。氧化剂具有氧化性,在氧化还原反应中化合价降低,本身被还原,其反应后的生成物叫还原产物。
2、还原剂:在氧化还原反应中,失去电子的物质较还原剂。还原剂具有还原性,在氧化还原反应中化合价升高,本身被氧化,其反应后的生成物叫氧化产物。
【例题】
例1 分析下列氧化还原反应中化合价变化的关系,标出电子转移的方向和数目,并指出氧化剂和还原剂。KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
解析 同种元素不同价态间发生氧化还原反应,价态变化的规律是:相靠不相交。
+5 -1 -1 0
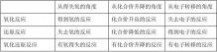


↑+3H2O
答 氧化剂:KClO3 还原剂:HCl
例2 下列叙述正确的是( )
A.有单质生成的反应一定是氧化还原反应
B.有金属单质参加的化合反应一定为氧化还原反应
C.单质在氧化还原反应中只能做氧化剂
D.任何单质均具有氧化性和还原性
E.复分解反应有可能是氧化还原反应
F.分解反应一定是非氧化还原反应
G.得电子越多的氧化剂,其氧化性越强
H.阳离子只能得到电子被还原,作氧化剂
例3:下列化学反应方程式中哪些是氧化还原反应?哪些不是?若是氧化还原反应则标明电子转
移的方向和数目,指明氧化剂和还原剂,若不是氧化还原反应,则标明反应的基本类型。
(1)CaCO3?CO2?H2O?Ca(HCO3)2 (2)2FeCl3?H2S?2FeCl2?2HCl?S?
(3)K2CO3?Ca(OH)2?2KOH?CaCO3 (4)3Cl2?6KOH?5KCl?KClO3?3H2O (5)H2SO4(浓)?H2S?S??SO2??2H2O (6)KClO3?6HCl?3Cl2?KCl?3H2O
例4:甲同学从课外书上找到了两个化学反应方程式:
①MnO2?4HCl(浓)?MnCl2?Cl2??2H2O
②O2?4HCl 催化剂
?2Cl2?2H2O
通过分析,他认为可得出以下几个结论:
A.HCl在上述反应中,都起到还原剂的作用,同时,由于HCl中氯元素为—1价,是氯元素的最低价态,在参与氧化还原中其价态只能升高,所以HCl只能作还原剂。
B.在①、②两个反应中,参加反应的HCl全部都是还原剂。
对于甲的两个结论你认为正确吗?如不正确,试说明理由。
【练习】
1.下列化学反应方程式中哪些是氧化还原反应?哪些不是?若是氧化还原反应则标明电子转移
的方向和数目,指明氧化剂和还原剂,若不是氧化还原反应,则标明反应的基本类型。
ΔNa2SO4?2NH3??2H2O (1)(NH4)2SO4?2NaOH(2)2CaO?2SO2?O2?2CaSO4 (3)2KMnO4Δk2MnO4?MnO2?O2? Δ2K2S?K2SO3?3H2O (4)3S?6KOH
2??2.铋酸钠(NaBio3)在酸性溶液中可以把Mn氧化成MnO4。在调节该溶液酸性时,不应选用
的酸是( ) A.稀硫酸 B.浓盐酸
?C.稀硝酸 ?D.稀盐酸 ?3.氢阴离子(H)能和NH3反应:H?NH3?NH2?H2?。根据上述反应事实可以得出
正确的结论是( )
A.NH3具有还原性 C.该反应的还原产物是H2 B.H是很强的还原剂 D.该反应属于置换反应 ?
4.单质X和Y反应生成化合物X2?Y2?,现有如下叙述:
(1)X被氧化; (2)X是氧化剂; (3)X具有氧化性; (4)XY既是氧化产物又是还原产物; (5)XY中的Y元素具有还原性; (6)XY中的X元素具有氧化性; (7)Y的氧化性比X2?强; (8)Y2?的还原性比X还原性强。上述说法中,正确的是( )
A.⑴⑷⑸⑹ B.⑵⑶⑷⑸ C.⑵⑷⑹⑻ D.⑸⑹⑺⑻
5.一定条件下KClO3与I2发生反应:2KClO3?I2?2KIO3?Cl2,由此推断下列相应的结论,
不正确的是( )
A.该反应属置换反应 C.非金属性:I?Cl B.还原性:I2?Cl2 D.氧化性:KClO3?I2
6.在3BrF3?5H2O?HBrO3?Br2?9HF?O2的反应中,如果有9g水被消耗时,BrF3被
还原的量为( )
A.0.1mol
? B..0.2mol C..0.3mol ?D..0.9mol 7.已知某物质XO(OH2)与Na2SO3反应时,XO(OH)2作氧化剂,Na2SO3被氧化为Na2SO4。
H)2需要100mL2.5mol/LNa2SO3溶液才能把该物质还原。试问现有0.1molXO(O?
XO(OH)2还原后X的最终价态为 。
8.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原物。当参加反应的单质与被还原
硝酸的物质的量之比为2:1时,还原产物是( )
A.NO2 B.NO C.N2O D.N2 ?
9.在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,
充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物NO与NH3的物质的量可能各是多少? 10.XeF6完全水解(与水反应)的反应是非氧化还原反应,反应后生成一种酸性溶液和固体物
质A,A极不稳定易转化为单质而呈强氧化性。A为分子晶体。将适量的A投入30mL 0.1mol/LMn2?的水溶液中,刚好完全反应,放出唯一一种气体单质,该气体为56mL(标准状况),则:(1)A为何物?写出反应的化学方程式;(2)描述反应的现象。
本文标题:离子反应方程式-Fe2+与H2O2反应的离子方程式61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1