一 : 高二要会考帮忙一下知道的,说一下乙醛的银镜反应步骤
高二要会考帮忙一下知道的,说一下乙醛的银镜反应步骤
有醛基的,如甲酸,乙醛.
1,不要加过量氨水.2,水浴加热.3,银氨溶液要现制现用
银镜反应:
2%硝酸银,4%氢氧化钠,稀氨水
1.碱洗试管(加热)
2.2毫升2%硝酸银,加稀氨水至沉淀刚好溶解为止,再滴入1-2滴4%氢氧化钠,摇匀,加2-3滴40%乙醛,用才摇动1分钟,使之变黄,静置即可得银镜.乙醛与氢氧化铜反应:取决于碱性强弱,而与是否新制无关.强碱性条件下,铜离子的络合物适当温度下均可反应.
银镜反应原理:银氨砾离子带有一定的氧化性,而醛基有还原性,因此,是醛基和银氨砾离子之间发生了氧化还原反应,银氨砾离子被还原成金属银,而醛基被氧化成羧基.银氨溶液要在碱性的溶液环境中反应.
以乙醛和银氨溶液反应为例:
CH3CHO+2Ag(NH3)2+ 2OH-→CH3COONH4+2Ag↓+3NH3+H2O
实验步骤:
①板氨溶液的配制:在一支洁净的试管中.加入6mL 2%AgNO3溶液,随后逐滴滴人2%氨水,边滴边振
荡,直到沉淀刚刚消失为止,就得无色银氨溶液.
②银镜的生成:向银氨溶液的试管中滴入3~5滴乙醛溶掖,轻轻振荡后,把试管放人盛有热水的烧杯
里温热(或水浴加热),此时不要摇动.如果试管洗得很洁净.可以看到试管内壁附着一层光亮的银;如试
管不干净.看不到光亮的银,只能看到生成黑色疏松的银沉淀.
③实验后用少量硝酸洗去银镜,并用水洗净后及时处理,不可久置.
(4)说明:
①试管必须洁净
②所用氨水及AgNO3溶液浓度要小(2%).
③滴加顺序;将氨水滴加到AgNO3溶液中.
④加入氨水的量一定要使刚开始生成的沉淀恰好溶解,氨水过量则易生成易爆炸的物质.
⑤该反应为水浴加热(温水浴),不能直接加热.
⑥该反应在碱性较强的环境中进行.
⑦该反应可用来鉴定醛基的存在.
⑧该原理可用于工业制镜.制保温瓶胆.
二 : 银镜反应实验的改进?
银镜反应实验的改进?
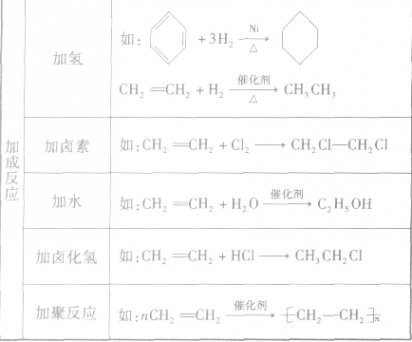
银镜反应是含醛基类物质的一个重要反应,常用于检验醛基的存在,该实验因现象明显而深受学生喜爱。银镜反应实验的关键是银氨溶液的配制,而按照现行教材中的做法:“在洁净的试管里加入1mL2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解。”常常难以控制,实验很容易失败。笔者经过大量的实验比较,发现:将氨水逐滴滴入到AgNO3溶液中,当试管中仍存在少许浑浊时,就进行银镜反应,极易成功,很少失败,并且这也容易操作。
改进后的操作容易控制,不论是老师演示还是学生演示都容易成功,提高了课堂教学效果,读者可自行试之。
三 : (1)写出乙醛的银镜反应的化学方程式_____________________
| (1)写出乙醛的银镜反应的化学方程式______________________________ (2)写出 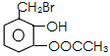 与足量NaOH溶液反应的化学方程式______________________________ 与足量NaOH溶液反应的化学方程式______________________________(3)写出乙二酸与乙二醇发生缩聚反应的化学方程式______________________________ (4)写出加聚产物 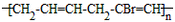 的单体的结构简式_____________________ 的单体的结构简式_____________________ |
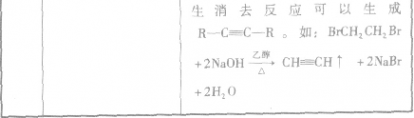
(1)CH3CHO+2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3 CH3COONH4+H2O+2Ag↓+3NH3(2) 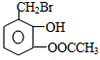 +4NaOH +4NaOH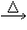 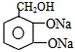 +CH3COONa+NaBr+2H2O +CH3COONa+NaBr+2H2O (3)nHOCH2CH2OH+nHOOC-COOH 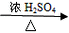 (4)CH2=CH-CH=CH2、BrC≡CH |
考点:
考点名称:有机反应方程式有机反应方程式书写注意事项:有机反应方程式举例:
一、烷烃、烯烃、炔烃
1. 甲烷的实验室制法C2H5OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
2. 甲烷燃烧CH4+2O2 CO2+2H2O
CO2+2H2O
3. 甲烷与氯气CH4+Cl2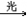 CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2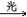 CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2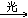 CCl4+HCl
CCl4+HCl
4. 甲烷隔绝空气时高温分解CH4 C+2H2
C+2H2
5. 丁烷的裂解(两个方程式)C4H10 CH4+C3H6
CH4+C3H6
C4H10 C2H4+C2H6
C2H4+C2H6
6. 乙烯的实验室制法CH3CH2OH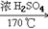 CH2=CH2↑+H2O
CH2=CH2↑+H2O
7. 乙烯燃烧C2H4+3O2 2CO2+2H2O
2CO2+2H2O
8. 乙烯使溴水褪色CH2=CH2+Br2→CH2Br─CH2Br
9. 乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH
C2H5OH
12. 乙烯的加聚
13. 乙烯与丙烯1:1加聚
14. 异戊二烯聚合
15. 苯乙烯与异戊二烯1:1加聚
16. 乙炔的实验室制法CaC2+2H2O→CH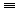 CH↑+Ca(OH)2
CH↑+Ca(OH)2
17. 乙炔与足量氢气反应CH CH+2H2
CH+2H2 CH3-CH3
CH3-CH3
18. 乙炔的聚合
19. 由乙炔制备聚氯乙烯CH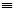 CH+HCl
CH+HCl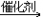 CH2=CHCl
CH2=CHCl
二、苯及其同系物
20. 苯燃烧2C6H6+15O2 12CO2+6H2O
12CO2+6H2O
21. 苯与液溴反应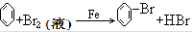
22. 甲苯的硝化反应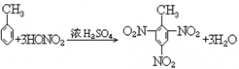
23. 苯与氢气反应
25. 甲苯与浓硝酸、浓硫酸反应
三、卤代烃的性质
26. 溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
27. 溴乙烷的水解反应CH3-CH2-Br+NaOH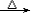 CH3-CH2-OH+NaBr
CH3-CH2-OH+NaBr
28. 氯苯与氢氧化钠水溶液反应
四、醇的性质
29. 乙醇燃烧C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
30. 乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑
31. 乙醇的催化氧化2C2H5OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
32. 乙醇与浓硫酸反应(两个方程式)CH3CH2OH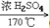 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2CH3CH2OH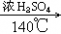 CH3─CH2─O─CH2─CH3+H2O
CH3─CH2─O─CH2─CH3+H2O
33. 乙醇与乙酸反应C2H5OH+CH3COOH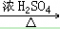 CH3COOC2H5+H2O
CH3COOC2H5+H2O
34. 乙二醇与钠反应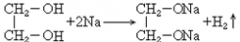
35. 甘油与硝酸反应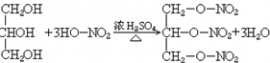
五、酚的性质
36. 苯酚与钠反应
37. 苯酚与氢氧化钠反应
38. 苯酚与浓溴水反应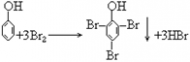
39. 苯酚钠与二氧化碳反应
40. 苯酚与甲醛缩聚
烯烃的通性:
(1)物理性质:随着分子中碳原子数的递增,熔沸点逐渐升高,相对密度逐渐增大,常温下存在状态,由气态逐渐过渡到液态、固态。
(2)化学性质:烯烃可发生氧化、加成、加聚等反应。
①烯烃的氧化反应:烯烃燃烧生成二氧化碳和水。CnH2n+3n/2O2 nCO2+nH2O
nCO2+nH2O
②烯烃的加成:烯烃可与氢气、卤素单质、水、卤化氢等发生加成反应。烯烃的加聚反应:以乙烯为例: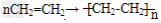 ,加聚时碳碳双键打开。
,加聚时碳碳双键打开。
③二烯烃的加成反应:以1,3-丁二烯(CH2=CH-CH=CH2)加成为例
1,2加成就是加成普通的不饱和键,和普通的烯烃和炔烃的加成一样。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CHCl-CH=CH2
1,4加成,1,4加成是分别加成两边的2个不饱和键,然后在中间重新形成一个双键。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CHCH2Cl
(3)烯烃的顺反异构:根据在两个由双键连接的碳原子上所连的四个原子或基团中两个相同者的位置来决定异构体的类型。当两个相同的原子或基团处于π键平面的同侧时称“顺式异构(cis-isomerism)”;当处于π键平面的异侧时称“反式异构(trans-isomerism)”。Z表示顺,E表示反。 
烃类燃烧规律总结:
1.烃完全燃烧时的耗氧量规律
(1)等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+ )的值,其值越大,耗氧量越大。
)的值,其值越大,耗氧量越大。
(2)等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
(3)实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
2.质量相同的烃CxHy, 越大,生成的CO2越多; 若两种烃的
越大,生成的CO2越多; 若两种烃的 相等,则生成的CO2和H2O的质量均相等。
相等,则生成的CO2和H2O的质量均相等。
3.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
4.不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子、H原子个数比也相同.
5.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮.黑烟越浓,如C2H2(92.3%)、C6H6(92·3%)、C7H8 (91.3%)燃烧时火焰明亮,伴随大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH4(75%)就是如此;对于C2H4及其他单烯烃(均为 85.7%).燃烧时火焰较明亮,并有少量黑烟。
6.气态烃CxHy完全燃烧后生成CO2和H2O 
(1)当H2O为气态时(T>100℃),1L气态烃燃烧前后气体总体积的变化有以下三种情况:
当y=4时,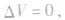 反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
当y>4时, 反应后气体总体积增大;
反应后气体总体积增大;
当y<4时, 反应后气体总体积减小
反应后气体总体积减小
(2)当H2O为液态时(T<100℃),1L气态烃完全燃烧后气体总体积减小
各类烃的反应类型及实例:

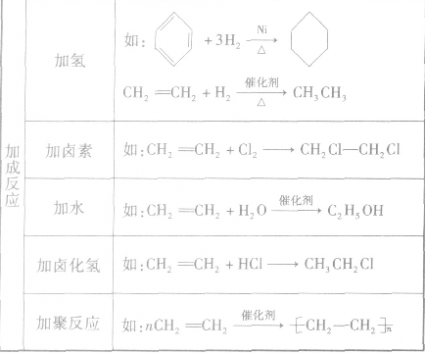
卤代烃:
1.卤代烃的定义
烃分子中的氢原子被卤素原于取代后生成的化合物,称为卤代烃,可用R—X(X为卤素原子)表示。在卤代烃分子中,卤素原子是官能团。由于卤素原子吸引电子的能力较强,使共用电子对偏移,c—x键具有较强的极性,因此卤代烃的反应活性增强。
2.卤代烃的分类 (1)根据分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃和碘代烃。
(2)根据分子中所含卤素原子个数的不同,分为一卤代烃和多卤代烃。
(3)根据烃基结构不同,分为卤代烷烃、卤代烯烃、卤代芳香烃等。
卤代烃的性质:
1.卤代烃的物理性质
(1)常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体。
(2)一氯代烷的物理性质:随着碳原子数增加,其熔、沸点和密度逐渐增大(沸点和熔点大于相应的烃)。
(3)难溶于水,易溶于有机溶剂,除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大。密度一般随烃基中碳原子数增加而增大。
2.卤代烃的化学性质与C2H5Br相似,可以发生水解反应和消去反应


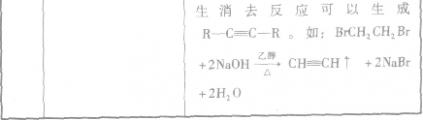
卤代烃中卤素的检验:
1.实验原理
根据AgX的颜色(白色、淡黄色、黄色)可确定卤素(氯、溴、碘):
2.实验步骤
①取少量卤代烃;
②加入NaOH溶液;
③加热煮沸;
④加入过量稀硝酸酸化;
⑤加入AgNO3溶液。
3.实验说明加热煮沸是为了加快水解速率,因不同的卤代烃水解难易程度不同;加入过量稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,干扰实验现象,同时也是为了检验生成的沉淀是否溶于稀硝酸。
卤代烃在有机物转化和合成中的重要桥梁作用:
1.一元代物与二元代物之间的转化关系 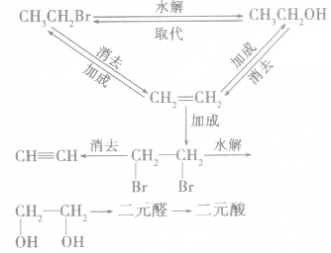
2.卤代烃的桥梁作用通过烷烃、芳香烃与X2发生取代反应,烯烃、炔烃与X2、HX发生加成反应等途径可向有机物分子中引入一X;而卤代烃的水解和消去反应均消去一X。卤代烃发生取代、消去反应后,可在更大的空间上与醇、醛、酯相联系。引入卤素原子常常是改变性能的第一步,卤代烃在有机物转化、推断、合成巾具有“桥梁”的重要地位和作用。
溴乙烷:
1.分子结构
分子式: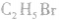
结构式:
电子式:
结构简式:
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点为38.4℃,密度比水大,难溶于水,易溶于乙醇等多种有机溶剂。
3.溴乙烷的化学性质
(1)水解反应:溴乙烷在NaOH存在的条件下可以跟水发生反应生成乙醇和溴化氢。 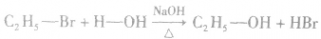
说明:溴乙烷的水解反应又属于取代反应。
溴乙烷水解生成的HBr与NaOH易发生中和反应,水解方程式也可写为: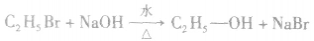
(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX)而生成含不饱和键(双键或三键)化合物的反应,叫做消去反应。
溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,从溴乙烷分子中脱去HBr,生成乙烯:
醇:
醇的定义:羟基跟烃基或苯环侧链上的碳原子直接相连的化合物叫做醇。
说明:在同一个碳原子上存在两个或多个羟基的多元醇,羟基连在碳碳双键或碳碳三键的不饱和碳原子上的醇,都不能稳定存在。
醇的性质:
1.醇的物理性质饱和一元醇的沸点比其相对分子质量接近的烷烃或烯烃的沸点高。这是因为一个醇分子中羟基上的氢原子可与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子间的相互作用。
2.醇的化学性质
(1)羟基的反应
①取代反应
在加热的条件下,醇与氢卤酸(如HCl、HBr、HI)发生取代反应生成相应的卤代烃和水,例如:
在浓硫酸作催化剂及加热的条件下,醇可以发生分子间的取代反应生成醚和水,例如:
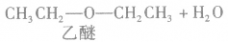
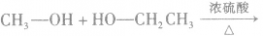
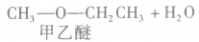
说明a.由醇生成醚的反应又叫做脱水反应或分子间脱水反应。
b.在醇生成醚的反应中,浓硫酸的作用是作催化剂和脱水剂。温度是醇脱水生成醚的必要条件之一,若温度过低,反应速率很慢或不能反应;若温度过高,反应会生成其他物质。
②消去反应
含β—H的醇,在一定条件下发生消去反应生成烯烃和水,例如: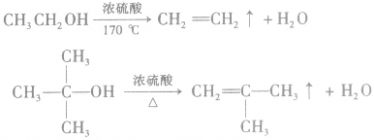
说明a.由醇生成烯烃的反应又叫做脱水反应或分子内脱水反应。
b.从分子组成与结构的方面来说,脱水生成烯烃的醇分子必须含有β一H,如 由于分子中没有β—H,不能脱水生成烯烃。
由于分子中没有β—H,不能脱水生成烯烃。
c.在醇生成烯烃的反应中,浓硫酸的作用是作催化剂和脱水剂。
d.人们通常把和官能团相连的碳原子称为α一C 原子.α—C原子上的氢原子称为α—H原子;依次称为β一C原子,β—H原子……
(2)羟基中氢原子的反应
①与活泼金属反应
由于氧元素与氢元素电负性的差异较大,羟基中氢氧键的极性比较强,容易断裂,所以羟基中的氢原子比较活泼,能与钠、钾、镁、铝等金属发生反应。例如,乙醇可以与金属钠反应生成乙醇钠和氢气。
②酯化反应
在一定条件下,醇羟基中的氢原子能够被羧酸分子中的酰基( )取代生成酯和水。
)取代生成酯和水。
例如:

说明a.该类反应由于生成了酯,所以叫做酯化反应。从物质分子组成形式变化的角度来说,该反应又属于取代反应。
b.在乙醇与乙酸生成乙酸乙酯的反应中,利用氧同位素( )示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(
)示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素( )。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
)。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
c.醇跟羧酸发生的酯化反应为可逆反应,具有反应速率慢和向右进行程度小的特点。加入浓硫酸的目的(浓硫酸的作用)有两个:一是作催化剂,提高化学反应速率;二是作吸水剂,通过吸收反应生成的水促使反应向生成乙酸乙酯的方向移动,提高乙酸与乙醇的转化率。
d.醇还能与硫酸、硝酸、磷酸等无机含氧酸发生酯化反应,生成的酯统称为无机酸酯。
(3)氧化反应大多数醇可以燃烧,完全燃烧时生成二氧化碳和水。醇也可以被催化氧化。例如: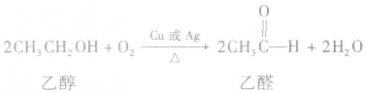

说明a.在醇的催化氧化反应中,醇分子中有2 个α一H时,醇被氧化为醛;醇分子中有1个α—H时,醇被氧化为酮;醇分子中没有α一H时,醇不能发生上述催化氧化反应。
b.乙醇也能被KMnO4酸性溶液、K2Cr2O7(重铬酸钾)酸性溶液氧化。
脂肪醇、芳香醇、酚和芳香醚的比较:
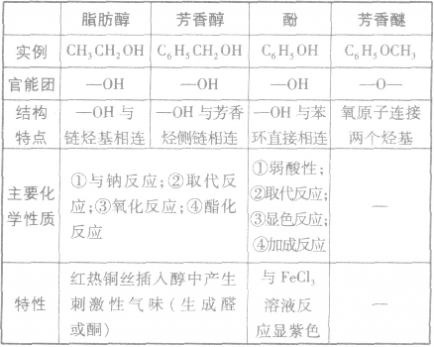
羟基氢原子活泼性比较:

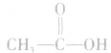 均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
酚:
l、酚的定义:羟基跟苯环直接相连的有机物叫做酚。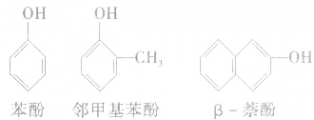
注意: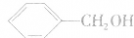 属于芳香醇,不属于酚。
属于芳香醇,不属于酚。
酚的通性:
通式为ArOH,是芳香烃环上的氢被羟基(-OH)取代的一类芳香族化合物。
(1)大多数酚类物质是无色晶体,只有少数为液体。
(2)易溶于苯、乙醇、焦油类等有机溶剂,但溶解度不等。
(3)具有羟基反应和烃基取代反应的特点。
(4)具有很弱的酸性,在强碱中生成酚盐。
(5)芳香环上的磺酸基、氨基和卤素都可和羟基发生置换反应,工业上利用这些性质生产合成酚。
(6)苯酚是结构最简单也是最重要酚类物质。它的化学性质可代表其他酚的化学性质。
(7)在稀碱(氨)和草酸作用下,酚可与醛发生反应。
(8)易发生氧化反应,所以含酚废水一般都带有颜色。
(9)酚与硫酸发生硝化反应。
苯、甲苯、苯酚的分子结构及典型性质的比较:

四 : (1)写出乙醛的银镜反应的化学方程式______________________________(2
| (1)写出乙醛的银镜反应的化学方程式______________________________ (2)写出  与足量NaOH溶液反应的化学方程式______________________________ 与足量NaOH溶液反应的化学方程式______________________________(3)写出乙二酸与乙二醇发生缩聚反应的化学方程式______________________________ (4)写出加聚产物 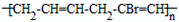 的单体的结构简式_____________________ 的单体的结构简式_____________________ |
(1)CH3CHO+2Ag(NH3)2OH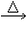 CH3COONH4+H2O+2Ag↓+3NH3 CH3COONH4+H2O+2Ag↓+3NH3(2)  +4NaOH +4NaOH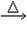  +CH3COONa+NaBr+2H2O +CH3COONa+NaBr+2H2O (3)nHOCH2CH2OH+nHOOC-COOH  (4)CH2=CH-CH=CH2、BrC≡CH |
考点:
考点名称:有机反应方程式有机反应方程式书写注意事项:有机反应方程式举例:
一、烷烃、烯烃、炔烃
1. 甲烷的实验室制法C2H5OH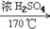 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2. 甲烷燃烧CH4+2O2 CO2+2H2O
CO2+2H2O
3. 甲烷与氯气CH4+Cl2 CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2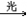 CCl4+HCl
CCl4+HCl
4. 甲烷隔绝空气时高温分解CH4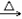 C+2H2
C+2H2
5. 丁烷的裂解(两个方程式)C4H10 CH4+C3H6
CH4+C3H6
C4H10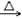 C2H4+C2H6
C2H4+C2H6
6. 乙烯的实验室制法CH3CH2OH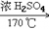 CH2=CH2↑+H2O
CH2=CH2↑+H2O
7. 乙烯燃烧C2H4+3O2 2CO2+2H2O
2CO2+2H2O
8. 乙烯使溴水褪色CH2=CH2+Br2→CH2Br─CH2Br
9. 乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH
C2H5OH
12. 乙烯的加聚
13. 乙烯与丙烯1:1加聚
14. 异戊二烯聚合
15. 苯乙烯与异戊二烯1:1加聚
16. 乙炔的实验室制法CaC2+2H2O→CH CH↑+Ca(OH)2
CH↑+Ca(OH)2
17. 乙炔与足量氢气反应CH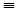 CH+2H2
CH+2H2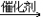 CH3-CH3
CH3-CH3
18. 乙炔的聚合
19. 由乙炔制备聚氯乙烯CH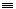 CH+HCl
CH+HCl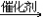 CH2=CHCl
CH2=CHCl
二、苯及其同系物
20. 苯燃烧2C6H6+15O2 12CO2+6H2O
12CO2+6H2O
21. 苯与液溴反应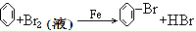
22. 甲苯的硝化反应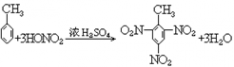
23. 苯与氢气反应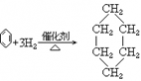
25. 甲苯与浓硝酸、浓硫酸反应
三、卤代烃的性质
26. 溴乙烷的消去反应CH3CH2Br+NaOH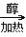 CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
27. 溴乙烷的水解反应CH3-CH2-Br+NaOH CH3-CH2-OH+NaBr
CH3-CH2-OH+NaBr
28. 氯苯与氢氧化钠水溶液反应
四、醇的性质
29. 乙醇燃烧C2H5OH+3O2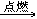 2CO2+3H2O
2CO2+3H2O
30. 乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑
31. 乙醇的催化氧化2C2H5OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
32. 乙醇与浓硫酸反应(两个方程式)CH3CH2OH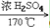 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O
CH3─CH2─O─CH2─CH3+H2O
33. 乙醇与乙酸反应C2H5OH+CH3COOH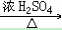 CH3COOC2H5+H2O
CH3COOC2H5+H2O
34. 乙二醇与钠反应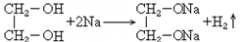
35. 甘油与硝酸反应
五、酚的性质
36. 苯酚与钠反应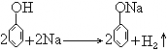
37. 苯酚与氢氧化钠反应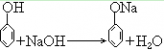
38. 苯酚与浓溴水反应
39. 苯酚钠与二氧化碳反应
40. 苯酚与甲醛缩聚
烯烃的通性:
(1)物理性质:随着分子中碳原子数的递增,熔沸点逐渐升高,相对密度逐渐增大,常温下存在状态,由气态逐渐过渡到液态、固态。
(2)化学性质:烯烃可发生氧化、加成、加聚等反应。
①烯烃的氧化反应:烯烃燃烧生成二氧化碳和水。CnH2n+3n/2O2 nCO2+nH2O
nCO2+nH2O
②烯烃的加成:烯烃可与氢气、卤素单质、水、卤化氢等发生加成反应。烯烃的加聚反应:以乙烯为例: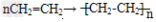 ,加聚时碳碳双键打开。
,加聚时碳碳双键打开。
③二烯烃的加成反应:以1,3-丁二烯(CH2=CH-CH=CH2)加成为例
1,2加成就是加成普通的不饱和键,和普通的烯烃和炔烃的加成一样。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CHCl-CH=CH2
1,4加成,1,4加成是分别加成两边的2个不饱和键,然后在中间重新形成一个双键。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CHCH2Cl
(3)烯烃的顺反异构:根据在两个由双键连接的碳原子上所连的四个原子或基团中两个相同者的位置来决定异构体的类型。当两个相同的原子或基团处于π键平面的同侧时称“顺式异构(cis-isomerism)”;当处于π键平面的异侧时称“反式异构(trans-isomerism)”。Z表示顺,E表示反。 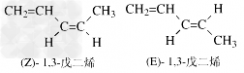
烃类燃烧规律总结:
1.烃完全燃烧时的耗氧量规律
(1)等物质的量的烃(CxHy)完全燃烧时,其耗氧量的大小取决于(x+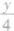 )的值,其值越大,耗氧量越大。
)的值,其值越大,耗氧量越大。
(2)等质量的烃完全燃烧时,其耗氧量的大小取决于该烃分子中氢的质量分数(或氢原子数与碳原子数的比值),其值越大,耗氧量越大。
(3)实验式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气以及燃烧后生成的二氧化碳和水的量均为定值。满足该条件的烃有C2H2和C6H6、烯烃与环烷烃等。
说明:在计算烃的衍生物的耗氧量时可将其改写成CxHy·(CO2)m·(H2O)n,耗氧量仅由CxHy 决定。
2.质量相同的烃CxHy,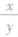 越大,生成的CO2越多; 若两种烃的
越大,生成的CO2越多; 若两种烃的 相等,则生成的CO2和H2O的质量均相等。
相等,则生成的CO2和H2O的质量均相等。
3.碳的质量分数ω(c)相同的有机物(最简式可以相同也可以不同),只要总质量一定,以任意比混合,完全燃烧后产生的CO2的量总是一个定值。
4.不同的有机物完全燃烧时,若生成的CO2和H2O的物质的量之比相同,则它们分子中C原子、H原子个数比也相同.
5.含碳量高低与燃烧现象的关系含碳量越高,燃烧现象越明显,表现在火焰越明亮.黑烟越浓,如C2H2(92.3%)、C6H6(92·3%)、C7H8 (91.3%)燃烧时火焰明亮,伴随大量浓烟;而含碳量越低,燃烧现象越不明显,往往火焰不明亮,无黑烟,如CH4(75%)就是如此;对于C2H4及其他单烯烃(均为 85.7%).燃烧时火焰较明亮,并有少量黑烟。
6.气态烃CxHy完全燃烧后生成CO2和H2O 
(1)当H2O为气态时(T>100℃),1L气态烃燃烧前后气体总体积的变化有以下三种情况:
当y=4时, 反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
反应后气体总体积不变,常温常压下呈气态的烃中,只有CH4、C2H4、C3H4;
当y>4时, 反应后气体总体积增大;
反应后气体总体积增大;
当y<4时, 反应后气体总体积减小
反应后气体总体积减小
(2)当H2O为液态时(T<100℃),1L气态烃完全燃烧后气体总体积减小
各类烃的反应类型及实例:
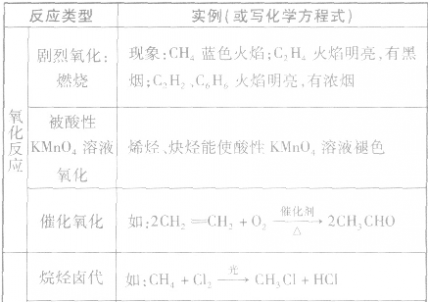

卤代烃:
1.卤代烃的定义
烃分子中的氢原子被卤素原于取代后生成的化合物,称为卤代烃,可用R—X(X为卤素原子)表示。在卤代烃分子中,卤素原子是官能团。由于卤素原子吸引电子的能力较强,使共用电子对偏移,c—x键具有较强的极性,因此卤代烃的反应活性增强。
2.卤代烃的分类 (1)根据分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃和碘代烃。
(2)根据分子中所含卤素原子个数的不同,分为一卤代烃和多卤代烃。
(3)根据烃基结构不同,分为卤代烷烃、卤代烯烃、卤代芳香烃等。
卤代烃的性质:
1.卤代烃的物理性质
(1)常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体。
(2)一氯代烷的物理性质:随着碳原子数增加,其熔、沸点和密度逐渐增大(沸点和熔点大于相应的烃)。
(3)难溶于水,易溶于有机溶剂,除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大。密度一般随烃基中碳原子数增加而增大。
2.卤代烃的化学性质与C2H5Br相似,可以发生水解反应和消去反应


卤代烃中卤素的检验:
1.实验原理
根据AgX的颜色(白色、淡黄色、黄色)可确定卤素(氯、溴、碘):
2.实验步骤
①取少量卤代烃;
②加入NaOH溶液;
③加热煮沸;
④加入过量稀硝酸酸化;
⑤加入AgNO3溶液。
3.实验说明加热煮沸是为了加快水解速率,因不同的卤代烃水解难易程度不同;加入过量稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,干扰实验现象,同时也是为了检验生成的沉淀是否溶于稀硝酸。
卤代烃在有机物转化和合成中的重要桥梁作用:
1.一元代物与二元代物之间的转化关系 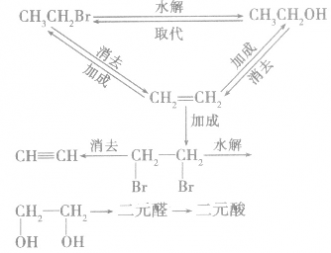
2.卤代烃的桥梁作用通过烷烃、芳香烃与X2发生取代反应,烯烃、炔烃与X2、HX发生加成反应等途径可向有机物分子中引入一X;而卤代烃的水解和消去反应均消去一X。卤代烃发生取代、消去反应后,可在更大的空间上与醇、醛、酯相联系。引入卤素原子常常是改变性能的第一步,卤代烃在有机物转化、推断、合成巾具有“桥梁”的重要地位和作用。
溴乙烷:
1.分子结构
分子式:
结构式: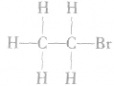
电子式:
结构简式: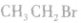
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点为38.4℃,密度比水大,难溶于水,易溶于乙醇等多种有机溶剂。
3.溴乙烷的化学性质
(1)水解反应:溴乙烷在NaOH存在的条件下可以跟水发生反应生成乙醇和溴化氢。 
说明:溴乙烷的水解反应又属于取代反应。
溴乙烷水解生成的HBr与NaOH易发生中和反应,水解方程式也可写为:
(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX)而生成含不饱和键(双键或三键)化合物的反应,叫做消去反应。
溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,从溴乙烷分子中脱去HBr,生成乙烯:
醇:
醇的定义:羟基跟烃基或苯环侧链上的碳原子直接相连的化合物叫做醇。
说明:在同一个碳原子上存在两个或多个羟基的多元醇,羟基连在碳碳双键或碳碳三键的不饱和碳原子上的醇,都不能稳定存在。
醇的性质:
1.醇的物理性质饱和一元醇的沸点比其相对分子质量接近的烷烃或烯烃的沸点高。这是因为一个醇分子中羟基上的氢原子可与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子间的相互作用。
2.醇的化学性质
(1)羟基的反应
①取代反应
在加热的条件下,醇与氢卤酸(如HCl、HBr、HI)发生取代反应生成相应的卤代烃和水,例如:
在浓硫酸作催化剂及加热的条件下,醇可以发生分子间的取代反应生成醚和水,例如: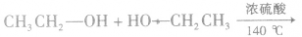
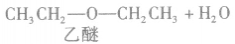
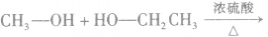
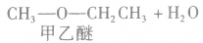
说明a.由醇生成醚的反应又叫做脱水反应或分子间脱水反应。
b.在醇生成醚的反应中,浓硫酸的作用是作催化剂和脱水剂。温度是醇脱水生成醚的必要条件之一,若温度过低,反应速率很慢或不能反应;若温度过高,反应会生成其他物质。
②消去反应
含β—H的醇,在一定条件下发生消去反应生成烯烃和水,例如: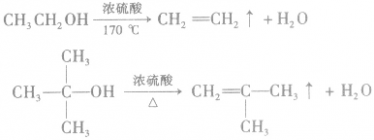
说明a.由醇生成烯烃的反应又叫做脱水反应或分子内脱水反应。
b.从分子组成与结构的方面来说,脱水生成烯烃的醇分子必须含有β一H,如 由于分子中没有β—H,不能脱水生成烯烃。
由于分子中没有β—H,不能脱水生成烯烃。
c.在醇生成烯烃的反应中,浓硫酸的作用是作催化剂和脱水剂。
d.人们通常把和官能团相连的碳原子称为α一C 原子.α—C原子上的氢原子称为α—H原子;依次称为β一C原子,β—H原子……
(2)羟基中氢原子的反应
①与活泼金属反应
由于氧元素与氢元素电负性的差异较大,羟基中氢氧键的极性比较强,容易断裂,所以羟基中的氢原子比较活泼,能与钠、钾、镁、铝等金属发生反应。例如,乙醇可以与金属钠反应生成乙醇钠和氢气。
②酯化反应
在一定条件下,醇羟基中的氢原子能够被羧酸分子中的酰基( )取代生成酯和水。
)取代生成酯和水。
例如: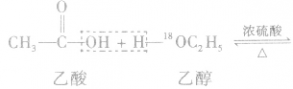

说明a.该类反应由于生成了酯,所以叫做酯化反应。从物质分子组成形式变化的角度来说,该反应又属于取代反应。
b.在乙醇与乙酸生成乙酸乙酯的反应中,利用氧同位素( )示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(
)示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素( )。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
)。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
c.醇跟羧酸发生的酯化反应为可逆反应,具有反应速率慢和向右进行程度小的特点。加入浓硫酸的目的(浓硫酸的作用)有两个:一是作催化剂,提高化学反应速率;二是作吸水剂,通过吸收反应生成的水促使反应向生成乙酸乙酯的方向移动,提高乙酸与乙醇的转化率。
d.醇还能与硫酸、硝酸、磷酸等无机含氧酸发生酯化反应,生成的酯统称为无机酸酯。
(3)氧化反应大多数醇可以燃烧,完全燃烧时生成二氧化碳和水。醇也可以被催化氧化。例如: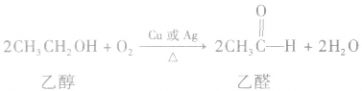
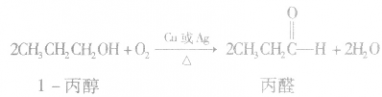
说明a.在醇的催化氧化反应中,醇分子中有2 个α一H时,醇被氧化为醛;醇分子中有1个α—H时,醇被氧化为酮;醇分子中没有α一H时,醇不能发生上述催化氧化反应。
b.乙醇也能被KMnO4酸性溶液、K2Cr2O7(重铬酸钾)酸性溶液氧化。
脂肪醇、芳香醇、酚和芳香醚的比较:

羟基氢原子活泼性比较:
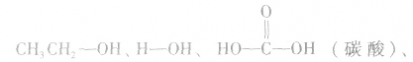
 均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
酚:
l、酚的定义:羟基跟苯环直接相连的有机物叫做酚。
注意: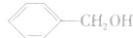 属于芳香醇,不属于酚。
属于芳香醇,不属于酚。
酚的通性:
通式为ArOH,是芳香烃环上的氢被羟基(-OH)取代的一类芳香族化合物。
(1)大多数酚类物质是无色晶体,只有少数为液体。
(2)易溶于苯、乙醇、焦油类等有机溶剂,但溶解度不等。
(3)具有羟基反应和烃基取代反应的特点。
(4)具有很弱的酸性,在强碱中生成酚盐。
(5)芳香环上的磺酸基、氨基和卤素都可和羟基发生置换反应,工业上利用这些性质生产合成酚。
(6)苯酚是结构最简单也是最重要酚类物质。它的化学性质可代表其他酚的化学性质。
(7)在稀碱(氨)和草酸作用下,酚可与醛发生反应。
(8)易发生氧化反应,所以含酚废水一般都带有颜色。
(9)酚与硫酸发生硝化反应。
苯、甲苯、苯酚的分子结构及典型性质的比较:
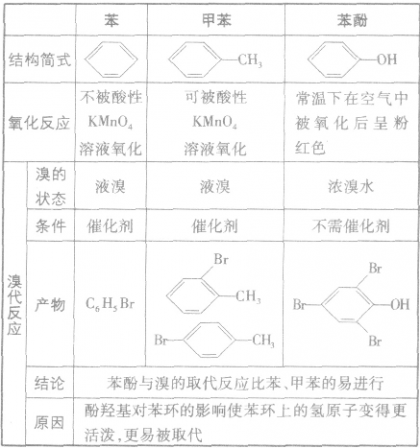
五 : (1)写出乙醛的银镜反应的化学方程式______(2)写出与足量NaOH溶液反应的化学方程式____
| (1)写出乙醛的银镜反应的化学方程式______ (2)写出 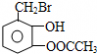 与足量NaOH溶液反应的化学方程式______ (3)写出乙二酸与乙二醇发生缩聚反应的化学方程式______ (4)写出加聚产物[CH2-CH=CH-CH2-CBr=CH]n的单体的结构简式______. |
(1)乙醛与银氨溶液反应能生成银单质和乙酸,即其反应方程式为:CH3CHO+2Ag(NH3)2OH CH3COONH4+H2O+2Ag↓+3NH3, 故答案为:CH3CHO+2Ag(NH3)2OH  CH3COONH4+H2O+2Ag↓+3NH3; (2) 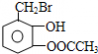 具有的官能团溴原子,在碱性条件下能水解生成醇;具有的酚羟基可与氢氧化钠反应;具有的酯键官能团,在碱性条件下能水解生成酚和乙酸,酚和酸继续与碱反应.则 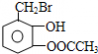 与足量NaOH溶液反应的化学方程式: 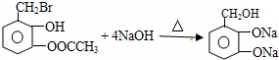 +CH3COONa+NaBr+2H2O, 故答案为: 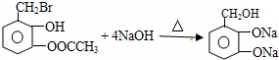 +CH3COONa+NaBr+2H2O; (3)乙二酸与乙二醇发生缩聚反应时,类似酯化反应,醇脱羟基H原子,酸脱羧基中的羟基,并生成聚合物和水, 则乙二酸与乙二醇发生缩聚反应的化学方程式为:nHOCH2CH2OH+nHOOC-COOH  H[OCH2CH2O]nH+(2n-1)H2O, 故答案为:nHOCH2CH2OH+nHOOC-COOH  H[OCH2CH2O]nH+(2n-1)H2O; (4)发生加聚反应时,单体中不饱和键要断裂一个键,来与其他单体结合形成高聚物,根据高聚物写单体时,可以采取找链接,断单键,价键向里转移的方法,当某碳原子出现形成5个键时,即断开另一碳碳键,从而得到[CH2-CH=CH-CH2-CBr=CH]n的单体,即CH2=CH-CH=CH2、BrC≡CH,故答案为:CH2=CH-CH=CH2、BrC≡CH. |
考点:
考点名称:化学反应方程式化学方程式:
用化学式来表示化学反应的式子,叫做化学方程式。化学方程式不仅表明了反应物、生成物和反应条件,同时,通过相对分子质量或相对原子质量还可以表示个物质之间的质量关系,即各物质之间的质量比。
书写化学方程式要遵守两个原则:
一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;
二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
化学方程式的意义:
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
考点名称:酯化反应酯化反应:
| 反应类型 | 定义 | 举例 |
| 酯化反应 | 酸和醇起作用,生成酯和水的反应 |  |
酯化反应的类型:
1.一元羧酸和一元醇的酯化反应
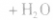
2.二元羧酸(或醇)和一元醇(或羧酸)的酯化反应
①二元羧酸和一元醇按物质的量之比1:1反应,如
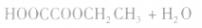
②二元羧酸和一元醇按物质的量之比1:2反应,如

③一元羧酸和二元醇按物质的量之比1:1反应,如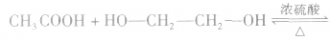

④一元羧酸和二元醇按物质的量之比2:1反应,如 

3.多元羧酸与多元醇发生酯化反应
①生成环状酯。如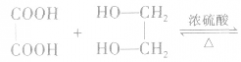
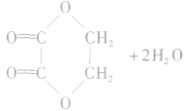
②生成聚酯。如 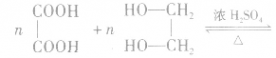

4.无机含氧酸与醇形成无机酸酯

5.羧基酸分子内的酯化反应 
6.羟基酸分子间的酯化反应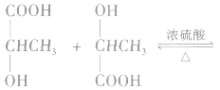
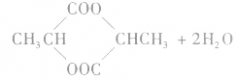
加聚反应:
| 反应类型 | 定义 | 举例 |
| 加聚反应 | 含有碳碳双键、三键、的不饱和化合物在催化剂的作用下生成高分子化合物的反应。 |  |
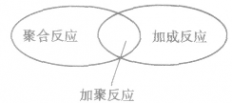
缩聚反应:
| 反应类型 | 定义 | 举例 |
| 缩聚反应 | 一种或两种以上的单体之间结合生成高分子化合物,同时生成小分子(水或卤化氢)的反应。 |  |
缩聚物和缩聚反应方程式的书写:
1.书写缩合聚合物(简称缩聚物)结构式时,与加成聚合物(简称加聚物)结构式写法有点不同,缩聚物结构式要在方括号外侧写出链节余下的端基原子或原子团,而加聚物的端基不确定,通常用横线“一”表示。 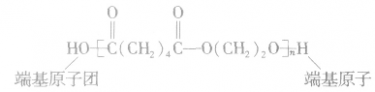
2.写缩聚反应方程式时,除单体物质的量与缩聚物结构式的下角标要一致外,也要注意生成小分子的物质的量。南一种单体进行缩聚反应,生成小分子物质的量应为(n一1);南两种单体进行缩聚反应,生成小分子物质的量应为(2n一1)。例如: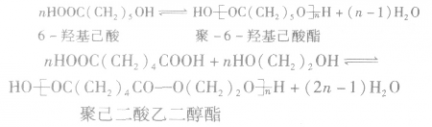
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1