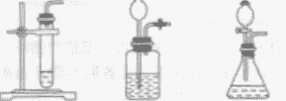
一 : 用金鱼藻作实验材料进行如图所示的实验,该实验收集到的气体主要是( )
用金鱼藻作实验材料进行如图所示的实验,该实验收集到的气体主要是( )
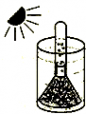 A. 空气
A. 空气
B. 氧气
C. 水蒸气
D. 二氧化碳
用金鱼藻作实验材料进行如图所示的实验,该实验收集到的气体主要是( )的参考答案
绿色植物通过叶绿体利用光能把二氧化碳和水转变成储存能量的有机物,并释放出氧气的过程叫绿色植物光合作用.金鱼藻在光下进行光合作用吸收二氧化碳释放氧气.所以实验收集到的气体主要是氧气.综上所述A、C、D选项错误,只有B选项正确.
故选:B
二 : 在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25
在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气.某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出.加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
| 编号 | 1 | 2 | 3 | 4 | | 加水的质量(g) | 10 | 10 | 10 | 10 | | 剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
试求:(1)表中m值为______;
(2)混合物中KClO3的质量______;
(3)所制得氧气的质量(写出具体计算过程).______. |
题型:问答题难度:中档来源:不详
(1)由1和2可知加入10g水最多溶解7.25g-4.05g=3.2gKCl,
而第三、第四次加水后溶解KCl为4.05g-3g<3.2g,
则第三次加水后KCl完全溶解,剩余的固体全部是不溶于水的MnO2,则m=3,故答案为:3;
(2)原混合物中KClO3为15.25g-3g=12.25g.故答案为:12.25g
(3)设可制得氧气的质量为x
2KClO32KCl+3O2↑
24596
12.25g x
=
x=4.8g
答:可制得氧气4.8克. |
考点:
考点名称:化学反应方程式的计算
利用化学方程式的简单计算:1.
理论依据:所有化学反应均遵循质量守恒定律,根据化学方程式计算的理论依据是质量守恒定律。
2.
基本依据
根据化学方程式计算的基本依据是化学方程式中各反应物、生成物之间的质量比为定值。而在化学方程式中各物质的质量比在数值上等于各物质的相对分子质量与其化学计量数的乘积之比。例如:镁燃烧的化学方程式为 2Mg+O
2
2MgO,其中各物质的质量之比为,m(Mg):m (O
2):n(MgO)=48:32:80=3:2:5。
有关化学方程式的计算:1.
含杂质的计算,在实际生产和实验中绝对纯净的物质是不存在的,因此解题时把不纯的反应物换算成纯净物后才能进行化学方程式的计算,而计算出的纯净物也要换算成实际生产和实验中的不纯物。这些辅助性计算可根据有关公式进行即可。
2.
代入化学方程式中进行计算的相关量(通常指质量;必须需纯净的(不包括未参加反应的质量)。若是气体体积需换算成质量,若为不纯物质或者溶液,应先换算成纯物质的质量或溶液中溶质的质量。
(1)气体密度(g/L)=

(2)纯度=

×100%=

×100%=1-杂质的质量分数
(3)纯净物的质量=混合物的质量×纯度
综合计算:1.
综合计算题的常见类型
(1)将溶液的相关计算与化学方程式的相关计算结合在一起的综合计算。
(2)将图像、图表、表格、实验探究与化学方程式相结合的综合计算
2.
综合计算题的解题过程一般如下: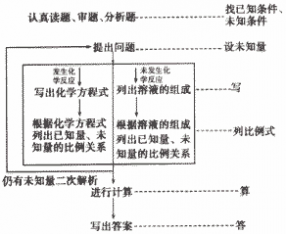
综合型计算题是初中化学计算题中的重点、难点。这种题类型复杂,知识点多,阅读信息量大,思维过程复杂,要求学生有较高的分析应用能力和较强的文字表达能力。它考查的不仅是有关化学式、化学方程式、溶解度、溶质质量分数的有关知识,也是考察基本概念、原理及元素化合物的有关知识。综合计算相对对准度较大,但只要较好地掌握基本类型的计算,再加以认真审题,理清头绪,把握关系,步步相扣,就能将问题顺利解决。
3.
溶质质量分数与化学方程式相结合的综合计算溶质质量分数与化学方程式相结合的综合计算题,问题情景比较复杂。解题时,应首先明确溶液中的溶质是什么,溶质的质量可通过化学方程式计算得出,其次应明确所求溶液的质量如何计算,最后运用公式汁算出溶液的溶质质量分数。
解题的关键是掌握生成溶液质量的计算方法:生成溶液的质量=反应前各物质的质量总和一难溶性杂质(反应的混有的且不参加反应的)的质量一生成物中非溶液(生成的沉淀或气体)的质量。
(1)固体与液体反应后有关溶质质量分数的计算于固体与液体发生反应,求反应后溶液中溶质的质量分数,首先要明确生成溶液中的溶质是什么,其次再通过化学反应计算溶质质量是多少(有时溶质质量由几个部分组成),最后分析各量间的关系,求出溶液总质量,再运用公式计算出反应后溶液中溶质的质量分数。
对于反应所得溶液的质量有两种求法:
①溶液组成法:溶液质节=溶质质量+溶剂质量,其中溶质一定是溶解的,溶剂水根据不同的题目通常有两种情况:原溶液中的水;化学反应生成的水。
②质量守恒法:溶液质量=进入液体的固体质量(包括由于反应进入和直接溶入的)+液体质量-生成不溶物的质量-生成气体的质量。
(2)对于液体与液体的反应,一般是酸碱、盐之间发生复分解反应,求反应后溶液中溶质的质量分数。此类计算与固体和液体反应后的计算类似,自先应明确生成溶液中的溶质是什么,其次再通过化学应应计算溶质质量是多少(往往溶质质量由几个部分组成),最后分析各量间的关系、求出溶液总质量再运用公式计算出反应后溶液中溶质的质量分数此类反应发生后,溶液质量也有两种求法:
①溶液组成法(同上)。
②质量守恒法:溶液质量=所有液体质量之和-生成沉淀的质量-生成气体的质量。
4.
图像、表格、实验探究与化学方程式相结合的综合计算 在近几年中考题出现了以图像,表格为载体的化学计算题这类题的特点是利用数学方法将化学实验数据进行处理和表达,常常以坐标曲线、图像、表格等形式将解题信息呈现。解答此类题目时,受求学生能够对图像,表格进行科学分析从中获取有用信息并结合化学知识将有用信息,应用到解决实际问题中
(1)图像与化学方程式结台的综合计算
图像型计算题是常见的题型是坐标曲线题,其特点是借助数学方法中的坐标图,把多个元素对体系变化的影响用曲线图直观表示出来。
坐标系中的曲线图不仅能表示化学反应,还能较好地反映化学变化的过程,读图时,要善于从曲线图中捕捉到“三点”,(起点,拐点,终点),并分析其含义。特别是要重点了解拐点表示对应两种物质一定恰好完全反应,这是此类题的关键。
(2)表格与化学方程式结合的综合计算
这类题往往给出一组或多组数据或条件,通过对表格中数据或条件的分析,对比,解答有关问题或进行计算。
策略:要通过仔细阅读,探究表格中各组数据之间内在的规律,努力从“变”中找“不变”,及时发现规律之中的矛盾点,从“不变”中找“变”,进而分析矛盾的根源,解决问题。
(3)实验探究与化学方程式相结合的综合计算
做实验探究的综合计算题时,学生应将化学计算与化学实验紧密结合,在对实验原理,实验数据进行分析理解的基础上,理出解题思路,在解题过程中要特别注意实验数据与物质(或元素)质量间的关系,解题的关键是理清思路,找出正确有用数据,认真做好每一步计算。
5.
化学方程式计算中的天平平衡问题: 化学计算中有关天平平衡问题的计算一般指眨应前灭平已处于平衡状态,当托盘两边烧杯中加入物质后,引起烧杯内物质净增量的变化,从而确定天平能否仍处于平衡的状态。解此类题目必须理顺以下关系:烧杯内物质净增质量=加入物质质量一放出气体质量;当左边净增质量=右边净增质量时,天平仍处于平衡状念;当左边净增质量>右边净增质量时,天半指针向左偏转;当左边净增质量<右边净增质量时,天平指针向有偏转。
6.
化学方程式计算的技巧与方法:(1)
差量法(差值法) 化学反应都必须遵循质量守恒定律,此定律是根据化学方程式进行计算的依据。但有的化学反应在遵循质量守恒定律的州时,会出现固体、液体、气体质量在化学反应前后有所改变的现象,根据该变化的差值与化学方程式中反应物、生成物的质量成正比,可求出化学反应中反应物或生成物的质量,这一方法叫差量法。此法解题的关键是分析物质变化的原因及规律,建立差量与所求量之间的对应关系。如:
①

2KMnO
4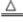
K
2MnO
4+MnO
2+O
2反应后固体质量减小,其差值为生成氧气的质量
②H2+金属氧化物

金属+水,该变化中固体质量减少量为生成水中氧元素的质量(或金属氧化物中氧元素的质量)
③CO+金属氧化物

金属+CO2,该变化中固体质量减少量为气体质量的增加量。
④C+金属氧化物

金属+CO2,反应后固体质量减小,其差值为生成的二氧化碳的质量。
⑤2H2+O2

2H2O,反应后气体质量减小,其减小值为生成水的质量。
⑥金属+酸→盐+H2,该变化中金属质量减小,溶液质量增加,其增加值等于参加反应的金属质量与生成氢气质量的差值。
⑦金属+盐→盐+金属,该变化中金属质量若增加,溶液的质量则减小,否则相反。其差值等于参加反应的金属质量与生成的金属质量的差值。
⑧难溶性碱

金属氧化物+水,该变化中固体质量减小,其差值为生成的水的质量
例:为了测定某些磁铁矿中四氧化三铁的质量,甲、乙两组同学根据磁铁矿与一氧化碳反应的原理,分别利用两种方法测定了磁铁矿中四氧化三铁的质量分数,已知磁铁矿与一氧化碳反应的化学方程式如下:Fe3O4+4CO

3Fe+4CO2
(1)甲组同学取该磁铁矿10g与足量的一氧化碳充分反应,并将产生的气体通入足量的氢氧化钠溶液中,溶液的质量增加了5.5g,请你根据甲组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。
(2)乙组同学取该磁铁矿样品10g与足量的一氧化碳充分反应,测得反应后固体物质的质量为8g,请你根据乙组同学的实验数据,计算出磁铁矿样品中四氧化三铁的质量分数。
解析:(1)甲组同学的实验中被氢氧化钠溶液吸收的是CO还原Fe3O4生成的CO2,由5.5gCO2的质量作为已知条件,根据方程式可计算出Fe3O4的质量
(2)乙组同学的实验中10g样品被CO充分还原后剩余8g固体,减少的质量为Fe3O4中氧元素的质量,利用产生的差量即可求出Fe3O4的质量。也可以根据题中杂质不参加反应来建立等量关系,求出Fe3O4的质量。
答案:(1)Fe3O4+4CO

3Fe+4CO2
232 176
x 5.5g
232/x=176/5.5g
解得x=7.25g
样品中Fe3O4的质量分数为7.25g/10g×100%=72.5%
答:样品中Fe3O4的质量分数为72.5%
(2)设样品中Fe3O4的质量分数为x
Fe3O4+4CO

3Fe+4CO2 △m
232 168 232-168=64
x 10g-8g=2g
232:64=x:2g
x=7.25g
样品中Fe3O4的质量分数为7.25g/10g×100%=72.5%
答:样品中Fe3O4的质量分数为72.5%
(2)
关系式法
关系式法就是根据化学式、化学方程式和溶质质量分数等概念所包含的各种比例关系,找出已知量与未知量之间的比例关系式直接列比例式进行计算的方法。关系式法有如下两种类型. (1)纵向关系式
经过多步的连续反应,即后一反应的反应物为前一反应的生成物,采用“加合”,将多步运算转化为一步计算
(2)横向关系式
①几种不同物质中含相同的量,根据该量将几种不同物质直接联系起来进行运算
②有多个平行的化学反应即多个反应的生成物有一种相同,根据这一相同的生成物,找出有关物质的关系式,依此关系式进行计算可建华运算过程。
关系式法抓住已知量与未知量之间的内在关系,建立关系式,化繁为简,减少计算误差,是化学计算常用方法之一。
例:碳酸氢钠(NaHCO3)俗称小苏打,是一种白色固体,是焙制糕点的发酵粉的主要成分之一,它能与稀硫酸等酸反应生成CO2,试回答:
(1)写出NaHCO3与稀硫酸反应的化学方程式
(2)如何用98%的硫酸(密度为1.84g/mL)配制980g18.4%的硫酸溶液?
(3)现将45gNaHCO3(混有KHCO3)固体粉末加入100mL稀硫酸,恰好完全反应后是气体全部逸出,固体粉末的质量与产生CO2的体积的关系如图(该状况下,CO2的密度为2g/L)所示,计算:

①求100mL稀硫酸中硫酸的质量
②若稀硫酸为120mL时,加入固体粉末为58.5g,求产生CO2的体积。
解析:
(1)书写化学方程式时注意化学方程式的配平和“↑”的书写
(2)设配制980g18.4%的硫酸溶液需98%的硫酸(密度为t.84g/mL)的体积为x,则: x×1.84g/ml×98%=980g×18.4%,x=100mL,需水的质量为:980g-100ml×1.84g/mL=796g;配制过程中应注意一定要把浓硫酸沿烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌
(3)由图像可以看出,45g固体粉爪与100ml稀硫酸恰好完全反应生成CO211L, 11LCO2的质量为l1L×2g/L=22g,根据CO2的质量可计算出100mL稀硫酸中硫酸的质量:由100mL 稀硫酸能与45g固体粉末完全反应,可计算出120mL 稀硫酸能与54g固体粉未完全反应,而加入的固体粉末为58.5g,则固体粉末有剩余,稀硫酸完全反应生成CO2气体11L,则120mL稀硫酸与54g固体粉末完全反应生成二氧化碳的体积为:
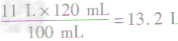
答案:(1)2NaHCO3+H2SO4==Na2SO4+2CO2↑+2H2O
(2)将100ml98%的H2SO4沿着烧杯内壁慢慢倒入796ml水中,同时用玻璃棒不断搅拌。
(3)解:①45g固体完全反应时生成CO2的质量m(CO2)=11L×2g/L=22g
设硫酸溶液中H2SO4的质量为x
由(1)得H2SO4——2CO2
98 88
x 22g
x=(98×22g)/88=24.5g
②设与120mL稀H2SO4完全反应的固体粉末的质量为y
100mL/120mL=45g/y
y=54g<58.5g
所以固体粉末过量,以硫酸的量进行计算:
V(CO2)=(11L×120mL)/100mL=13.2L
答:100mL稀硫酸中硫酸的质量为24.5g,产生的CO2的体积为13.2L。
(3)
平均值法
混合物中确定各组分的有关计算是初中化学计算中难度较大的一种题型.如混合物中各组分均能与某一物质反应且得到的产物中有同一种物质或混合物中各组成成分均含有同一种元素,要确定其成分的有天计算可用平均值法求解。解答此类题的关键是要先找出混合物中各成分的平均值(如平均二价相对原子质节、平均相对分子质量、平均质量、平均质量分数等),此平均值总是介于组分中对应值的最大值与最小值之间。利用这些平均值解题的方法叫做平均值法。下面分类进行讨论:
(1)平均二价相对原子质量法
由金属单质组成的混合物,要判断混合物的组成或计算某一成分的质量,利用平均二价相对原子质量法计算较为快捷、准确。解题时先设该混合物为一种纯净的二价金属,利用化学方程式或其他方法求出平均二价相对原子质量,混合物各组分中一种金属的二价相对原子质量小于半均二价相对原子质量,则另一种金属的二价相对原子质量必须大于平均二价相对原子子质量,据此求出正确答案。
二价相对原子质量=

×2
如:Na的二价相对原子质量=
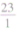
×2=46
Mg的二价相对原子质量=

×2=24
Al的二价相对原子质量=
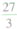
×2=18
设一种二价金属R的质量为m,其二价相对原子质量为M,与足量稀硫酸反应产生H2的质量为x
R+H
2SO
4==RSO
4+H
2↑
M 2
m x
解得:x=m/M×2
即金属与足量稀硫酸反应,生成H2的质量与该金属质量成正比,与该金属二价相对原子质量成反比,若像Cu等金属与稀硫酸不反应,即产生的H2的质量为零。
注意:①二价相对原子质量和相对原子质量有本质区别,前者为一假设值。
②Cu、Ag等不与稀硫酸或稀盐酸发生置换反应的金属产生H
2质量为0。
⑧金属与足量稀硫酸或稀盐酸反应产生氢气的质量为:

④制取一定量的氢气需要金属的质量为:
 例:
例:小明同学用6.5g不纯的锌与足量稀盐酸完全反应,收集到H2的质量为0.205g,已知其中含有另一种金属杂质,这种金属杂质不可能是()
A.铁B.铝C.铜D.镁
解析:由题意可知,两种金属混合物6.5g与足量的稀盐酸反应生成了0.205g氢气,则混合物的二价相对原子质量为(6.5/0.205)×2=63.4,。已知Zn、Fe、Al、Cu、Mg五种金属的二价相对原子质量分别为65,56,18,∞(无穷大),24,混合物中含有Zn,则另一种金属的二价相对原子质量不能大于63.4,所以这种金属杂质不可能是Cu。
(2)相对分子质量平均值法
由化合物组成的混合物,要判断混合物中各物质是否存在或计算某成分的质量,可用相对分子质量平均值法解题。解题时根据化学方程式和其他方法求出平均相对分子质量,混合物中一种物质的相对分子质量如果大于平均相对分子质量,则另一种物质的相对分子质量必小于平均相对分子质量,据此可求出正确答案。
(3)质量平均值法
利用混合物中平均质量解题方法。
(4)质量分数平均值法
混合物中某元素的质量分数总是介于混合物中一种成分该元素的质量分数与另一种成分中该元素的质量分数之间,据此可确定混合物的组成。
4.
守恒法化学变化中等量关系的简历,有一条很重要的定律——质量守恒定律,即参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。在实际应用中,上述定律演绎为:a化学反应前后,物质发生变化生成新物质,但组成物质的元素种类不变,质量不变;b化学反应前后,分子本身发生变化,而分子的数目虽然有的改变,但原子的种类,数目不变。该定律反映出化学反应中的一些等量关系,是解化学试题的思路之一。利用化学反应前后某些量之间的等量关系,推理得出正确答案的方法称为守恒法。仔细挖题目中隐含的等量关系是守恒法解题的关键。下面分类进行讨论:
(1)质量守恒法
①发宁前后反应物与生成物质量守恒
②溶液混合或稀释前后,溶质总质量守恒
③化学反应中某些元素的质量守恒
(2)电荷守恒法
溶液中阴、阳离子个数不一定相等,但正负电荷总数相等。
(3)比例守恒法
利用试题中潜在的某些量之间的比例恒定不变的原理来解题的一种方法。
例:某二价金属M的氧化物10g与90g稀硫酸恰好完全反应后,形成无色透明溶液,测得反应后溶液中溶质的质量分数为30%,请计算(结果保留一位小数):
(1)该金属M的相对原子质量和上述新硫酸中溶质的质量分数
(2)反应后溶液中氢元素与氧元素的质量比
解题:(1)由质量守恒定律可知,反应后溶液中溶质质量为100g×30%=30g
设金属M的相对原子质量为
M,稀硫酸中H2SO4的质量为x
MO + H2SO4== MSO4 + H2O
M+16 98 M+96
10g x 30g
(
M+16):(
M+96)=10g:30g
解得
M=24,可知
M为镁元素
98:40=x:10g
x=24.5g
硫酸溶液中溶质的质量分数为:24.5g/90g×100%=27.2%
(2)反应后溶液中MgSO4的质量为30g,则水的质量为70g,氢元素的质量即水中氢元素的质量,氧元素的质量是水与硫酸镁中氧元素的质量和
氢元素与氧元素的质量比为:
(70g×

):(70g×

+30g×
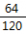
)=35:352
5.
假设量法
在所给题目中缺少实例,无数据,仅有字母或仅有比值,在解答该类题设未知数之前,先假设一个题目中缺少的关键量为假设量,即一个已知量,补充解题的条件。然后,此假设量可参与整个化学计算,使计算过程简单,清晰。但该假设的已知量只帮助解题,不会影响最终结果,这种解题方法叫假设量法。具体有两种类型:
假设用具体的物质代替题目中抽象或不定的物质来解题。
②假设一具体数据代替题目中未知数据来解题。
a. 题目中给出化学反应前后某两种物质的等量关系(已知条件),求混合物中各组分间的质量比—找等量设为假设量。
b. 题目中给出某种物质的质量分数(已知条件),求另一种物质的质量分数—找条件中给出的质量分数所对应的物质质量为假设量
例:已知完全中和一定量的某盐酸,需100g80%的氢氧化钾溶液,若改用100g80%的氢氧化钠溶液,则反应后溶液的pH()
A.大于7B.小于7C.等于7D.无法确定
解析:设题目中盐酸溶液中溶质的质量为36.5g,需要NaOH、KOH的质量分别为x和y
NaOH+HCl==NaCl+H2O
40 36.5
x 36.5g
40/x=36.5/36.5g
x=40g
KOH+HCl==KCl+H2O
56 36.5
y 36.5
y=56g
若用含56gNaOH的溶液与含36.5gHCl的盐酸反应,则NaOH过量,溶液pH>7,选A。
6.
比较法
解题时对题目给定的已知条件或数据,结合有关知识进行全面,仔细地分析,比较,然后确定正确答案。此法解计算型选择题时可避免对各备选答案一一进行计算。运用该法解题时有如下情况:
(1)分类比较:按被选择对象的某些特点,先分类后比较选择
(2)计算比较:解题时先做简单计算,然后比较化学式,相对分子质量或分子中某一相同原子的个数,最后选择。
(3)转化问题比较:解题之前将所求问题转化为直观问题来比较选择答案。
(4)排列比较:将被选择答案按某种顺序排列后,再分析比较选择答案。
例:铅蓄电池中需要一定质量分数的硫酸溶液,现将50%的硫酸溶液(密度为d1g/ml)与10%的硫酸溶液(密度为d2g/ml)按体积比1:1混合,已知d1>d2,所得溶液的质量分数()
A.大于30%B.等于30%C.等于60%D.小于30%
解析:当两种同溶质的溶液混合时,以m1g a%的溶液和m2g b%的溶液混合为例,且a>b。
当m1>m2时,混合后溶质质量分数大于(a%+b%)/2
当m1=m2时,混合后溶质质量分数=(a%+b%)/2
当m1<m2时,混合后溶质质量分数<(a%+b%)/2
从题意分析知,由d1>d2,则等体积的两种溶液,50%的H2SO4溶液质量大,则混合后溶质质量分数>(50%+10%)/2=30%
要明确解题思路解题时的一般思路:(1)先找出题中涉及的化学反应,并正确书写化学方程式。
(2)找出题中所提供的数据与化学方程式中各物质的直接或间接关系。
(3)确定哪些数据能直接代入化学方程式。如果所给数据与化学方程式中各物质的关系仅仅是间接关系,那必须分析清楚该数据是通过什么“中介”与各物质产生联系的,然后再列出相应的比例式。
根据化学方程式计算的步骤具体的计算步骤如下:(1)设未知量,求什么设什么。
(2)正确完整地写出相应的化学方程式。
(3)根据化学方程式写出各物质的相对分子(或原子)质量总和,标在相应的化学式下面。把题中的已知条件和待求未知址写在相应物质的相对分子(或原子) 质量总和的下面。
(4)列比例式。
(5)求解。
(6)简明地写出答案。
应注意的问题:
(1)解题时首先要认真审题、理清思路、确定解题方法、严格按解题步骤求解。
(2)化学方程式所表示的反应物、生成物的质量关系是进行化学计算的基础,在化学方程式中各物质的化学式一定要书写正确,一定要配平化学方程式或关系式中某元素原子的数目一定要相等,相对分子质量的计算一定要准确。
(3)化学方程式所表明的各物质均指纯净物,参加计算的各物质的质量也必须是纯净物的质量。如果求纯净物的质量需进行换算,换算方法:纯净物的质量= 物质总质量×该物质的质量分数(即纯度)。
(4)对题目中所给的“适最”“足量”“过量”“恰好反应”“完全反应”“充分反应”等词语,要认真对待,正确理解一般来说:“适量”—两种(或多种)反应物之间按一定量比恰好反应。 “足量”—一种反应物完全反应,无剩余;另一种反应物可能完全反应,也可能过量。 “过量”—完全反应后,有一种(或多种)反应物剩余。 “恰好反应”和“完全反应”—完全反应,反应物无剩余。 “充分反应”和“反应完全”—同“足量"。
(5)用化学方程式计算时解题格式要规范。
利用化学方程式计算的几种类型:(1)已知某反应物或生成物的质量,求另一种反应物或生成物的质量。
(2)有关含杂质的物质质量间的计算。
(3)根据化学方程式进行计算的含有体积、密度与质量间换算的有关计算。
(4)关于过量问题的计算。
(5)多步反应的计算。
(6)其他类型的计算。
计算时常见的错误:(1)不认真审题,答非所问;
(2)元素符号或化学式写错;
(3)化学方程式没有配平;
(4)相对分子质量计算错误;
(5)没有统一单位;
(6)把不纯物质当成纯净物质计算。
化学方程式计算中的几个误区:
(1)化学方程式不正确就计算,这是最严重的问题。
(2)把含杂质的质量直接应用在化学方程式计算中,或把体积直接代入化学方程式。
(4)解题格式不规范,设的未知缺与求的量不同,相对分子质量计算错误,
(5)计算不准确,不按题目要求写化学方程式(方程式应用不当)。
(6)体积、质量、密度之间的关系问题及单位问题弄错等。
化学方程式计算中的“三个三”:
在解题时要把握好“三个要领”、抓住“三个关键”、注意“三个事项”,即:
三个要领:(1)步骤要完整;(2)格式要规范; (3)结果要准确。
三个关键:(1)准确书写化学式;(2)化学方程式要配平;(3)计算质量比要准确。
三个事项:(1)单位统一;(2)用纯量进行计算; (3)若是体积要换算成质量。考点名称:氧气的制取和收集氧气的制取是初中化学的重点,也是历年中考的热点。我们不仅要学好氧气制取的知识,而且要触类旁通,逐步掌握实验室制取气体的一般思路和方法。中考对制取氧气的考查主要集中在药品选用、实验装置、操作步骤等方面。
实验室制取收集氧气:
| 过氧化氢制氧气 | 高锰酸钾制氧气 |
| 药品和反应原理 | 2H2O2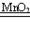 2H2O+O2↑ 2H2O+O2↑ | 2KMnO4 K2MnO4+ MnO2+ O2↑ K2MnO4+ MnO2+ O2↑ |
| 发生装置 | 固液常温型
 | 固体加热型
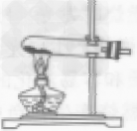 |
| 收集装置 | 氧气可用排水法收集,也可用向上排空气法收集
 |
| 整体装置图 |  | 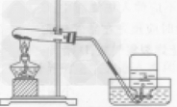 |
| 操作步骤 | ①检查装置气密性
②再锥形瓶中装入二氧化锰
③塞好带有长颈漏斗和导管的橡皮塞(长颈漏斗的下端一定在液面以下,否则氧气会从长颈漏斗中跑出来)
④向长颈漏斗中加入过氧化氢溶液
⑤收集氧气
| ①检查装置气密性
②将药品平铺在试管底部,用带导管的单孔橡皮塞塞紧试管口(用高锰酸钾制取氧气,还要在管口放一小团棉花)
③将试管固定在铁架台上
④点燃酒精灯,预热后加热试管
⑤当导管口有连续均匀的气泡冒出时开始收集气体
⑥收集完毕,先将导管移出水面
⑦熄灭酒精灯。加热高锰酸钾(或氯酸钾和二氧化锰的混合物)制氧气,用排水法收集,其操作步骤可概括为:“查”“装”“定”“点”“收”“离”“熄”7个字。可用谐音记忆为“茶庄定点收利息”。 |
| 注意事项 | ①伸入试管或锥形瓶中的导管应刚刚露出橡皮塞即可,否则不利于气体的导出。
②用排水法收集氧气时,导管应刚伸人集气瓶口即可,过长不利于水的排出,气体不易收集满。
③用向上排空气法收集氧气时,导管要伸入集气瓶的底部,否则不利于空气的排出,收集的气体不纯。
④用长颈漏斗时,长颈漏斗末端应在液面以下,否则氧气会从长颈漏斗中逸出。 | ①药品要平铺在试管底部,均匀受热。
②试管口要略向下倾斜,防止药品中湿存的水分受热后变成水蒸气,遇冷凝结成水倒流回试管底部,使试管炸裂。
③铁架台的铁夹要夹在试管的中上部(或距离试管口1/3处)。
④试管内的导管稍伸出橡皮塞即可,这样便于气体导出。
⑤集气瓶充满水后倒放入水槽中(瓶口要在水面下)。
⑥加热时要先使试管均匀受热,然后酒精灯外焰要对准药品所在部位加热。
⑦用排水法收集气体时,应注意当气泡连续均匀冒出时再收集,否则收集的气体中混有空气,当集气瓶口有大盆气泡冒出时,证明已集满。
⑧停止加热时,应先把导管从水里撤出,再撤掉酒精灯。如果先熄灭酒精灯,试管内气体温度降低,压强减小,水槽中的水就会被倒吸入热的试管内,使试管炸裂。
⑨用高锰酸钾制氧气时,试管口要放一小团棉花,防止加热时高锰酸钾小颗粒进人导管。
⑩盛氧气的集气瓶应盖上玻璃片正放,因为在相同状况下氧气的密度大于空气的密度,正放可减少气体的逸散。 |
三 : 漫思茶,2(新实验文体:诗——散文)

<擂茶,1992年于湖南乡下>
-
苦人茶
又苦又咸
三“擂”而成,一饮而尽
*( 文章阅读网:www.61k.com )
*
<长江北岸,姊归一带的茶>
-
“无风难破浪,失计长江边”(李白)
李太白飘飘,当年就饮过这样的茶
在这里稍事停留
走向东国
*
*
<“狗古脑“茶,曾于井冈山的乡间买过>
-
喝过“狗古脑”
余茶不香
名土,茶洋
-
罗霄山 , 千山绵
*
*
<四川“八宝茶”,几米外以滚水注之>
-
惊
心
一
泻
-
一川天水
巴蜀火色
*
*
< 在滇南红河州五里冲茶场>
-
车过云山雾缭
新安所古镇
水库粼粼,林木丰茂
就到五里冲茶场
品茗,看野茶花
思索明天人们将喝的“生态茶”
*
*
<在甘肃酒泉旅社,怀“酒泉”地名来历>
——这是朝廷皇帝赏赐的几坛美酒
岂能将军我一人独饮,
传我大将军的命令:“统统倒入泉水里”
——泉水边,站立着浩浩西征大军
-
将军手一挥——
“弟兄们,饮酒!”
*
*
<北方、东北方的“花茶”>
-
茶过黄河
要加茉莉
越过辽水
再添一把
*
*
<北京国贸的一壶“商茶”>
-
待客的那位朋友
忘记带卡,搜遍全身
加上我兜里的几百元
还不够一壶昂贵的茶钱
只好叫司机
回去取
*
*
<知青寒冷的吉林丘陵地带,乡亲待我的茶>
-
大娘烧一把火
把早晨熬的小米汤烧开,热腾腾
端一碗
-
谁说茶叶只能是树叶?
“冷水烧成热水”(旧时乡间待客亲切语),就是茶
*
*
<桦汁茶>
-
早春
大兴安岭
割开白桦树的枝干
一滴,一滴……
-
举世清绝——
*
*
<往古,草原晨起牧人的奶茶>
-
男人们喝一口
拉一阵马头琴
再喝,再拉一阵马头琴
然后伊始
辽阔和勇毅的一天——
*
*
<70年代初,旅客喜欢在列车上喝一种“橘皮茶”>
-
名陈皮。
冬食橘
清香消食,去火解躁
——那时,“污染“一词还没诞生
*
*
<1994年在辽南金州,见村民用槐花制茶>
-
槐花可酿蜜,制药,晒干入茶
备于严冬
-
其味幽
其香袅
*
*
<“潮州功夫茶”>
别看
小小一盅
-
醍醐
灌顶
*
*
<内蒙与青海的茶砖(茯茶)>
-
以茶制砖
起源长城
充满想象——
-
茯,(音伏)
北去阴山,西迤祁连
*
*
<泡>
-
人间理不清的万千头绪
在饮茶时都可以
慢 慢 理 清
*
*
<一撮黄山脚下辛苦乡民的青炒茶>
-
(味道)像普通的夏日里,北方
镰刀割下的青草沫子
又苦 ,又甘 , 又涩
令人不忍尝
*
*
<古“阳羡茶”:产于江苏宜兴>
-
“天子不尝阳羡茶
百草不敢先开花”
-
中国茶中之“周天子”
“冲天香阵透长安”——
*
*
<碧螺春:产于太湖>
-
中国的仙女茶
茶之阴
茶之美、茶之柔
*
*
<铁观音:产于福建安溪>
-
老君炉里
蒸煮
-
喝过铁观音
渐入老境
世间余味,淡矣……
*
*
<秦岭北麓“无名茶”>
-
酒一样冽
老子一样老
秋天 , 秋茶
深远 , 弥漫
*
*
<于首都的前门茶店赏台湾“冻顶”>
-
从未喝过
“冻顶茶”
因此还可存翩翩想象——
-
遗憾之美
冻顶之冻
*
*
<中国茶>
-
死后
无论是去天堂
还是去地府
我的第一件“要事”都将是——
快泡茶
-
-
(2010年 京郊)
四 : 漫思茶,1(新实验文体:诗——散文)

<茶>
-
一生的时光都快过去了
而我们却只在埋头吃茶
*
*( 文章阅读网:www.61k.com )
<五十岁读陆羽《茶经》>
-
天下不足论
茶足论
*
*
<替东坡问茶>
-
“江山如画”,一时多少
茶客
*
*
<梦想中与竹林七贤对饮>
-
刘伶死后
茶最高
*
*
<多年前游老三峡,船中吃一尾江鲤>
-
船过三峡,
中国深矣;
饮过巫山,
中国远矣(对故国美境三峡之永远怀念)
*
*
<遥想清代旧京的古雅生活>
-
“小楼一夜听春雨”
明朝京巷购新茶
*
*
<饮茶时读南朝刘勰《文心雕龙》>
-
悄然凝思
思接千里
此中意深
痴然忘啜
*
*
<老北京大碗茶>
-
属于苦力们车夫们的茶
碗要大,汤要热
一碗绝不能超过一文钱
-
吃饱, 喝足
还要赶路
*
*
<重读《三国》>
-
白发渔樵说,
“给我一壶茶,
我还给你一个乾坤“
*
*
<某年,路过潇湘之洞庭湖君山>
-
“一旗一枪
茶最清“
-
叠叠梯田
畦畦茶园
*
*
<友人送我黔南野茶>
-
采自
峭崖
-
桀骜不驯的
几株灵魂
*
*
<家酿酒,家炒茶>
-
天下有多少种个性
就有多少种
炒青
*
*
<1985年逛成都郊区旧茶馆>
-
老伴给的两个角子
也能喝一个上午
再配点瓜子
-
——美茶成都堪送老
*
*
<广州郊黄埔军校,镇上吃米饭青菜,“茶味”免费,遥想_>
-
兵分黄埔
风起天涯
龙战玄黄
血染长沙
*
*
<1987年,在广州餐馆吃“早茶“>
-
宾馆里的一客茶费15元——
而门外大排挡的早餐阳春面只要每位3元——
外带“免费”茶味
-
老广粤, 新广粤
*
*
<旧时北京庭院,盛夏>
-
一壶,几盏
窗明 ,院净
寂然,蝉鸣
*
*
<浙江金华“土茶”>
-
天下只有苏、浙二省的茶
最为和风细雨
-
只有家乡阿婆亲手炒制的茶
最为家常
*
*
- <源>
-
道、茶、中医
古中国气味的“三位一体”
*
*
<明前茶>
-
茶近清明
细细雨
*
*
<秋茶>
-
茶至老秋
人生况味
一梗三叶,苦而香
*
*
<1994年,兰州黄河铁桥边西北“三泡茶”>
-
“第一泡苦如人生
第二泡甜如爱情
第三泡淡若清风“——
-
所以第三杯
要慢慢饮
虔敬,凝神
-
-
(2010年 京郊)
五 : 迷路的体验
她们走在上山的道路上。这条小路是不知多少人踩过以后形成的,很细,又带有一些石子,所以还有些滑。从远处看,这就象一队蚂蚁行走在小路上。两旁的树林奇密,在那里似乎如同冰冷的囚房,潮湿且阴冷,没有多少阳光和温暖能被树叶筛下。整座山只有这条路和几条另外的岔道,无处见光。
十三四岁的她们在好奇心的驱使下,做好了远足的准备。
她们说说笑笑,面目闲适地向山顶走去。她们享受着鸟儿们的欢迎曲,落叶的悲沧曲,阳光的激荡曲,树木的蓬勃曲,所以,到山顶时,她们也忍不住放歌起来,声音打成一片。但处于这种陶醉之中的她们,在归途中依旧感受着大自然的美,个个和颜悦色,如同这山中一群灿烂的花朵,笑容始终挂在脸上。
但是,这迷人的笑随着最后一缕阳光沉入了地平线,取而代之的是寒冷的月光带来的恐惧感。原来,她们处在黑夜的笼罩下,迷路了。
远处传来乌鸦嘶哑的叫声,令人毛骨悚然。森林里,敏感的女孩们似乎总感到野兽阴冷的目光在周围徘徊,空中月轮微弱的光亮使原本就可怖的森林又多了一层神秘色彩。山泉好象也在莫名地嘲笑她们的冒失。这些,使她们无法入睡又不敢生火取暖。
早晨的阳光渐渐爬上她们憔悴的脸上,给即将崩溃的女孩儿一丝希望。
果然,一个女孩坚定又带有些惊喜地说:“大家跟着我走,沿着山泉,可以到小溪,再汇入江河,我们就可以到家了。”
大家狐疑地看着她,从她坚定的眼神里了解到:这似乎是唯一的办法。为了生命,必须这样了。
寻找山泉的路并不累。根据声音找得很快。接着,她们开始了新的旅程。
她们匆匆地前进,根本无暇关注身旁的美景:流水带走的落花、落叶,清澈如镜的山泉,夕阳西下时的灿烂——对家的渴望异常激烈。
终于,这支队伍在行进一天后,在傍晚,看见了缕缕炊烟,听见人家的声音——她们到家了。
后来,她们才知道,那个女孩说的生存本领是因为她多次进山而不知不觉中形成的。
她们感叹:这何尝不是一种人生的体验呢!
本文标题:
实验室制取和收集气体的思路-用金鱼藻作实验材料进行如图所示的实验,该实验收集到的气体主要是( ) 本文地址:
http://www.61k.com/1073316.html  A. 空气
A. 空气 2MgO,其中各物质的质量之比为,m(Mg):m (O2):n(MgO)=48:32:80=3:2:5。
2MgO,其中各物质的质量之比为,m(Mg):m (O2):n(MgO)=48:32:80=3:2:5。 
 ×100%=
×100%= ×100%=1-杂质的质量分数
×100%=1-杂质的质量分数

 K2MnO4+MnO2+O2
K2MnO4+MnO2+O2 金属+水,该变化中固体质量减少量为生成水中氧元素的质量(或金属氧化物中氧元素的质量)
金属+水,该变化中固体质量减少量为生成水中氧元素的质量(或金属氧化物中氧元素的质量) 金属+CO2,该变化中固体质量减少量为气体质量的增加量。
金属+CO2,该变化中固体质量减少量为气体质量的增加量。 金属+CO2,反应后固体质量减小,其差值为生成的二氧化碳的质量。
金属+CO2,反应后固体质量减小,其差值为生成的二氧化碳的质量。 2H2O,反应后气体质量减小,其减小值为生成水的质量。
2H2O,反应后气体质量减小,其减小值为生成水的质量。 金属氧化物+水,该变化中固体质量减小,其差值为生成的水的质量
金属氧化物+水,该变化中固体质量减小,其差值为生成的水的质量 3Fe+4CO2
3Fe+4CO2 3Fe+4CO2
3Fe+4CO2 3Fe+4CO2 △m
3Fe+4CO2 △m
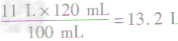
 ×2
×2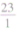 ×2=46
×2=46 ×2=24
×2=24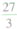 ×2=18
×2=18

 ):(70g×
):(70g× +30g×
+30g×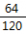 )=35:352
)=35:352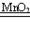 2H2O+O2↑
2H2O+O2↑ K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑





