新浪科技讯10月7日晚间消息,2019年度的诺贝尔生理学或医学奖已经宣布,今年的奖项授予两位美国科学家和一位英国科学家:授予威廉·凯林(William G.Kaelin),彼得·拉特克利夫爵士(Sir Peter J.Ratcliffe)以及格雷格·萨门扎(Gregg L.Semenza),以表彰他们在“生物在分子层面上如何感知氧气”方面所作出的开创性贡献。
细胞是如何感知氧气的?
自从现代生物学的伊始,人们就知道生命的维持需要氧气,但是生物细胞是如何做出调整以适应不同的氧气供应环境的?其背后的分子机制究竟是什么?这两个问题却一直未能被很好的理解,直到今年的几位诺贝尔奖获奖人所做的工作阐明了这一机制。
当周围的氧气水平发生变化时,动物细胞会经历基因表达上的明显改变。这种基因表达上的改变会同时改变细胞新陈代谢,组织重塑,甚至组织反应,比如心率加速,或者呼吸量的改变。
在1990年代早期的研究中,格雷格·萨门扎最早识别,并于此后在1995年最终提纯并克隆了一种转录因子,其对这些与氧气密切相关的反应机制起到调节作用。他将这一因子命名为HIF,即“缺氧诱导因子”,并确认其包含两个部分:一种是全新发现的,对氧气敏感的HIF-1a,另一种是此前就已经被发现的,固有性表达,并且并不受氧气调节的蛋白质“ARNT”。1995年,威廉·凯林正在从事冯·希佩尔-林道肿瘤抑制基因的研究并成功实现了对该基因的全序列分离与克隆,他发现,这种基因可以抑制VHL突变致癌细胞系中的肿瘤生长。
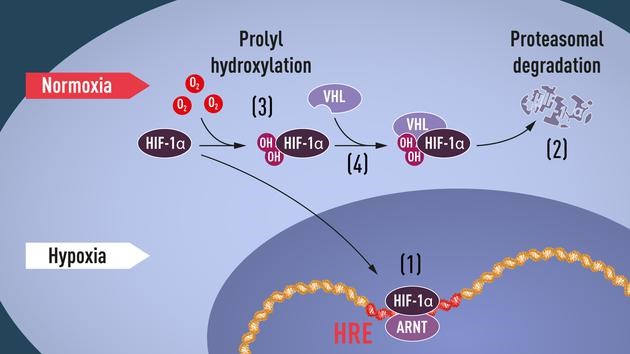
随后,在1999年,彼得·拉特克利夫证明了,VHL与HIF1a之间存在某种关联,并发现VHL可以调节HIF-1a的翻译后及氧敏降解。最后,凯林和拉特克利夫的研究团队同时证明了这种VHL对于HIF-1a的调节机制会受到HIF-1a羟基化的影响,这是一种共价修饰,其本身将受到氧气水平高低的影响。
由于以上这三位获奖人的工作,证明了由于氧气水平改变引发的基因表达反应,与动物细胞内的氧气水平之间存在直接耦合关系,从而允许透过HIF转录因子的作用,实现对于氧化反应的快速细胞层面响应。
氧气与动物生命
在1770年代,瑞典科学家卡尔·舍勒(Carl Scheele)通过计算得到结论,空气中大约有1/4的体积是所谓的“feuer luft”,即他所称的“火气”,也就是可以支持物体发生燃烧的气体。这一发现的相关论文最终于1777年公开发表(Scheele,1777)。大约与此同时,在英国,约瑟夫·普里斯特利(Joseph Priestley)也发现了一种方法来提纯这种此前未知的气体,并将其称之为“去燃素空气”(Priestley,1775)。而除了舍勒和普里斯特利之外,大致同一时间,法国化学家安托万·拉瓦锡(Antoine Lavoisier)也在巴黎进行了对这种气体的分离试验,并且也对其进行了自己的命名。而这个命名也正是这种气体在今天被广为接受的名称:氧气(Lavoisier,1777)。
动物生命离不开氧气,因为我们的身体需要借助氧化反应驱动将营养物质转化为ATP。事实上,根据可获得的氧气数量来调节细胞活动,正是新陈代谢调节的关键内容之一。早在一个多世纪之前我们就已经明白这个道理,比如在1858年,法国微生物学家路易斯·巴斯德(Louis Pasteur)最先证明在动物细胞内存在复杂的氧气使用平衡,并证明细胞会透过多条复杂路径来完成能量转换(Pasteur,1858)。
而关于动物体内对氧气的感知机制,此前已经获得过两次诺贝尔奖,一次是1931年授予德国生理学家奥拓·沃伯格(Otto Warburg),其成就是发现了细胞呼吸的酶基础,第二次是1938年授予比利时医学家柯奈尔‧海门斯(Corneille Heymans),奖励其在神经系统在机体对氧气的呼吸反应中所发挥的作用方面进行的研究。然而,在整个20世纪的大部分时间里,我们仍然不清楚,对于氧气水平变化的调节机制,是如何在基因表达的基础水平上得到调节的。
对不同氧气水平的适应
对于绝大部分动物体内的细胞而言,能够对氧气水平的变化做出快速相应是非常关键的。分子分类学已经清楚表明,在生物演化过程中,随着动物细胞开始聚集到一起,组成多细胞的三维结构体生命开始,这种对于氧气水平的响应能力便不再仅仅是一种细胞层面的,用作调节单个细胞内部新陈代谢水平的反应,而且还发展出了一套复杂的生理反应机制。细胞需要作出许多自动反应,以对变化的氧气供应水平作出反应,其中尤为重要的是对自身的新陈代谢水平进行调节。
当在组织和器官层面观察这种反应时,我们发现多细胞组织不仅需要重塑自身组织以适应变化后的氧气环境(比如在受伤之后重构血管系统),还需要调动整个组织以补偿氧化水平的变化(比如剧烈运动后,或者暴露于高海拔地区时,人的呼吸会变得急促)。
作为一个案例:生活在高海拔地区的人们,其体内的氧气水平变化是由其肾脏内的一种特殊细胞负责感知的,其可以分泌并释放一类名为“红细胞生成素”(EPO)的荷尔蒙。这种荷尔蒙会激活骨髓中的血红细胞合成。促发这一反应的一种方式是暴露于高海拔地区的低氧环境下,在这样的环境中,肾脏的EPO生成速度将加速,从而导致血液内红细胞含量升高,从而帮助我们的身体更好适应高海拔地区的低氧环境。
动物可以暴露于低氧环境,但有一点很重要,氧气水平在身体组织内部也会出现起伏波动。动物机体组织内部的氧气水平会出现空间和时间上的变化,而这种变化在正常生理事件中也会频繁发生,比如运动过后骨骼肌的缺氧,但也会在病理过程中出现,比如癌症和感染。而通过上世纪1970~1980年代期间的相关工作,事情逐渐变得明朗:这些局部和暂时性的氧气水平改变会通过基因表达的形式,激发细胞和组织层面的关键性适应反应。
这些基因调节反应将会改变细胞新陈代谢,并控制基础性发育,再生和机体防御机制,包括血管形成,发炎等。
动物细胞感知不同氧气水平的能力,以及随之改变自身基因表达的机制,对于机体的生存至关重要。这种氧气驱动的信号通路至少影响着300个不同的基因,它们分属于多个不同的机体调节系统。
这些分子水平上的通路广泛参与多种生理过程,从器官发育到代谢平衡再到组织再生和免疫功能,并在许多疾病的进展中起到关键性作用,其中包括癌症。
氧气与红细胞生成
生物体内的任何关键性信号通路,几乎肯定会与不同层面上的大量其他分子通路之间存在相互关联。氧气响应通路也不例外。因此,正如预料的那样,今年获得诺贝尔生理学或医学奖的这些基础性工作,并未终结在分子层面氧气响应机制方面的研究,与此相反,这些关键性发现开启了一个崭新领域,激发大量研究人员投入其中,取得大量研究成果,揭示出分子层面对氧气响应机制的极度复杂性。
今年的三位获奖人:威廉·凯林,彼得·拉特克利夫以及格雷格·萨门扎所取得的基础性发现,都是围绕缺氧诱导因子(HIF)的作用所展开的。这一因子的发现,最早需要追溯到在1986年至1987年间多位研究人员所做的工作,其中包括莫里斯·邦杜伦特(Maurice Bondurant),马克·克里(Mark Koury)以及贾米·卡罗(Jaime Caro)等;他们的工作表明低氧环境会促发肾脏内红细胞生成素(EPO)荷尔蒙的转录表达(Bondurant and Koury,1986;Jelkmann and Hellwig-Burgel,2001;Schuster et al。,1987)
这项发现反过来,植根于1882年开展的相关实验,以及法国生理学家保罗·博特(Paul Bert)的相关工作(Bert,1878),他在1878年最先证明了低氧环境对于心血管产生的效应,也是首位发现暴露于高海拔环境下,会导致生物体内红细胞数量增加的科学家(Bert,1882)。
HIF的分离
在发现EPO基因表现出缺氧诱导的转录反应之后,下一步就是确定EPO基因调控区域中负责氧敏感性的DNA序列。萨门扎决定在转基因小鼠身上追踪EPO基因的转录调控因子,他使用的是包含人类EPO基因的不同大小的DNA片段克隆。萨门扎和同事们首先阐明了一个覆盖了EPO编码序列的区域,包含了4000个碱基,以及一些小的5‘和3’侧翼序列,这些序列会导致所有被分析的转基因组织产生EPO,并导致循环的EPO水平升高,从而产生红血球增多症,即红细胞的计数增加。接下来,萨门扎证明了一个更长的EPO基因结构,包含6000个碱基的5’侧翼DNA序列,能够在肾脏中诱导EPO表达。这项工作指向了一个EPO对氧反应的转录调控复合体,包括正调控和负调控因子。
一年后的1991年,萨门扎在另两项研究中,增加了调节EPO基因的重要信息:1)一项脱氧核糖核酸酶(DNAse)过敏症研究发现,EPO 3‘侧翼DNA的一小块区域结合了几个核因子,其中至少有两个因子是由肝脏和肾脏贫血诱导的;这个小区域能够作为缺氧诱导的增强子,在体外瞬时表达测定中发挥作用;2)进一步研究了EPO在转基因模型中的转录调控。大约在同一时间,彼得·拉特克利夫爵士和贾米·卡罗实验室报告称,EPO基因中存在一个具有顺式作用的DNA 3’元件,在转染到体外培养的肝癌细胞中,该元件赋予了报告基因对氧的响应性。
上述工作使萨门扎于1992年在EPO基因的3‘端发现了约50个碱基对的增强子,可用于诱导缺氧诱导型报告基因在培养细胞中的表达。这种增强子被萨门扎称为缺氧反应元件(HRE),它结合了肝癌细胞中的几个核因子:一个是本身结构,另一个是缺氧诱导的。后者因此被萨门扎称为低氧诱导因子(HIF)。
拉特克利夫和萨门扎都证明,EPO基因的3’增强子可以在多种哺乳动物细胞类型中驱动缺氧诱导型报告基因表达。这表明,参与EPO基因氧调节的分子机制在多种动物细胞中都很活跃的,HIF因此也很可能是常见的氧感知细胞机制的一部分。
低氧诱导HIF可以在多种哺乳动物细胞中观察到,不仅仅是肾脏和肝脏中产生EPO的细胞。这一观点引起了更广泛的科学家群体的兴趣和关注。HIF的发现表明了一种潜在的,普遍存在于代谢适应基础上的分子机制,并在组织氧通量的作用下诱导组织重塑。
此时,萨门扎采用生化方法从大量的细胞提取物中纯化HIF蛋白质。在纯化过程中进行功能分析时,他使用了应用于EPO基因3’增强子的电泳迁移率转移(EMSA)实验。氨基酸测序和随后对纯化蛋白质的cDNA克隆表明,HIF本身是一个异源二聚体,由两个不同的基因产物组成。第一个组件是对氧敏感的部分,称为HIF-1α;第二个组件是一种结构性表达的基因,最初被称为HIF-1b。后来,更多的研究对HIF-1b进行了克隆和描述,并称其为芳香烃受体核转位子(ARNT)。ARNT蛋白和其他一些因子会形成异二聚物,而且它的表达并不会对氧含量敏感,因此显而易见,HIF-1α才是复合体中氧响应性的调节者。
HIF家族的扩大
有四个研究小组独立克隆出了一个与HIF-1α高度相关的蛋白质,即Yoshiaki Fujii-Kuriyama、Werner Risau、Christopher Bradfield和Steven McKnight的团队。他们的研究都是在1997年完成的。编码该蛋白质的基因最初有许多名称,包括仍然很常用的“HIF-2a”。不过,该基因恰当的名称是EPAS1。EPAS1基因编码的蛋白质与HIF-1α具有高度的序列同源性,并且也能结合ARNT异质二聚体。它与HIF-1α一样,都对缺氧敏感,并且几乎具有和HIF-1α同样的调节功能。
然而,HIF-1α和EPAS1之间也存在显著的功能差异。HIF-1α基因缺失的小鼠出现了一个明确的表型,即中期妊娠致死性;而Epas1基因缺失则具有高度变化的表型,可能是遗传背景的变化造成的。此外,有大量证据表明,某些缺氧反应仅由某种对氧敏感的HIF同等型专一控制,例如,红细胞生成似乎就主要由EPAS1控制。
HIF的调节发生在转译之后,且涉及VHL
由多个实验室(包括拉特克利夫所在的实验室在内)收集的数据显示,HIF-1a水平本身受蛋白质稳定性的变化调节、而非受基因转录或蛋白质合成的变化调节。许多团队随后进一步发现,HIF-1a会通过“泛素-蛋白酶体”通路降解,且该过程依赖于氧气。该研究还确定了HIF-1a中负责这类降解的特定结构区域(名为ODD区域,即“依赖于氧气的降解”的英文缩写,在HIF-1a和EPAS1中均存在)。
大约在同一时期,1995年,凯林的团队首次发表了VHL肿瘤抑制基因的完整序列,并指出若向肾细胞癌细胞株中重新引入一种野生型VHL,便可阻止该细胞株形成肿瘤。凯林和其它多支研究团队一直在研究VHL基因、以及该基因与一系列对特定癌症具有遗传易感性的基因家族的联系。凯林发表的论文中指出,VHL是一种肿瘤抑制基因,其活动能够抑制VHL基因变异的患者体内的肿瘤细胞生长。1996年,在确定VHL基因特性的过程中,凯林的团队与马克·戈德伯格团队间的合作研究显示,VHL变异细胞株中有许多HIF目标基因存在过度表达。这一发现说明,“HIF应答”与“VHL相关肿瘤生长”两条通路之间可能存在一定联系。
而在寻找能够与VHL蛋白质结合的物质时,研究人员发现了与VHL功能有关的一条重要线索。1995年,理查德·克劳斯纳与同事们、以及凯林所在的团队发现,VHL会与转录延伸因子B和C发生相互作用。1997年,克劳斯纳、W·马斯顿·莱恩汉和同事们发现,VHL存在于一种与Cul-2蛋白质构成的复合体中,这是蛋白质泛化中涉及的一种因子。该研究发现随后被凯林成功复制。由于延伸因子C和Cul-2蛋白质的结构类似于Skp1和Cdc53(这两种因子都会使特定蛋白质在泛素作用下发生水解),这说明VHL与蛋白质降解之间或具有某种联系。
HIF以泛素化和被VHL水解为目标
尽管研究人员在1996至1998年间弄清了HIF-1a和EPAS1在常氧状态下、会通过蛋白酶体降解被迅速消除,但仍不清楚该过程在缺氧状态下是如何受到抑制的。这里缺失的一块拼图便是泛素E3连接酶,研究人员怀疑该物质与将HIF-1a确定为降解目标有关。而在这一点上,拉克利夫和同事们在1999年取得了关键性突破:他们在论文中指出,VHL复合体参与了HIF-1a的水解过程。他们和其他研究人员随后提出,VHL在这一过程中起到了识别泛素E3连接酶的作用。
此时,整幅“拼图”还缺少关键的一块:VHL与HIF-1a之间的相互作用、以及后续的HIF-1a降解究竟是如何受氧气调节的?麦克斯维尔等人在1999年发表的论文中指出,VHL与HIF-1a之间的相互作用既依赖于氧气、又依赖于铁。这一发现促使研究人员展开了对相关机制的搜寻:既要寻找HIF-1a依赖于氧气发生的、使之能够与VHL相结合的化学变化,又要寻找能够催化该反应的酶。
此时研究人员已经了解到,胶原蛋白中会发生依赖于氧气的蛋白质羟基化,且该反应可由胶原脯氨酸-4-羟化酶调节。因此研究人员猜测,HIF-1a中残余脯氨酸依赖于氧气发生的羟基化或许能产生与VHL相结合所需的构象变化。这一猜测随后果然得到了证实。2001年,拉克利夫和凯林所在的实验室同时报告称,HIF-1a中ODD区域内部的两种脯氨酸残余物依赖于氧气发生的4-羟基化增强了HIF转录因子中VHL复合体结合的亲和性。描述该现象的两篇论文在2001年以“背靠背”的形式发表。
氧依赖性的开关
脯氨酸羟基化需要氧气,由此科学家揭示了HIF-1α和EPAS1蛋白质的翻译后调控机制:在缺氧的情况下,羟基化不可能发生,VHL无法识别HIF-1α;正因为如此,HIF-1α不会泛素化,从而避免了被蛋白酶体降解,依然完好无损。HIF-1α逐渐积累,并激活了低氧诱导基因α的程序(图1)。
拉特克利夫团队和McKnight团队独立确定了参与HIF-1α和EPAS1羟基化的脯氨酸羟化酶(PHD)基因。他们的论文描述了PHD基因的分离,都发表于2001年。凯林的团队还用生化方法分离了PHD基因,并在2002年发表了这项研究。这些羟化酶的发现为制造特殊的PHD抑制剂,进而提高HIF活性提供了可能。例如,我们或许可以通过这种方法增加贫血患者的红细胞生成素(EPO)水平。
第二个氧依赖性机制发现于2001年,与HIF-1α的降解无关,而是为了抑制HIF-1α作为转录因子的活动。萨门扎的团队率先识别出了相关因子,称为FIH-1(意为“抑制HIF的因子”)。FIH是一种氧依赖性的羟化酶,可以使HIF-1α和EPAS1氨基端激活域的天冬酰胺残基(NTAD)羟基化。Murray Whitelaw和Richard Bruick发现,这种羟基化作用会干扰p300转录辅助激活因子的增加。因此,通过脯氨酸羟化过程,氧气不仅促进了HIF-1α降解,还可以抑制任何逃脱VHL依赖性降解的HIF-1α或EPAS1的转录功能。因此,HIF-1α活性的氧依赖性翻译后抑制具有两个独立的机制。这表明,保持合理的HIF水平,以及准确地调节细胞氧含量是一个非常精细的过程。
HIF调控途径的广泛意义
在氧依赖性机制发现之后,许多研究小组的工作揭示了HIF通路的稳固性,以及HIF在调节受氧影响的基因表达中的核心作用。从发现最初的线索以来,萨门扎、拉特克利夫和凯林一直是该领域的中心人物。他们参与了进一步阐明HIF通路的分子生物学工作,并使我们更深刻理解了缺氧反应在健康状态和疾病中的生理作用。
脯氨酸羟化酶的发现启发了寻找羟化酶抑制剂,以提高HIF水平的研究,为药理学开发开辟了新的途径。事实上,一些通过抑制脯氨酸羟化酶来增加HIF功能的潜在药物已经进行了很长时间的临床试验,最近的一系列成果也展示了这些药物在贫血治疗中的临床疗效。
抑制HIF通路的未来应用也很有前景。我们或许可以用这些手段来减缓由VHL突变引起的某些癌症的发展。其中之一是EPAS1功能的特异性阻滞剂,最近凯林和同事在动物模型中发现,该阻滞剂能够减缓VHL突变细胞的肿瘤生长。
从药理上提高HIF的功能可能有助于治疗多种疾病,因为已有研究证明,HIF对免疫功能、软骨形成和伤口愈合等多种现象至关重要。另一方面,抑制HIF功能也可以有许多应用:许多癌症以及一些心血管疾病(包括中风、心脏病和肺动脉高血压)中都会出现HIF水平升高。这些诺贝尔奖成果的应用很可能才刚刚开始,因为很明显,细胞、组织和有机体对氧气的反应是动物最核心、最重要的生理适应之一。
版权声明:本文内容由网友上传(或整理自网络),原作者已无法考证,版权归原作者所有。61k阅读网免费发布仅供学习参考,其观点不代表本站立场。
本文标题:诺贝尔生理学或医学奖背后的科学:细胞是如何感知氧气的61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1