一 : 常用核酸染料
















核酸染料 常用核酸染料

核酸染料 常用核酸染料
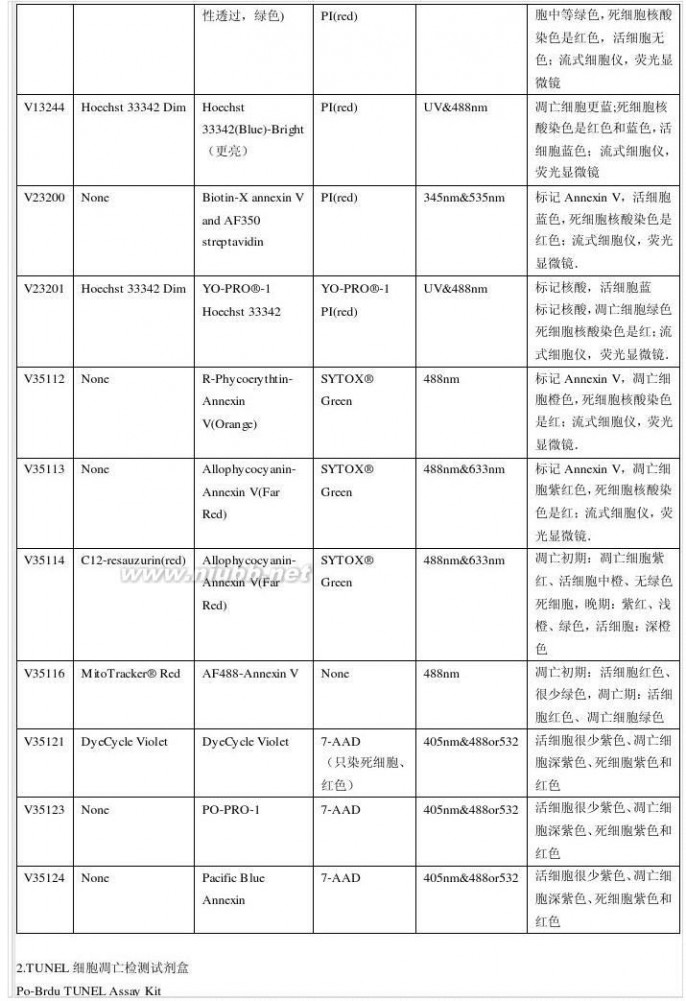
核酸染料 常用核酸染料
核酸染料 常用核酸染料
特别的“染料”给特别的你:Invitrogen独家的SYBR GreenER
【字体:大 中 小】 www.ebiotrade.com 时间:2006年05月23日

来源:生物通 ------------------------------------------------------------------------------------------------------------------------------------

摘要:
要解决SYBR Green的非特异问题,当然不是只有一条途径。[www.61k.com)所谓条条道路通罗马,不同于Qiagen或者ABI利用的是提高DNA聚合酶的特异性,“曲线救国”,Invitrogen公司采用直接改造SYBR Green的方法,发展出更特异更灵敏的荧光染料——SYBR? GreenER? qPCR Reagent System。SYBR Green系列荧光染料由于低毒、灵敏度度优于EB而日渐受到科研用户的欢迎,这个原属于Molecular Probes公司的专利随着Probes被并购进入Invitrogen的大家庭,Invitrogen要优化它自然更方便啦。
SYBR? GreenER?被Invitrogen称为新一代定量PCR荧光检测方法的核心技术之一,相比原有的SYBR Green,最大的优势的发光强度更强更明亮,使得原来检测不到的低丰度DNA的信号更容易被检测到——这也就意味着荧光染料的检测灵敏度提高了,从原来的0.1ng左右提高到6pg,应用在定量PCR检测中就使得基因表达数据分析更为可靠。此外,对荧光染料构造的修饰使得减少了染料分子对PCR反应的抑制作用。SYBR GreenER和原有的SYBR Green一样适用相同的滤光片,并不需要增加新的仪器或者新滤光片(filters)。SYBR GreenER可以看作是SYBR Green的兼容升级版了,具体的升级优化如下:
RealTime ready 智力大冲浪!答对5题,即获赠美国傲仕优质保温杯!
核酸染料 常用核酸染料
升级step one:快速反应与高灵敏度增加结果可靠性
SYBR GreenER这种新颖的DNA结合染料的一个显著特点就是在检测信号上有了大幅度提高,同时也由于SYBR GreenER消除了一些原有SYBR Green对PCR反应的影响(荧光染料结合入DNA小沟,阻碍扩增反应),因此反应时间得到了提升。[www.61k.com]而对于定量PCR反应来说,时间越长代表着反应越有可能进入平台期,影响数据分析,因此快速的反应也可以在一定程度上增加反应的可靠性(见下图)。
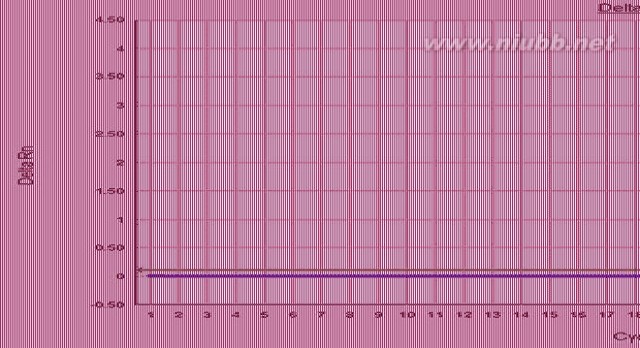
(通过对目标DNA的定量PCR扩增,可以从图中看出SYBR GreenER(绿色)比ABI SYBR? Green Master Mix (红色),以及 ABI Power SYBR? Green Master Mix (蓝色)早3到4个循环得到数据)
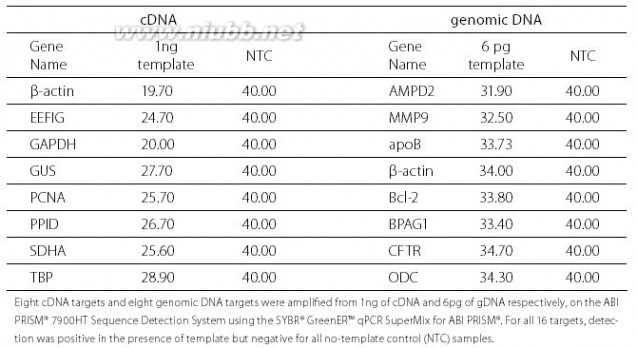
同时也正是由于SYBR GreenER在检测信号方面的改进,因此灵敏度在原有的基础上又进了一步,可以百分之百检测到3pg gDNA(约一个人的基因组当量),而这在同类产品中可是是并不常见的(见下)。灵敏度的提高对于检测单拷贝基因是十分之重要的,尤其是对于稀有复制子,如果检测不到很有可能在疾病诊断和治疗方面出现纰漏,影响甚大。
核酸染料 常用核酸染料

(这里我们特别就这个问题咨询了来自Q厂家的专家Ivy,因为上表中Quantitect正是Q家花旦,Ivy表示,Quantitech可以检测低至5个拷贝的模版,用10pg模版也能得到非常漂亮的曲线(·“酶”头一蹙,计上心来 Qiagen vs.ABI(II)参考文中图片)(这里顺便插一句,我们常常看到厂家的宣传资料中有和其他品牌的对比实验,这些做实验的专家们一般只擅长做自家的产品,人家的产品做的结果都特不好,所以读者还是要自己多看多思考哦!)而且Q厂家认为光有灵敏度是不够的,定量的特异性更是非常重要的,Q的特异性是通过引物设计和试剂盒中的酶和缓冲体系共同来实现的。(www.61k.com)试剂盒的特异性体现在:使用同样的引物时,Q的体系反应仅得到特异性产物,但是其他同类产品的体系会出现引物二聚体(NTC曲线上升),Ct值偏高。)
升级Step two:重复特异性
可靠的定量PCR数据来自于高度的特异性和可重复性,这也正是传统SYBR Green的缺陷所在,要改善这一点,SYBR GreenER除了采用了新型的这种GreeER染料,而且在混合液里的DNA扩增酶也进行了化学修饰,保证其在常温下不会扩增以及可以长时间4°C保存,这种热启动酶活性减少了非特异性扩增。另外SYBR GreenER也同样采用了UNG,减少污染。 这样得到的混合体系即使是模板量从6pg到1ng都可以保证阴性对照(NTC,no template control,即将目的DNA以水取代作为模板)的荧光信号都保持在40持平水平(见下),说
核酸染料 常用核酸染料
明了这一混合液的高特异性和高重复性。[www.61k.com)
升级Step three:适合不同系统的多种选择
SYBR GreenER目前可以提供三种不同的体系以供选择,包括
? SYBR? GreenER? kits for ABI PRISM? (包括 premixed ROX reference dye,获
得对照)
? SYBR? GreenER? kits for iCycler? (包括premixed fluorescein,获得动力学
因子(dynamic well factors),可以用于参照) ? SYBR? GreenER? Universal
核酸染料 常用核酸染料

(生物通专稿)
核酸染料 常用核酸染料
细胞荧光化学
一、实验目的
1、进—步熟悉荧光显微镜的使用方法。[www.61k.com]
2、初步了解几种常用的荧光染色方法。
二、实验用品
荧光显微镜、水浴锅、载玻片、盖玻片、镊子、消毒牙签
三、实验原理
荧光法较一般光学方法具有灵敏度高、特异性强、方法简便等优点,因此近年来荧光组织化学特别是免疫荧光技术有了很大的发展。利用荧光技术可研究细胞内化学成分的分布与定位,研究细胞与组织中物质的吸收与转运,进行病理鉴别以及细胞免疫等方面的研究。
当用一种波长的光(如紫外光)照射某种物质时,这种物质会在极短的时问内发射出较照射波长为长的光(可见的光),这种光就称为荧光。有些生物材料受到紫外线照射后能直接发出荧光称自发荧光(或直接荧光);有的生物材料受紫外线照射后并不发光,但当它吸收荧光染料后,也同样产生荧光,称间接荧光(或次生荧光)。与生物学有关的荧光现象有五种:
1、 自发荧光 如叶绿索、维生素A的红色荧光、胶原纤维的蓝绿色荧光、脂褐素的蓝色荧光等。
2、 诱发荧光 通过诱导剂作用而发的荧光,如甲醛蒸气处理可诱发细胞和组织中生物单胺类(儿茶酚胺、5—羟色胺等)产生荧光。
3、荧光染料染色荧光 即经染色后荧光染料与细胞中某些成分结合而产生的荧光。
4、酶诱发荧光 通过细胞内酶的作用,使某些不发荧光的物质转换为发荧光的产物。如细胞内的脂酶可使不发荧光的二醋酸荧光素分解为发荧光的荧光素。
5、免疫荧光 荧光染料和抗体以共价键结合,这种标记的抗体再和相应的抗原形成抗原—抗体复合物,经激发后发射荧光,用以辨认抗原。
细胞和组织所产生的荧光必须通过荧光显微镜进行观察或通过显微荧光光度计进行定量测定。除少数生活物质含有自发荧光外,大多数研究需外加荧光染料,进行特异性结合而得以显示。.
四.实验方法
(一)几种荧光染料对细胞染色的观察
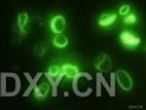
细胞吖啶橙荧光染色的观察 :吖啶橙是最经典的灵敏的荧光染料,它可对细胞中的DNA和RNA同时染色而显示不同颜色的荧光,DNA呈绿色荧光,RNA呈橙红色荧光。
1.将生长有培养细胞的玻片或鸡血涂片放入95%乙醇中固定15—30分钟,干燥;
2.在1%醋酸中酸化30秒;
3.在标本片上滴加足量的0.01%吖啶橙磷酸缓冲染液,染色5-10分钟;
4.用pH4.8磷酸缓冲液洗1分钟;
5.0.1mol/L氯化钙分化30秒或几分钟;
6.PBS漂洗三次,每次数秒钟;
7.在干净载玻片上滴—滴PBS,将标本片有细胞面向下临时封固,或在血涂片上滴加磷酸缓冲
核酸染料 常用核酸染料
液后加盖玻片临时封固;
8.在荧光显微镜下观察,用蓝紫光激发滤片,可见细胞核为绿色,细胞质为橙红色,但常因细胞质的pH值的变化而呈棕色至鲜红色。[www.61k.com)
(二)活细胞双荧光染色观察细胞核和线粒体
一般的生物染料不能穿透细胞膜,只有当细胞被固定后改变了细胞膜的通透性,染料才能进入细胞内。但有些活体染料能进入活细胞,并对细胞不产生毒性作用。荧光染料Ho33342和若丹明123都是活体染料。Ho33342能与细胞中DNA进行特异的结合,若丹明123能与线粒体进行特异的结合。采用两种荧光染料的混合染液可对一个活细胞的核和线粒体同时染色。
1. 用牙签在自己口腔颊粘膜处刮取上皮细胞涂于干净载玻片上;
2.滴一滴双荧光染液(含0.25ug/mL Ho33342和若丹明123 1ug/mL的PBS液)于细胞上;
3.加上盖玻片(注意防止气泡),用指甲油把盖玻片边缘封好;
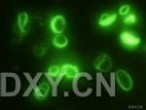
4.用落射式荧光显微经观察。先用高倍镜观察细胞核(采用紫外光激发滤片/双色束分离器/内装阻断滤片的组合插块置于光路),可见核发蓝荧光。再换油镜观察线粒体(换用紫光或蓝光的组合插块),在细胞核附近的胞质中可见有一些发绿光的圆形和短秆状颗粒分布,即为线粒体。
五、荧光组化实验中应注意的几个问题
1.每种荧光染料,均有自己的最适PH值,此时荧光最强。当pH改变时,不仅荧光强度减弱,而且波长将有所改变,因此荧光检测时要在一定的PH值的缓冲液中进行。
2.一放荧光染色在20。C以下时荧光比较稳定,温度升高常出现温度猝灭。
3.在荧光观察中,常因激发光的增强而使样品荧光很快衰竭,造成观察和照相困难。为此最好用能量小的长波长光进行观察,需照相时再适当增强激发光。
4.一般荧光染液的浓度在万分之一以下,甚至亿万分之一,也能使标本着色。在一定的限度内,荧光强度可随荧光素的浓度增加而增强,但超过限度,荧光强度反而下降,这是由于荧光分子间的缔合而使自身荧光猝灭所致。
核酸染料 常用核酸染料
我发现用Goldview染色后,随着电泳时间的延长,紫外照射下的荧光强度越来越弱,如下图: 不知道大家用的时候有没有类似的情况出现?有什么好的方法避免吗?
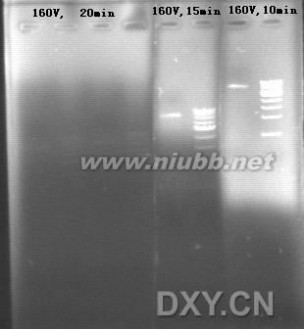
呵呵,你是直接把Goldview加入到胶中进行电泳吧.
在电泳时,一般我们都知道核酸由负级向正级泳动.但如果制胶时就加入EB或Goldview的话,这些荧光染料也有自己的泳动方向----正级向负级!正好和核酸电泳迁移方向相反。[www.61k.com)
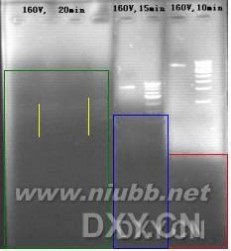
你的电压(160),呵呵,有些偏大(不晓得你的电泳槽和胶的长度,但感觉还是蛮大,我们一般常的小于120).,10min后,Goldview泳动到红色上边框处(下图),15min后泳动到兰色上边框处,20min后泳动到绿色上边框处,而红、兰、绿方框内是没有荧光染料或仅有微弱的残留。
由于没有了Goldview染色,所以电泳20min后你观察不到核酸着色带。但隐约还是可以看到一点点微弱的着色(黄色竖线处)。
不是Goldview染料有问题,想避免这种情总发生,可以将Goldview加入电泳液(如果电泳槽体积小,电泳液更换不频繁的话。嘿,为了节约嘛);也可以制胶时不加入Goldview,先电泳,后染色;
当然,也可以把电压调小些,电泳时间短一点!
你再试试看!
呵呵,EB也是一样哦。
核酸染料 常用核酸染料
EB染色有问题的战友同样可以参考!
核酸染料 常用核酸染料
马上就要做荧光检测了,可是在园子里一搜居然这么多方法.不太明白.ho33342/PI双染是不是说33342可看出凋亡,PI可测出细胞坏死.双染后坏死细胞被PI染成红色,凋亡细胞被33342染成亮兰色?33342和PI是在板子里加完细胞就加,还是培养24小时,细胞贴壁后再加?用96孔板吗?不清楚,请各位高手帮忙!谢谢!
Hoechest/PI双染法检测细胞凋亡的原理是:早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的、能与DNA结合的荧光染料(如PI)不能进入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。[www.61k.com)利用这一特点,将被检测细胞悬液用荧光素染色,利用流式细胞仪或荧光显微镜检测细胞悬液中的细胞荧光强度可区分正常细胞、坏死细胞和凋亡细胞。正常细胞由于对染料有抗拒性,荧光染色很浅,凋亡细胞主要摄取Hoecha染料,呈现强蓝色荧光,而坏死细胞主要摄取碘化丙啶(PI)而呈强的红色荧光。
具体操作是待细胞处理结束后(贴壁不是标准),收集约10~100万个细胞(96孔板单孔应该收集不到这么多的细胞),分别用PI和Hoecha染料染色后,进行流式细胞仪分析或荧光显微镜观察。PI及Hoechest3342均使用340nm紫外线激发,前者荧光为红色(620nm),后者荧光为蓝色(480nm)。
我做过荧光显微镜观察细胞凋亡,但是Hoechst33342单染,效果同双染差不多,具体操作如下,可供参考:
将培养于含盖玻片的24孔培养板中细胞,给予不同浓度的药物培养一定时间后,即进行Hoechest33342染色检测细胞凋亡:
1. 固定:细胞盖玻片用0.01M PBS洗两遍(3min×2),加4%多聚甲醛室温下固定1h,用0.01M PBS洗三遍(3min×3);
2. 染色:在暗房内配1:200 Hoechest(5ug/ml),即将10ul Hoechest储存液和2mlPBS混合,加入Hoechest工作液,100ul/孔,4℃避光孵育1h,用0.01M PBS洗三遍(3min×3);
3. 封片:在载玻片上滴加10ul缓冲甘油,将盖玻片附有细胞的一面倒扣在甘油上;
4. 检测:在激发光波长为490nm,滤色波长为520nm的荧光显微镜下观察,正常细胞核呈弥散均匀的蓝色荧光,凋亡的细胞核呈团状或碎块状致密浓染的强荧光;拍摄照片;计算每个视野内凋亡细胞的百分率=凋亡细胞核数/总细胞核数×100%。
上述方法参考《细胞凋亡的基础与临床》
用Annexin -FITC和PI也可鉴别凋亡和坏死。原理如下:
在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发生凋亡早期,膜磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。Annexin 是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin 被作为检测细胞早期凋亡的灵敏指标之一。在细胞发生凋亡时,膜磷脂酰丝氨酸外翻的发生早于细胞核的变化。因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin 常与鉴定细胞死活的核酸染料(如Propidium Iodide,PI)合并使用,来区分凋亡细胞与死亡细胞。
screen.width-333)this.width=screen.width-333" width=408 height=191 title="Click to iew full 示意图.jpg (408 X 191)" border=0 align=absmiddle>
不错 收藏
核酸染料 常用核酸染料
真好!!谢谢啊!!
谢谢楼主!
谢谢各位的帮忙。[www.61k.com]但是这个实验对于检测凋亡细胞是不是有说服力,annexin-的结果据说可以和tunnle相比,但价钱却差很多,是这样吗?我现在拿不定用哪种方法了。
二 : 常用核酸染料


















特别的“染料”给特别的你:Invitrogen独家的SYBR GreenER
【字体:大 中 小】 www.61k.com 时间:2006年05月23日

来源:生物通 ------------------------------------------------------------------------------------------------------------------------------------

摘要:
要解决SYBR Green的非特异问题,当然不是只有一条途径。所谓条条道路通罗马,不同于Qiagen或者ABI利用的是提高DNA聚合酶的特异性,“曲线救国”,Invitrogen公司采用直接改造SYBR Green的方法,发展出更特异更灵敏的荧光染料——SYBR? GreenER? qPCR Reagent System。SYBR Green系列荧光染料由于低毒、灵敏度度优于EB而日渐受到科研用户的欢迎,这个原属于Molecular Probes公司的专利随着Probes被并购进入Invitrogen的大家庭,Invitrogen要优化它自然更方便啦。
SYBR? GreenER?被Invitrogen称为新一代定量PCR荧光检测方法的核心技术之一,相比原有的SYBR Green,最大的优势的发光强度更强更明亮,使得原来检测不到的低丰度DNA的信号更容易被检测到——这也就意味着荧光染料的检测灵敏度提高了,从原来的0.1ng左右提高到6pg,应用在定量PCR检测中就使得基因表达数据分析更为可靠。此外,对荧光染料构造的修饰使得减少了染料分子对PCR反应的抑制作用。SYBR GreenER和原有的SYBR Green一样适用相同的滤光片,并不需要增加新的仪器或者新滤光片(filters)。SYBR GreenER可以看作是SYBR Green的兼容升级版了,具体的升级优化如下:
RealTime ready 智力大冲浪!答对5题,即获赠美国傲仕优质保温杯!
升级step one:快速反应与高灵敏度增加结果可靠性
SYBR GreenER这种新颖的DNA结合染料的一个显著特点就是在检测信号上有了大幅度提高,同时也由于SYBR GreenER消除了一些原有SYBR Green对PCR反应的影响(荧光染料结合入DNA小沟,阻碍扩增反应),因此反应时间得到了提升。而对于定量PCR反应来说,时间越长代表着反应越有可能进入平台期,影响数据分析,因此快速的反应也可以在一定程度上增加反应的可靠性(见下图)。
(通过对目标DNA的定量PCR扩增,可以从图中看出SYBR GreenER(绿色)比ABI SYBR? Green Master Mix (红色),以及 ABI Power SYBR? Green Master Mix (蓝色)早3到4个循环得到数据)
同时也正是由于SYBR GreenER在检测信号方面的改进,因此灵敏度在原有的基础上又进了一步,可以百分之百检测到3pg gDNA(约一个人的基因组当量),而这在同类产品中可是是并不常见的(见下)。灵敏度的提高对于检测单拷贝基因是十分之重要的,尤其是对于稀有复制子,如果检测不到很有可能在疾病诊断和治疗方面出现纰漏,影响甚大。

(这里我们特别就这个问题咨询了来自Q厂家的专家Ivy,因为上表中Quantitect正是Q家花旦,Ivy表示,Quantitech可以检测低至5个拷贝的模版,用10pg模版也能得到非常漂亮的曲线(·“酶”头一蹙,计上心来 Qiagen vs.ABI(II)参考文中图片)(这里顺便插一句,我们常常看到厂家的宣传资料中有和其他品牌的对比实验,这些做实验的专家们一般只擅长做自家的产品,人家的产品做的结果都特不好,所以读者还是要自己多看多思考哦!)而且Q厂家认为光有灵敏度是不够的,定量的特异性更是非常重要的,Q的特异性是通过引物设计和试剂盒中的酶和缓冲体系共同来实现的。试剂盒的特异性体现在:使用同样的引物时,Q的体系反应仅得到特异性产物,但是其他同类产品的体系会出现引物二聚体(NTC曲线上升),Ct值偏高。)
升级Step two:重复特异性
可靠的定量PCR数据来自于高度的特异性和可重复性,这也正是传统SYBR Green的缺陷所在,要改善这一点,SYBR GreenER除了采用了新型的这种GreeER染料,而且在混合液里的DNA扩增酶也进行了化学修饰,保证其在常温下不会扩增以及可以长时间4°C保存,这种热启动酶活性减少了非特异性扩增。另外SYBR GreenER也同样采用了UNG,减少污染。 这样得到的混合体系即使是模板量从6pg到1ng都可以保证阴性对照(NTC,no template control,即将目的DNA以水取代作为模板)的荧光信号都保持在40持平水平(见下),说
明了这一混合液的高特异性和高重复性。

升级Step three:适合不同系统的多种选择
SYBR GreenER目前可以提供三种不同的体系以供选择,包括
? SYBR? GreenER? kits for ABI PRISM? (包括 premixed ROX reference dye,获
得对照)
? SYBR? GreenER? kits for iCycler? (包括premixed fluorescein,获得动力学
因子(dynamic well factors),可以用于参照) ? SYBR? GreenER? Universal

(生物通专稿)
细胞荧光化学
一、实验目的
1、进—步熟悉荧光显微镜的使用方法。
2、初步了解几种常用的荧光染色方法。
二、实验用品
荧光显微镜、水浴锅、载玻片、盖玻片、镊子、消毒牙签
三、实验原理
荧光法较一般光学方法具有灵敏度高、特异性强、方法简便等优点,因此近年来荧光组织化学特别是免疫荧光技术有了很大的发展。利用荧光技术可研究细胞内化学成分的分布与定位,研究细胞与组织中物质的吸收与转运,进行病理鉴别以及细胞免疫等方面的研究。
当用一种波长的光(如紫外光)照射某种物质时,这种物质会在极短的时问内发射出较照射波长为长的光(可见的光),这种光就称为荧光。有些生物材料受到紫外线照射后能直接发出荧光称自发荧光(或直接荧光);有的生物材料受紫外线照射后并不发光,但当它吸收荧光染料后,也同样产生荧光,称间接荧光(或次生荧光)。与生物学有关的荧光现象有五种:
1、 自发荧光 如叶绿索、维生素A的红色荧光、胶原纤维的蓝绿色荧光、脂褐素的蓝色荧光等。
2、 诱发荧光 通过诱导剂作用而发的荧光,如甲醛蒸气处理可诱发细胞和组织中生物单胺类(儿茶酚胺、5—羟色胺等)产生荧光。
3、荧光染料染色荧光 即经染色后荧光染料与细胞中某些成分结合而产生的荧光。
4、酶诱发荧光 通过细胞内酶的作用,使某些不发荧光的物质转换为发荧光的产物。如细胞内的脂酶可使不发荧光的二醋酸荧光素分解为发荧光的荧光素。
5、免疫荧光 荧光染料和抗体以共价键结合,这种标记的抗体再和相应的抗原形成抗原—抗体复合物,经激发后发射荧光,用以辨认抗原。
细胞和组织所产生的荧光必须通过荧光显微镜进行观察或通过显微荧光光度计进行定量测定。除少数生活物质含有自发荧光外,大多数研究需外加荧光染料,进行特异性结合而得以显示。.
四.实验方法
(一)几种荧光染料对细胞染色的观察
细胞吖啶橙荧光染色的观察 :吖啶橙是最经典的灵敏的荧光染料,它可对细胞中的DNA和RNA同时染色而显示不同颜色的荧光,DNA呈绿色荧光,RNA呈橙红色荧光。
1.将生长有培养细胞的玻片或鸡血涂片放入95%乙醇中固定15—30分钟,干燥;
2.在1%醋酸中酸化30秒;
3.在标本片上滴加足量的0.01%吖啶橙磷酸缓冲染液,染色5-10分钟;
4.用pH4.8磷酸缓冲液洗1分钟;
5.0.1mol/L氯化钙分化30秒或几分钟;
6.PBS漂洗三次,每次数秒钟;
7.在干净载玻片上滴—滴PBS,将标本片有细胞面向下临时封固,或在血涂片上滴加磷酸缓冲
液后加盖玻片临时封固;
8.在荧光显微镜下观察,用蓝紫光激发滤片,可见细胞核为绿色,细胞质为橙红色,但常因细胞质的pH值的变化而呈棕色至鲜红色。
(二)活细胞双荧光染色观察细胞核和线粒体
一般的生物染料不能穿透细胞膜,只有当细胞被固定后改变了细胞膜的通透性,染料才能进入细胞内。但有些活体染料能进入活细胞,并对细胞不产生毒性作用。荧光染料Ho33342和若丹明123都是活体染料。Ho33342能与细胞中DNA进行特异的结合,若丹明123能与线粒体进行特异的结合。采用两种荧光染料的混合染液可对一个活细胞的核和线粒体同时染色。
1. 用牙签在自己口腔颊粘膜处刮取上皮细胞涂于干净载玻片上;
2.滴一滴双荧光染液(含0.25ug/mL Ho33342和若丹明123 1ug/mL的PBS液)于细胞上;
3.加上盖玻片(注意防止气泡),用指甲油把盖玻片边缘封好;
4.用落射式荧光显微经观察。先用高倍镜观察细胞核(采用紫外光激发滤片/双色束分离器/内装阻断滤片的组合插块置于光路),可见核发蓝荧光。再换油镜观察线粒体(换用紫光或蓝光的组合插块),在细胞核附近的胞质中可见有一些发绿光的圆形和短秆状颗粒分布,即为线粒体。
五、荧光组化实验中应注意的几个问题
1.每种荧光染料,均有自己的最适PH值,此时荧光最强。当pH改变时,不仅荧光强度减弱,而且波长将有所改变,因此荧光检测时要在一定的PH值的缓冲液中进行。
2.一放荧光染色在20。C以下时荧光比较稳定,温度升高常出现温度猝灭。
3.在荧光观察中,常因激发光的增强而使样品荧光很快衰竭,造成观察和照相困难。为此最好用能量小的长波长光进行观察,需照相时再适当增强激发光。
4.一般荧光染液的浓度在万分之一以下,甚至亿万分之一,也能使标本着色。在一定的限度内,荧光强度可随荧光素的浓度增加而增强,但超过限度,荧光强度反而下降,这是由于荧光分子间的缔合而使自身荧光猝灭所致。
我发现用Goldview染色后,随着电泳时间的延长,紫外照射下的荧光强度越来越弱,如下图: 不知道大家用的时候有没有类似的情况出现?有什么好的方法避免吗?
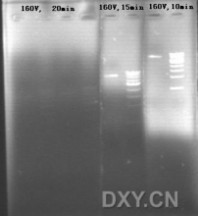
呵呵,你是直接把Goldview加入到胶中进行电泳吧.
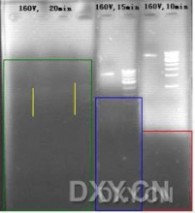
在电泳时,一般我们都知道核酸由负级向正级泳动.但如果制胶时就加入EB或Goldview的话,这些荧光染料也有自己的泳动方向----正级向负级!正好和核酸电泳迁移方向相反。
你的电压(160),呵呵,有些偏大(不晓得你的电泳槽和胶的长度,但感觉还是蛮大,我们一般常的小于120).,10min后,Goldview泳动到红色上边框处(下图),15min后泳动到兰色上边框处,20min后泳动到绿色上边框处,而红、兰、绿方框内是没有荧光染料或仅有微弱的残留。
由于没有了Goldview染色,所以电泳20min后你观察不到核酸着色带。但隐约还是可以看到一点点微弱的着色(黄色竖线处)。
不是Goldview染料有问题,想避免这种情总发生,可以将Goldview加入电泳液(如果电泳槽体积小,电泳液更换不频繁的话。嘿,为了节约嘛);也可以制胶时不加入Goldview,先电泳,后染色;
当然,也可以把电压调小些,电泳时间短一点!
你再试试看!
呵呵,EB也是一样哦。
EB染色有问题的战友同样可以参考!
马上就要做荧光检测了,可是在园子里一搜居然这么多方法.不太明白.ho33342/PI双染是不是说33342可看出凋亡,PI可测出细胞坏死.双染后坏死细胞被PI染成红色,凋亡细胞被33342染成亮兰色?33342和PI是在板子里加完细胞就加,还是培养24小时,细胞贴壁后再加?用96孔板吗?不清楚,请各位高手帮忙!谢谢!
Hoechest/PI双染法检测细胞凋亡的原理是:早期死亡细胞膜通透性状态的不同是区分细胞凋亡和坏死的一个重要指标,凋亡细胞在进入最终溶解阶段前,胞膜通透性无明显改变,相对分子质量大的、能与DNA结合的荧光染料(如PI)不能进入凋亡细胞内,而相对分子质量小的荧光染料(如Hoechest 3342或33258等)仍能被细胞摄取。利用这一特点,将被检测细胞悬液用荧光素染色,利用流式细胞仪或荧光显微镜检测细胞悬液中的细胞荧光强度可区分正常细胞、坏死细胞和凋亡细胞。正常细胞由于对染料有抗拒性,荧光染色很浅,凋亡细胞主要摄取Hoecha染料,呈现强蓝色荧光,而坏死细胞主要摄取碘化丙啶(PI)而呈强的红色荧光。
具体操作是待细胞处理结束后(贴壁不是标准),收集约10~100万个细胞(96孔板单孔应该收集不到这么多的细胞),分别用PI和Hoecha染料染色后,进行流式细胞仪分析或荧光显微镜观察。PI及Hoechest3342均使用340nm紫外线激发,前者荧光为红色(620nm),后者荧光为蓝色(480nm)。
我做过荧光显微镜观察细胞凋亡,但是Hoechst33342单染,效果同双染差不多,具体操作如下,可供参考:
将培养于含盖玻片的24孔培养板中细胞,给予不同浓度的药物培养一定时间后,即进行Hoechest33342染色检测细胞凋亡:
1. 固定:细胞盖玻片用0.01M PBS洗两遍(3min×2),加4%多聚甲醛室温下固定1h,用0.01M PBS洗三遍(3min×3);
2. 染色:在暗房内配1:200 Hoechest(5ug/ml),即将10ul Hoechest储存液和2mlPBS混合,加入Hoechest工作液,100ul/孔,4℃避光孵育1h,用0.01M PBS洗三遍(3min×3);
3. 封片:在载玻片上滴加10ul缓冲甘油,将盖玻片附有细胞的一面倒扣在甘油上;
4. 检测:在激发光波长为490nm,滤色波长为520nm的荧光显微镜下观察,正常细胞核呈弥散均匀的蓝色荧光,凋亡的细胞核呈团状或碎块状致密浓染的强荧光;拍摄照片;计算每个视野内凋亡细胞的百分率=凋亡细胞核数/总细胞核数×100%。
上述方法参考《细胞凋亡的基础与临床》
用Annexin -FITC和PI也可鉴别凋亡和坏死。原理如下:
在正常细胞中,磷脂酰丝氨酸只分布在细胞膜脂质双层的内侧,细胞发生凋亡早期,膜磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。Annexin 是一种磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin 被作为检测细胞早期凋亡的灵敏指标之一。在细胞发生凋亡时,膜磷脂酰丝氨酸外翻的发生早于细胞核的变化。因为细胞坏死时也会发生磷脂酰丝氨酸外翻,所以Annexin 常与鉴定细胞死活的核酸染料(如Propidium Iodide,PI)合并使用,来区分凋亡细胞与死亡细胞。
screen.width-333)this.width=screen.width-333" width=408 height=191 title="Click to iew full 示意图.jpg (408 X 191)" border=0 align=absmiddle>
不错 收藏
真好!!谢谢啊!!
谢谢楼主!
谢谢各位的帮忙。但是这个实验对于检测凋亡细胞是不是有说服力,annexin-的结果据说可以和tunnle相比,但价钱却差很多,是这样吗?我现在拿不定用哪种方法了。
三 : 最新核酸染料介绍
Goldview I核酸染料----EB替代品
产品规格 您的价格
1ml 80.00
5ml 300.00
特殊规格 请询价
GoldView(GV)是一种可代替溴化乙锭(EB)的新型核酸染料,其灵敏度与EB相当,使用方法与之完全相同,在100ml琼脂糖胶溶液中加入5μl GoldView?即可。[www.61k.com)在紫外透射光下双链DNA呈现绿色荧光,也可用于染RNA.由于未发现GoldView?有致癌作用,且灵敏度与EB相当,将有可能逐渐取代EB而得以广泛应用。
概 述
GoldView?是一种可代替溴化乙锭(EB)的新型核酸染料,采用琼脂糖电泳检测DNA时,GoldView?与核酸结合后能产生很强的荧光信号,其灵敏度与EB相当,使用方法与之完全相同。在紫外透射光下双链DNA呈现绿色荧光,而且也可用于染RNA。
通过Ames试验、小鼠骨髓嗜多染红细胞微核试验、小鼠睾丸精母细胞染色体畸变试验,致突变性结果均为阴性;而溴化乙锭(EB)是一种强致癌剂。因此用Goldview?代替EB不失为一种明智的选择。
使用方法
1. 将100ml琼脂糖凝胶溶液(浓度一般为0.8%~2%)在微波炉中融化。
2. 加入5μl GoldView,轻轻摇匀,避免产生气泡。
3. 冷却至不烫手时倒胶,待琼脂糖凝胶完全凝固后上样电泳。
4. 电泳完毕在紫外灯下观察。若使用数码相机照相记录,则关闭相机的闪光灯,放在自动档即可;若使用凝胶成像系统照相,通过调节光圈、曝光时间,选择合适的滤光片,可得到成像清晰、背景较低的照片。
注意事项
1. 胶厚度不宜超过0.5cm,胶太厚会影响检测的灵敏度。
2. 加入GoldView的琼脂糖凝胶反复融化可能会对核酸检测的灵敏度产生一定影响,但不明显。
核酸染料 最新核酸染料介绍
3. 通过凝胶电泳回收DNA片段时,建议使用GoldView染色,在自然光下切割DNA条带,避免紫外线与EB对目的DNA产生的损伤,可明显提高克隆、转化、转录等分子生物学下游操作的效率。(www.61k.com]
4. 虽然未发现GoldView有致癌作用,但对皮肤、眼睛会有一定的刺激,操作时应戴上手套。
本产品由北京中生瑞泰科技有限公司优惠供应,公司常年现货,欢迎广大科研工作者及经销商同仁前来咨询选购;另外公司专业从事进口科研生化试剂的批发及零售业务,产品涉及分子生物学、细胞生物学、免疫学、生物化学等诸多生命科研领域。因公司业务发展的需要,现诚征各地经销代理商,欢迎有志从事本行业的精英、同行莅临指导。
联系:010-63250233 57279809 18611786965
客服QQ:2861568557 986073639 1282986895
EB(Ethidium bromide)长期用作PCR产物电泳检测中的核酸染料,由于其可以牢固得与双链DNA分子结合,万一操作不当,可能对人体健康造成不良影响。
根据现有的网上资料,我们总结了几种EB替代染料。
一. AtlasSight DNA Stain
无致癌性,Ames艾姆斯氏试验(致突变试验)显示比EB引起更少的突变,骨髓嗜多染红细胞微核试验结果和对小鼠精母细胞的染色体畸变分析结果阴性。AtlasSight DNA Stain适合于核酸电泳应用。可加入预制胶后待电泳后染色,同EB一样灵敏,使用方式同EB相同。同DNA结合后发出绿色荧光。
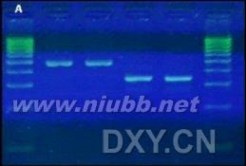
AtlasSight DNA Stain染色的凝胶
核酸染料 最新核酸染料介绍
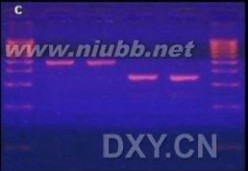
EB染色的凝胶
二. RedGel
Ames艾姆斯氏试验结果表明,比EB引起更少的突变。(www.61k.com)可加入预制胶后待电泳后染色,灵敏度高。
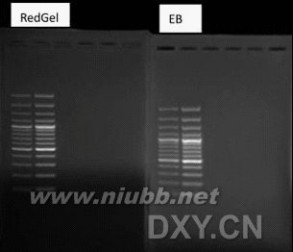
三. 花菁染料
分子量远大于EB(EB分子量394),如果手接触到花菁染料,也不用担心染料会马上进入细胞和DNA结合。
GeneFinder,属于花菁类染料,毒性很低, 其检测核酸的灵敏度比EB染色法平均高10倍左右,与SYBR Green I染料的灵敏度相当。
核酸染料 最新核酸染料介绍

GeneFinder?染料最大吸收峰为470nm,与该染料结合的核酸呈现绿色荧光。[www.61k.com)
产品描述:
GelRed 是一种高灵敏、低毒性和超安全的荧光核酸凝胶染色试剂。它可替代溴化乙锭(EB),并且远高于EB的灵敏度,同时不需要脱色。由于GelRed和EB有相同的光谱特性,因此用它替代EB时不需要更换成像系统。
GelRed既可用于预制凝胶也可用于电泳后染色。通常电泳后染色的灵敏度更高,并能排除染料对DNA迁移的干扰 。使用 GelRed进行电泳后染色,操作简单,不需要脱色和特殊溶液。只要将染料稀释在 0.1M NaCl 中,并将凝胶置于染色液中, 30 分钟后就可以观察。染色液在室温下极为稳定,可以多次反复使用。相比而言,预制凝胶由于不需要额外染色过程,因此染料用量更少,更为简单经济。
其水溶染色剂通过美国环保局安全认定,废弃物可直接倒入下水道,而不会造成任何环境污染。
重要提示:
1、无 毒 性:GelRed独特的油性和大分子量特点使其不能穿透细胞膜进入细胞内,艾姆斯氏试验结果也表明,该染料的诱变性远小于EB。其水溶染色剂通过美国环保局安全认定,废弃物可直接倒入下水道,而不会造成任何环境污染。
2、灵敏度高:适用于各种大小片段的电泳染色,对核酸迁移的影响小于SYBR Green I。
3、稳定性高: 可以使用微波炉加热,可以在室温下保存。
核酸染料 最新核酸染料介绍
4、信噪比高:样品荧光信号强,背景信号低。[www.61k.com]
5、操作简单:与 EB 一样,在预制胶和电泳过程中不必担心染料降解;而电泳后染色过程也只需30 分钟且无需脱色或冲洗 ,即可直接用紫外凝胶透射仪观察。
6、适用范围广:适用于预制凝胶(胶染法)和凝胶电泳后染色(泡染法)。
7、与标准凝胶成像系统完美兼容 :使用 312nm 激发的 UV 凝胶成像系统时, GelRed 可以完美的替代 EB
本文标题:核酸染料-常用核酸染料61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1