一 : 济宁一中分校初四化学第一学期期末学业水平测试试题
济宁一中分校初四第一学期期末学业水平测试化学试题
可能用到的原子量:Cu:64 Zn:65 H:1 S:32 O:16


2、物质的分类非常重要。下列按酸、碱、盐的顺序排列的一组是( )
A.H2SO4、Na2CO3、NaCl B.Ca(OH)2、HCl、Na2SO4
C.NaOH、H2CO3、NaCl D.H2SO4、NaOH、Na2CO3
3、某同学用pH试纸测定日常生活中一些液体的pH。他的实验记录一定错误的是( )
A.肥皂水pH=10 B.纯碱溶液pH=11
C.橘子汁pH=4 D.食醋pH=7
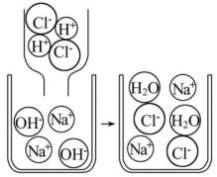
4、、许多物质在溶液中都以离子形式存在。我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应。如氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示)。结合信息、图示,你认为下列各组离子间不能反应的是( )
A.H Na OH NO3
C.H+ K+ CO32- HCO3- ++- - B.Na K Cl OH- D.K+ Ba2+ Cl- SO42- ++-
5、下列厨房用具,在空气中最易锈蚀的是( )

6、如图是A、B两种固体物质的溶解度曲线,下列说法正确的是
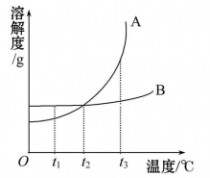
( )
A.A的溶解度都大于B的溶解度
B.t1 ℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大
C.t2 ℃时,A、B两种饱和溶液中,溶质的质量分数相等
D.A、B两种饱和溶液都从t3 ℃降温到t2 ℃,析出的晶体一定等量
7、金属R与CuCl2溶液反应的化学方程式为R+CuCl2 ====RCl2+Cu,则下列说法错误的是( )
A.该反应是置换反应
B.金属R可能是铝
C.金属R活动性比Cu强
D.该反应前后R的化合价发生了改变
8、如图为初中化学常见气体的发生与收集装置。有关这些装置的说法不正确的是( )

A.装置Ⅰ可作为固体加热制取气体的发生装置
B.装置Ⅱ中长颈漏斗可以用分液漏斗、医用注射器代替
C.装置Ⅲ、Ⅳ可用于收集密度与空气密度差距较大,且不与空气中各成分反应的气体
D.装置Ⅴ可以用于收集H2、O2,也可以用于实验室收集CO2
9、常温下,在15克氯化钠中加入60克水,完全溶解后,溶液中氯化钠的质量分数为( )
A.20% B.15% C.25% D.33.3%
10、李伟在实验室药品柜中发现一瓶标签残缺的无色溶液(如图),老师告诉他这是实验室常用的试剂。这瓶溶液可能是( )
A.氯化钾 B.氢氧化钾
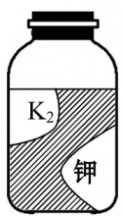
C.硫酸钾 D.硝酸钾
二、填空与简答题、(每空3分、共36分)
1、只用H、C、O、Cl、Ca五种元素中的一种或几种,按要求,各写出一个化学式:
(1)可用作食品干燥剂的氧化物是___________;
(2)胃液中的酸是_________;
(3)可用于改良酸性土壤的碱__________;
(4)含有原子团的盐是_____________________。
2、、炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:

(1) 请写出①、②、③反应的化学方程式:
① 。
②_______________________________________________。
③_______________________________________________。
(2)将生锈的铁制品放入盛有一定量稀盐酸的烧杯中,观察到溶液由无色变为黄
色,写出此反应的化学方程式
_________________________________________________________________。
3、某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案。结合实验方案回答下列问题:
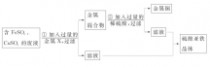
(1)步骤①中,金属X是________,该反应的化学方程式为__________________________________________________________。
(2)步骤②中,加入过量稀硫酸的目的是__________________________________________________________。
(3)从滤液中获得硫酸亚铁晶体采用的方法是__________________________________________________________。
三、实验与探究(每空2分、共18分)
白醋是我们日常生活中常用的调味品,白醋中含有3%~5%的醋酸(CH3COOH)。某化学研究小组围绕白醋开展了下列探究。
Ⅰ.探究白醋的性质。
请完成表格内的相关内容:(可选择的试剂:白醋、镁条、碳酸钠(Na2CO3)粉末、5%的氢氧化钠(NaOH)溶液、酚酞试液、石蕊试液)

Ⅱ.探究影响化学反应快慢的因素。
该小组同学根据酸的性质想到,白醋也能与铁锈反应。于是他们将生锈的铁钉放
入白醋中,没有看到明显现象,老师提示这可能是因反应太慢造成的,于是他们
对影响白醋与铁锈反应快慢的因素展开了探究。
【猜想】影响白醋与铁锈反应快慢的因素可能有:温度、铁锈的表面积大小(即
锈蚀程度)、_____________等。
【探究过程】实验用品:5%的醋酸溶液、10%的醋酸溶液、20%的醋酸溶液、锈蚀
程度相同的铁钉数枚、酒精灯、大试管等。
实验1.实验方案:如图,向三支试管中分别加入10 mL不同浓度的醋酸溶液,
然后同时放入锈蚀程度相同的铁钉1枚,观察现象。
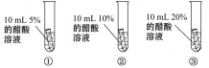
现象:试管①中看不到明显现象;试管②中铁锈消失较慢;试管③中铁锈很快消
失。
结论:_________________________________________________________ ____。
实验2:请实验探究温度对反应速度的影响
实验方案:(请用简要文字说明)________________________________ ___________________________________________________________
结论:升高温度,白醋与铁锈反应能加快。
【总结反思】依据实验室制氧气的原理,催化剂也是影响化学反应快慢的因素。
四、 分析与计算(6分)
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样
品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,均充分反应,实验数据如

(1)(2分)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)
(2)(4分)所用稀硫酸的质量分数为多少?
二 : 91高中化学选修三期末总复习试题
高中化学选修三期末总复习试题
班级__________姓名__________
一、选择题每小题只有一个正确答案
1.下列说法中正确的是
A.电子云通常是用小黑点来表示电子的多少 B.处于最低能量的原子叫基态原子
C.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
D.电子仅在激发态跃迁到基态时才会产生原子光谱
2.价电子排布为5s25p1的元素,在周期表中的位置是
A.第四周期第ⅤA族
C.第五周期第ⅠA族
3.下列电子层中,包含有f能级的是
A.K电子层 B.L电子层 C.M电子层 D.N电子层
4.下列各原子或离子的电子排布式错误的是
A.K 1s22s22p63s23p6 B.As 1s22s22p63s23p63d104s24p3 +B.第五周期第ⅢA族 D.第四周期第ⅢA族
C.N3- 1s22s22p6 D.Cr 1s22s22p63s23p63d44s2
5.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是
6.某元素简化电子排布式为[Xe]4f46s2,其应在
A.s区 B.p区 C.d区 D.f区
7.第三周期元素中,微粒半径最大的是 ( )
A.Na B.Na+ C.S2- D.Cl-
8.元素电负性随原子序数的递增而增强的是
A.Na K Rb B.N P As C.O S Cl D.Si P Cl
9.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能
量,以下各式中正确的是
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)<E(3s)<E(2s)<E(1s) D.E(5s)>E(4s)>E(4f)>E(3d)
10.关于电子云的下列说法不正确的是 .
A.s电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形
B.s轨道都是球形轨道 C.轨道不同,电子云的形状也不一样
D.电子云图是形象地描述电子在空间单位体积内出现概率大小的图形
11.下列四种元素中,其单质氧化性最强的是
A.原子含有未成对电子最多的第二周期元素
B.位于元素周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p6的元素 D.原子最外层电子排布为2s22p5的元素
12.下列各组表述中,两个微粒一定不属于同种元素原子的是 .
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
13.下列说法中正确的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
14.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.第一电离能Y可能小于X B.气态氢化物的稳定性:HmY大于HnX
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的
D.X和Y形成化合物时,X显负价,Y显正价
15
下列叙述正确的是
A.X、Y元素的金属性X<Y B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
16.下列各组元素性质的递变情况错误的是
A.Li、Be、B原子最外层电子数依次增多 B.P、S、Cl元素最高正价依次升高
C.N、O、F电负性依次增大 D.Na、K、Rb第一电离能逐渐增大
17.下列各组粒子,半径大小比较中错误的是
A.K>Na>Li B.Na+>Mg2+>Al3+ C.Mg2+>Na+>F- D.Cl->F->F
18.关于晶体与化学键关系的下列说法中,正确的是( )
A.离子晶体中一定存在共价键
B.原子晶体中可能存在离子键
C.金属晶体中存在离子,但却不存在离子键
D.分子晶体中一定存在共价键
19.由下列各组的三种元素构成的化合物中既有离子晶体,又有分子晶体的是( )
A.H、O、C B.Na、S、O C.H、N、O D.H、S、O
20.下列物质的熔、沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CF4
C.MgO>H2O>N2>O2 D.金刚石>生铁>钠>纯铁
21.下列叙述正确的是( )
①离子化合物可能含有共价键 ②构成晶体的粒子一定含有共价键 ③共价化合物中不可能含有离子键 ④非极性分子中一定含有非极性键
A.①② B.①③ C.②④ D.③④
22.下表所列有关晶体的说法中,有错误的是( )
23.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
24.下列微粒的个数比不是1∶1的是( )
A.NaHCO3晶体中阴、阳离子
B.NH3分子中的质子和电子
C.Na2O2固体中阴、阳离子
2D.1H原子中的质子和中子
25.下列有关数据的比较,不正确的是( )
A.元素的价电子数和所在族的族序数相等
B.NaOH晶体中的阳离子和阴离子数目相等
C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等
D.[Co(NH3)6]3+中的NH3分子数与配位键数相等
26.金属晶体和离子晶体是重要晶体类型。下列关于它们的说法中,正确的是( )
A.金属晶体和离子晶体都能导电
B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取“紧密堆积”方式
D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性
27.下列金属晶体的堆积方式的空间利用率最低的是( )
A.Na B.Mg C.Po D.Au
28.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是( )
A.在加热时此化合物可以分解
B.它是一种离子化合物
C.这种化合物不能跟强碱发生化学反应
D.该化合物在一定条件下由PH3与HI化合而成
29.
如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
A.8;BaTi8O12 B.8;BaTi4O9 C.6;BaTiO3 D.3;BaTi2O3
30.氢叠氮酸(HN3)与醋酸性质相近,其盐稳定,但受撞击时易迅速发生反应,生成氮气。关于氢叠氮酸以下说法:①NaN3的水溶液呈碱性 ②固体HN3属分子晶体 ③固体NaN3属离子化合物 ④NaN3可用于小汽车防撞保护气囊,其中正确的是( )
A.①②③ B.①②③④ C.②③④ D.①③④
31.有关乙炔分子中的化学键描述不正确的是 ( )
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
32.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中
常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A.PH3分子中有未成键的孤对电子
B.PH3是非极性分子
C.PH3是一种强氧化剂
D.PH3分子的P-H键是非极性键
33.下列物质中,难溶于CCl4的是 ( )
34.用带静电的有机玻璃棒靠近下列液体的细流,细流发生偏转的是 ( )
35.碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为 ( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
36.下列分子或离子中,含有孤对电子的是 ( )
A.H2O B.CH4 C.SiH4 D.NH4+
37.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
38.在乙烯分子中有5个σ键、一个π键,它们分别是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
二、填空题
39.(14分)(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是________。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是__________________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸 B.能溶于CS2,不溶于水 A.碘单质 B. 水 C. 苯 D.甲烷 A.苯 B.二硫化碳 C.氯水 D.四氯化碳
91高中化学选修三期末总复习试题_高中化学总复习
C.固态时不导电,液态时能导电,可溶于水 D.固态、液态时均不导电,熔点为3 500℃ 试推断它们的晶体类型:
A.________;B.________;C.________;D.________。 40将几种分子晶体在水和四氯化碳中的溶解情况填入下表:
其原因是 41
A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。
(1)它们的元素符号分别为:;; (2)BC2是由 键组成的 (填“极性”或“非极性”)分子。 42.(6分)写出下列原子的电子排布式。(1)S (2)29Cu
(1)____________________ (2)____________________
44试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
三 : 初三上学期期末小结
时间就像那无情的流水,一天一天的过去了,期末考试终于都结束了,初二的“称号”离我们而去,我们已从一个初二生变成一个初三生了。回忆起初二的学习生活,真是有点舍不得,因为到了初三后,我们的学习生活将会变得更紧张,就不会像初二这么自在了。
在初二的学习生活中,我学到了不少的知识,例如:压力与压强,浮力的实际运用。。。真是非常丰富。
而最令我高兴的是我终于学会了学习英语的方法,可是我不会骄傲,因为我的英语成绩还是不理想,但是,我会继续努力,直到满意为止!
当然,有得必有失,而令我不高兴的事就是我对物理越来越陌生,在第一学期的时候还好,可是一到了第二个学期,我和物理就好像成为了两个陌生人一样,互不相识。不知道为什么,凡是一到上物理课的时候,我就会变得无精打采,当我集中精神的听的时候,就不由自主地发起呆来。等我醒来时,老师要讲的内容都已经讲完了。就这样日复一日,我和物理怎么会不变得陌生呢?但是,我绝不会放弃物理,因为曾经有人说过:越搞不懂的地方就要越靠近它。
所以,我会继续努力,力求做的更好!
我要在初三的来临前,把所有不懂的地方弄懂,以最好的状态迎接初三的来临。
老师们都提过,初二是一个重要的学习阶段,也是一个转折点,能否升上好的高中就要看你在这个阶段中学得好不好,知识掌握得牢不牢。所以我决定在正在到来的初三里发奋学习!
初二这一年也发生了大大小小的很多事,刚开学的时候,觉得身边的一切都边了,自己也和初一截然不同了,整整一个初二的一年似乎是由挫折、改变、无助和迷茫所构成,总之很累。明白了很多,发现很多事情只能自己去努力只能自己去完成,别人谁也不能帮你。
那天在计算成绩时,顿时感受到了一种危机,一种紧迫的感受,自己的成绩和中考的分数线差之千里。回忆整整初二这一年只能用虚度这二字形容,想象人的一生又怎能像这样虚度几次呢?这一切太过可怕。回想起初一那时的欢笑打闹与无所事事,可现在呢?我敢说我绝对的善良,也从未伤害别人,也总是为别人着想,至少在班里没几个人可以和我比这些,可这又怎样呢?成绩不好但拥有这些良好品质你还是无能为力的。
或许自己是最能帮助自己的,但自己必须要有那个实力帮助自己。不过还好因为初二这一年我虽然有些晚的明白了这些,但总算懂得了,努力吧!初三会更累因为这一年丢的东西太多,从现在起要补回来这些会很麻烦。
一切都是未知的,所以未来也有可能改变,可要是再不努力,后果仿佛已经可想而之。。。
我深知学习的重要性。面对二十一世纪这个知识的时代,面对知识就是力量,科学技术是第一生产力的科学论断,我明白离开了知识将是一个一无是处的废人。以资本为最重要生产力的"资本家"的时代将要过去,以知识为特征的"知本家"的时代已经到来。而中学时代是学习知识的黄金时代,而我国的本科教育又是世界一流的,我应该抓住这个有利的时机,用知识来武装自己的头脑,知识是无价的。首先,合理安排时间,调整好作息时间,分配好学习、娱乐的时间。时间是搞好学习的前提与基础,效率和方法更为重要。
其次,要保质保量的完成老师布置的作业,老师布置的作业一般是他多年教学经验的总结,具有很高的价值,应认真完成。认真对待考试,考前认真复习。另外,积极阅读有关书籍和资料,扩大自己的知识面;经常提出问题,与同学讨论,向老师请教;搞好师生关系,师生相处得融洽和睦;抓住点滴时间学习一些其它领域的知识,因为知识总是有用的。在这学期的期末考试中,尽管取得一些成绩,但离心中的目标还很远,仍需继续努力,抓紧自己的学习。知识无止境,探索无止境,人的发展亦无止境,我还有很多的知识需要学习。
作为一个学生,学习知识亦是最主要的,各何况是一个即将面临中考的初三生!也只有我们努力,奋发,才能获得成功!我相信我的明天在我的努力下将会变得更美好!
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1