一 : 将过量的氯气通入溴化钠和碘化钠的混合溶液中,然后把混合溶液蒸干,再将剩余残渣灼烧,最后留下的物质是[
| 将过量的氯气通入溴化钠和碘化钠的混合溶液中,然后把混合溶液蒸干,再将剩余残渣灼烧,最后留下的物质是 |
| [ ] |
| A.NaCl、NaBr、NaI B.NaCl、NaBr C.NaCl D.NaCl、I2 |
| C |
考点:
考点名称:氯气氯气:
①化学式:Cl2
②氯元素在周期表中的位置:第三周期ⅦA族
③氯原子的电子式: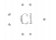
④氯的原子结构示意图:
⑤氯原子的外围电子排布式: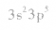
⑥化学键类型:非极性共价键
⑦氯分子的电子式:
⑧氯分子的结构式:
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO二 : 有PH=13的Ba(OH)2和NaOH的混合溶液100mL,从中?
有PH=13的Ba(OH)2和NaOH的混合溶液100mL,从中取出25mL用0.025mol/L的H2SO4滴
有=13的Ba(OH)2和NaOH的混合溶液100mL,从中取出25mL用0.025mol/L的H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所消耗的酸的体积的一半.求
(1)当滴到沉淀不再增加时,溶液的PH为多少(设体积可以加和)
(2)原混合溶液中Ba(OH)2和NaOH的物质的量浓度是多少?
请老师给我详细解答这道题?我需要详细的解题过程?
请老师把解题过程列出来~!
谢谢~!
pH=13,既[OH-]=0.1mol/L,V1=25mL,硫酸浓度是0.025mol/L,[H+]=0.05mol/L.
所以到滴定终点,须硫酸的体积V2=0.1*25/0.05=50mL.其中25mL用于和Ba2+反应,和碱液的体积相等,所以,氢氧化钡的浓度等于硫酸的浓度,是0.025mol/L .其提供的OH-的浓度是0,05mol/L .而OH-的总浓度是0.1mol/L,所以NaOH的浓度是0,05mol/L.
V(H2SO4)=c(OH)*V(OH)/2c(H2SO4)=0.1*25/2*0.025=50ml.
c(SO4)=c(Ba)=c[Ba(OH)2]=c(H2SO4)V(H2SO4)/V(OH)=0.025*25/25=0.025mol/L
c(NaOH)=c(OH)-2c(Ba)=0.1-0.025*2=0.05mol/L .
三 : 求沉淀的蛋白质在饱和硫酸铜溶液中再溶解的解释在我们的生化课中,有
求沉淀的蛋白质在饱和硫酸铜溶液中再溶解的解释
在我们的生化课中,有一个传统实验,如下:
1、取1支试管,加入1ml卵蛋清溶液,再加入2%硫酸铜溶液1滴,观察沉淀生成。
2、再向试管中加入过量的饱和硫酸铜溶液,观察沉淀的溶解。
实验现象确实如此。
但当我们向多名老师询问实验步骤二沉淀溶解现象的原因时,没有一个老师能够很确切、肯定地告诉我们原因,最多只能给出个猜测性结论。即使询问了我校的老师,也没能得到确切解释
。
请想:变性的蛋白质是不会再溶于水的。以上实验中,铜离子已经使蛋白质变性了。
那么请问,实验的步骤二中的沉淀为什么会溶解?
答案最好是非常确切和肯定的,尽量不要猜测。
谢谢了,希望大家不要骂我答题条件过于苛刻。
以下是“五行山下又经”朋友的回答(在这里表示感谢), 但我觉得有所不妥,所以没有采纳,大家可以再看一看:
盐溶液(比如硫酸铜)使蛋白质沉淀的原因不是蛋白质变性而是盐析,少量的盐溶液改变了蛋白质的溶解度,所以在步骤一的时候,溶剂(水)的量相对不足,所以发生了沉淀,但是当加入足够的溶剂(硫酸铜是饱和了,但是蛋白质还能继续溶解),原来析出的蛋白质重新被溶解。这里可能有一个认识上的误区,所谓饱和硫酸铜溶液,饱和的只是硫酸铜,对于其他溶质,还是可以继续溶解的。
这个实验其实主要的目的是分别蛋白质的盐析和变性是两个不同的过程。如果加入重金属,或者加热,蛋白质沉淀以后,再加入无论多少水,都不会重新溶解。
盐析和变性的本质区别在于是否有蛋白质的二级结构改变。
盐析只是改变了蛋白质分子和水分子的结合方式
变性则发生了蛋白空间结构改变,主要是次级键和二硫键破坏,不过一般不涉及一级结构被破坏。
盐析 蛋白質分子表面多少有一些較不具?O性的?^域,水分子??谶@些非?O性?^的表面聚集,形成?似『水籠』的??造 (??下?D),以便把蛋白質溶入水中。一旦蛋白質溶液加入硫酸銨,後者吸引了大量水分子,使水籠?o法有效隔離蛋白質的非?O性?^,造成這些非?O性?^之間的吸引,因而沈?障?怼?
变性 蛋白质受到酸、碱、尿素、有机溶媒、重金属、热、紫外光及X-射现等物理或化学的破坏,引起蛋白质自然之分子结构的改变,并引起生理活性的消失,称为变性作用。 变性作用破坏了蛋白质的二级、三级、四级结构,一般不会影响其初级结构。
关于铜的重金属性的问题
1.铜在重金属中相对比较轻,相对银,汞和其他重金属来说。比它在轻的Fe就不算重金属了。
2.重金属沉淀的蛋白质常是变性的,但这里的作用是盐析,不是变性,因为正如你说的,变性了就不能再溶解。
这是一种胶粒电性反号现象.也就是胶粒可移动边界层到溶液中部的电位差(ξ)电位变号现象.
一般的溶胶中加入电解质时,电解质中与胶粒电性相反的离子(简称反号离子)便要更多地分布在胶团的可动层,甚至挤入固定层.随着反号离子的增加,不但中和了胶粒表面的电荷量,并使胶团的扩散层变薄,ξ电位下降,胶粒相互聚结的机会也就增多了,而当ξ电位降到某临界值时,胶粒表面所带的电荷大部分已被反号离子中和,离子间的吸引力上升为主要矛盾,聚沉就产生了.这就是该实验提到的"1、取1支试管,加入1ml卵蛋清溶液,再加入2%硫酸铜溶液1滴,观察沉淀生成"
有时候,外加电解质的反号离子能被胶粒表面强烈的吸附,那有会由于胶粒固定层内迅速积累了过多的反号离子而迫使ξ电位变号,也就是原来胶粒带的电荷的电性改变(从带正电变为带负电,或者从带负电变为带正电).此时胶粒ξ电位又升高(只是与以前反向了),胶粒之间的排斥力增大,使聚沉的胶粒溶解(但不是任何胶体都有此现象).这就是你的实验中提到的"2、再向试管中加入过量的饱和硫酸铜溶液,观察沉淀的溶解".但如果聚沉了的胶体时间过久的话,你的实验2可能就做不成功了.
我对生物化学知识了解很少.以上回答纯从物理化学方面来回答的.
四 : 请帮我解决问题将V升含有硫酸镁和硫酸钾的混合溶液分成两等份,一份
请帮我解决问题
将V升含有硫酸镁和硫酸钾的混合溶液分成两等份,一份加入a mol氢氧化钠溶液,恰好使镁离子完全沉淀为氢氧化镁。另一份加入含b mol的氯化钡溶液,恰好使硫酸根离子完全沉淀为硫酸钡。原混合溶液中钾离子的浓度是多少?
两份氢氧化钠和一份镁离子反应即2NaOH∽MgSO₄
所以镁离子的物质的量为a/2mol
一份氯化钡和一份硫酸根离子反应
所以硫酸根离子的物质的量为bmol
由电荷代数和为0可知
2n(硫酸根离子)=2n(镁离子)+n(钾离子)
解得n(钾离子)=2b-a
而分成两份后每份溶液体积为v/2L
∴钾离子的浓度为(2b-a)/(v/2)mol/L
=(4b-2a)/V mol/L
本文标题:烧杯中装有一定量硫酸和硫酸铜的混合溶液-将过量的氯气通入溴化钠和碘化钠的混合溶液中,然后把混合溶液蒸干,再将剩余残渣灼烧,最后留下的物质是[61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1