一 : 原电池的工作原理
原文地址:原电池的工作原理作者:老杜原电池的工作原理
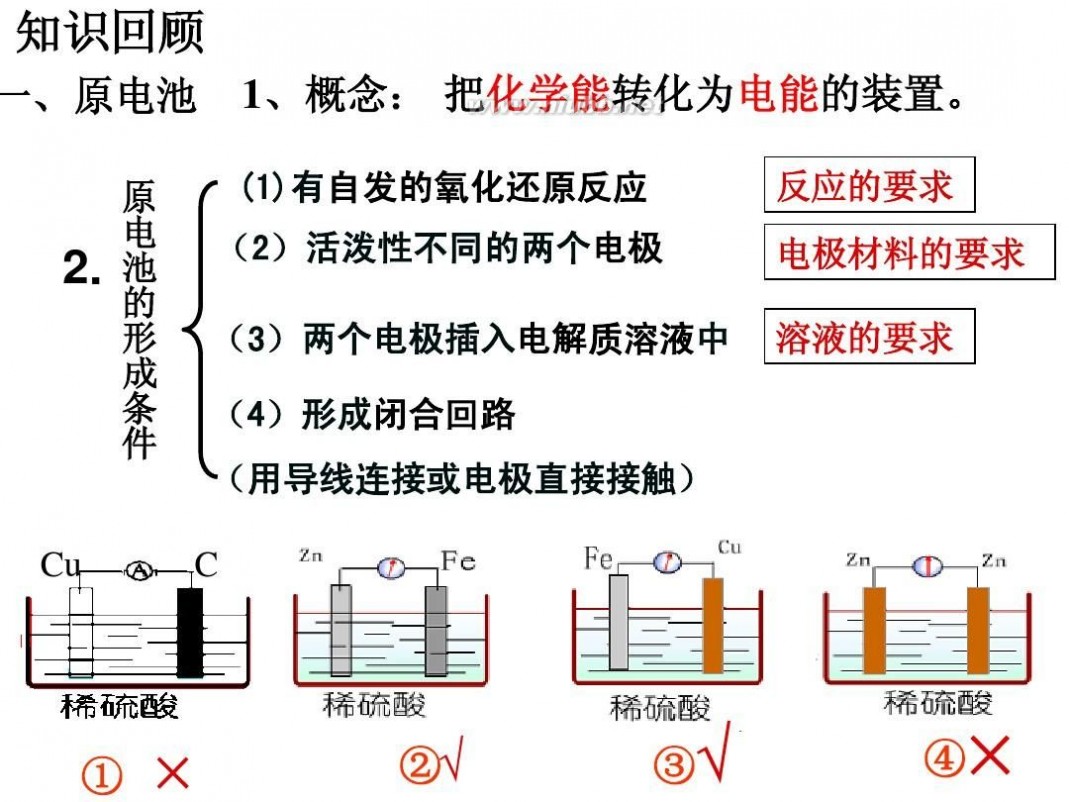
实验原理:原电池是利用氧化还原反应将化学能转化为电能的装置。原电池的工作原理是将氧化还原反应的氧化反应,还原反应分别在两极上进行,还原剂在负极被氧化,失去的电子通过导线传递给正极,氧化剂在正极被还原,得到电子,从而实现化学能到电能的转化。
实验操作:①将锌片与铜片平行插入盛有稀硫酸的烧杯里,观察发生的现象。②用导线把锌片和铜片连接起来,观察发生的现象。③在导线中间接入一个电流计,观察发生的现象。如图所示。
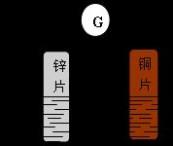
稀硫酸
实验现象及结论:①锌片溶解,锌片上有气泡产生。铜片上无气泡。因为Zn比Cu活泼,Cu不能和稀硫酸发生置换反应,而Zn可以置换出硫酸中的氢:Zn+H2SO4==ZnSO4+H2↑。
②铜片上有气泡产生。因为Zn比Cu活泼,容易失去电子,发生氧化反应,电子沿导线流向铜片,电子流进铜片后,溶液中的氢离子在铜片上得到电子产生氢气,发生还原反应,因而铜片上有气泡产生。
③电流计指针有偏转。说明导线上有电子流过。
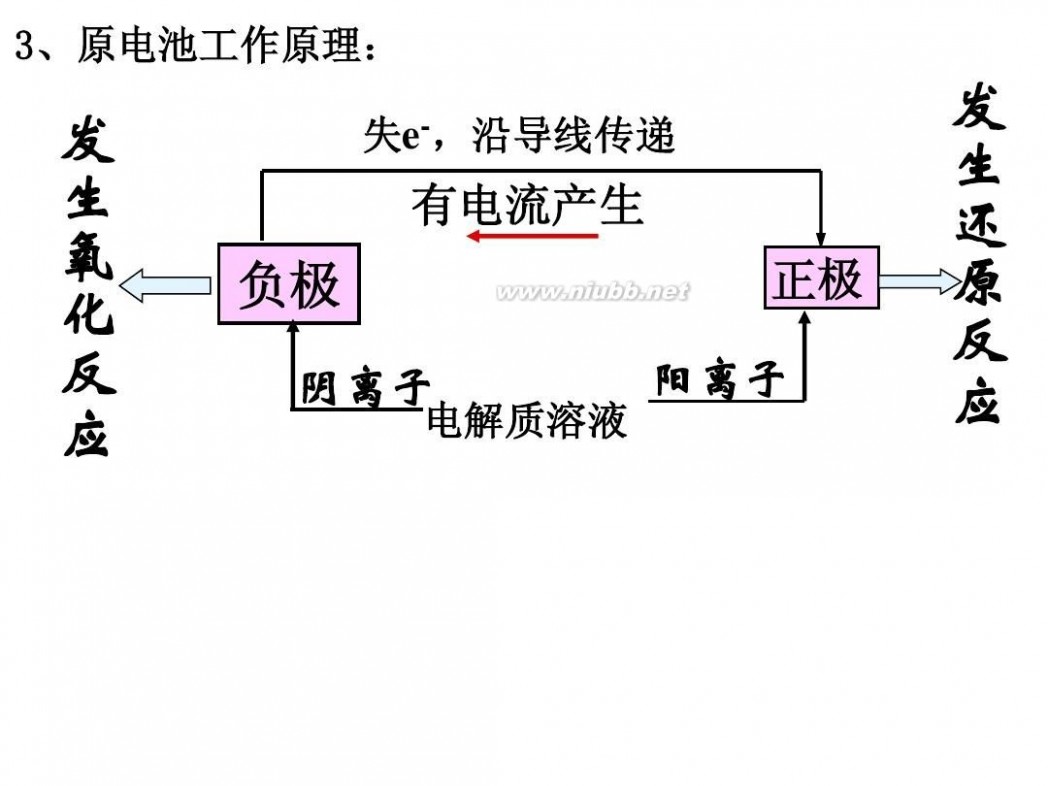
装置中,锌片(负极)发生氧化反应,Zn-2e-==Zn2+,铜片(正极)发生还原反应,2H++2e-==H2↑。电子由负极经导线流向正极,整个电路形成回路,产生电流,化学能转变为电能。这就是原电池的工作原理。
总反应方程式:Zn+2H+==Zn2++H2↑。
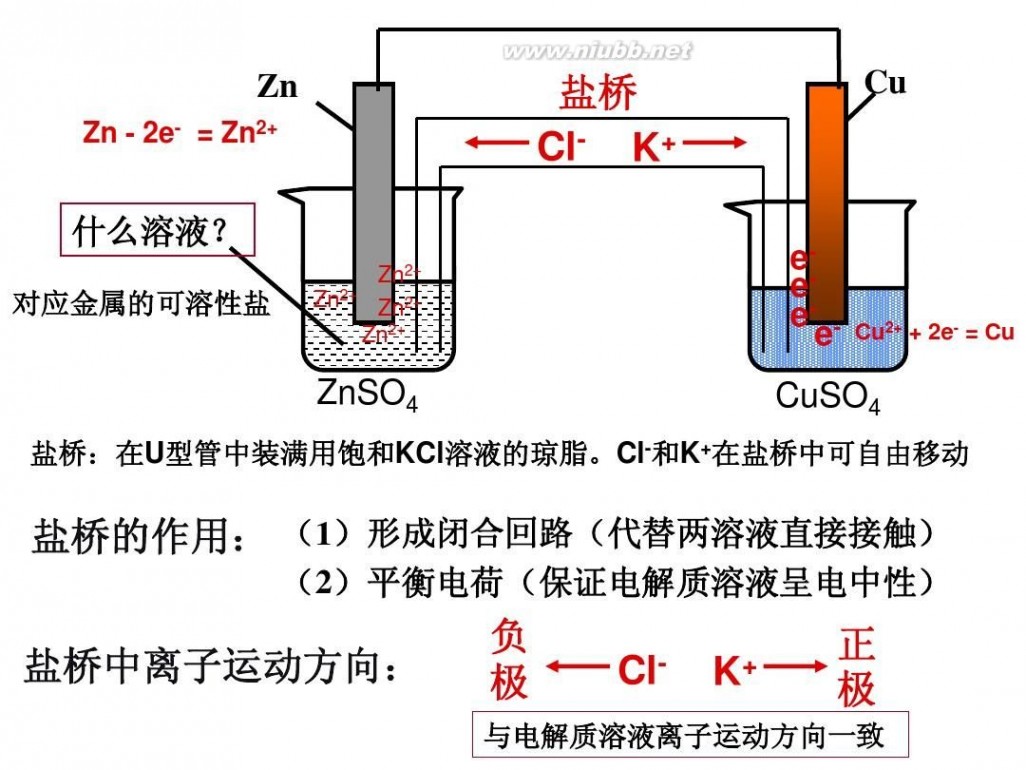
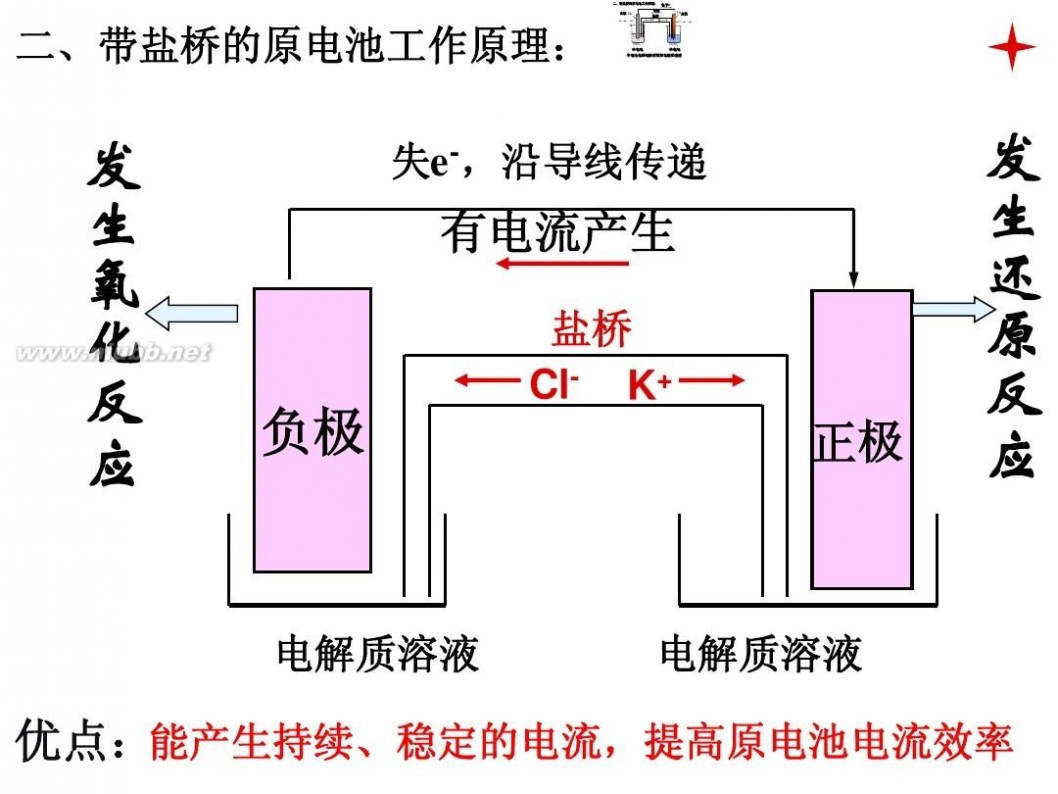
问题:①如果将上述实验中的“稀硫酸”改为“CuSO4溶液”,其他不变,能否构成原电池?如果再用比锌活泼的镁代替铜片,再用ZnSO4溶液代替CuSO4溶液与锌片组成原电池,锌片上将发生怎样的电极反应?如果将锌片置于盛有ZnSO4溶液的烧杯中,将铜片根置于盛有CuSO4溶液的烧杯中,分别构成两个电极,外电路仍用导线连接,并通过盐桥将两个隔离的电解质溶液连接起来,能否构成原电池?根据上述实验探究,你认为原电池构成的条件是什么?
②在实验室里,用锌跟稀硫酸反应制取氢气时,为什么粗锌比纯锌反应快?为什么向稀硫酸中加入少量硫酸铜溶液能使制取氢气的反应加快?
③曾经有一位格林太太镶了一颗金牙,但有一次因意外事故,她的金牙旁边的一颗牙齿破碎,牙医为她补了一颗不锈钢牙,可是自那次事故以后,格林太太就留下了“后遗症”:经常头疼、夜间失眠、心情烦躁,拜访了很多当时的名医,使用了当时最先进的仪器,都无功而返,后来,一次偶然机会,她遇见了一位年轻的化学家,化学家很快就解除了她的烦恼,你想知道格林太太到底得了什么“怪病”,年轻的化学家用什么方法解除了格林太太的烦恼吗?
④有一银器因日久其表面生成了硫化银而变黑。现有一旧铝锅和足量的食盐水,你采用什么方法能使银器光泽复原?写出有关反应的电极方程式和电池反应式。(利用原电池原理将银器放在盛有足量食盐水的铝锅中,使之与锅底接触,这样就构成了一个铝为负极,硫化银为正极的原电池,放置一段时间后银器即可恢复光亮。负极:2Al-6e-==2Al3+,正极:3Ag2S+6e-==6Ag+3S2-。电池反应为:2Al+3Ag2S+6H2O==6Ag+3H2S↑+2Al(OH)3↓。)
二 : 伏打电池的工作原理
伏打电池的锌电极在溶液中带有负电荷,是因为每个锌原子在锌板上留下两个电子后变为带两个正电荷的锌离子(Zn++)进入溶液中。使溶液中带正电,故锌板对溶液为负电位。而铜电极在稀硫酸溶液中不易溶解,放带电较锌电极弱得多,它对溶液的负电位远比锌电极对溶液的负电位在数值上小得多,所以铜电极的电位比锌电极电位高,正是这个电势差形成了伏打电池的电动势而成为化学电源。
由于伏打电池工作过程中,锌电极在硫酸溶液中溶解,同时生成硫酸锌和氢气。因而在锌电极附近有大量的氢气泡冒出,这些氢气泡一部分散发在大气中,一部分却积聚在铜电极上。因此在伏打电池工作过程中,在有电流通过闭合电路的同时,锌电极和硫酸溶液逐渐变为其他物质(硫酸体和水)。这样将使得两电极间电势差降低,即电池的电动势逐渐减小,这就是伏打电池工作持续性差的原因。
编者提示:本小实验可辅以“电磁学”部分的物理实验教学,以此培养和提高学生的实验能力和素养。
三 : 铿电池:铿电池-电池的工作原理,铿电池-电池的常用标准
化学电源俗称为电池,是一种利用物质的化学反应所释放出来的能量直接转化为电能的装置。顾名思义,电池是装电的电池,尤如水池,电池的电压及容量类似于水池的水位高低和蓄水量。电池电压的高低说明电池可能对外释放电能的多少,电池容量则说明电池所贮存电量的多少。任何电池都由四个部分组成,即由电极、电解质、隔离物及外壳组成。
化学电源俗称为电池,是1种利用物质的化学反应所释放出来的能量直接转化为电能的装置。顾名思义,电池是装电的
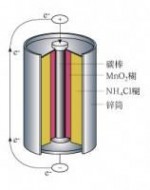
电极是电池的核心部分,一般由活性物质和导电骨架组成,活性物质是能够通过化学变化释放出电能的物质,导电骨架主要起传导电子和支撑活性物质的作用。电池内的电极又分为正(电)极和负(电)极。在电池标识标出“+”的一端为正极,标出“-”的一端为负极。
(www.61k.com]铿_铿电池 -电池的工作原理
电池使用过程电池放电过程,电池放电时在负极上进行氧化反应,向外提供电子,在正极上进行还原反应,从外电路接受电子,电流经外电路而从正极流向负极,电解质是离子导体,离子在电池内部的正负极之间的定向移动而导电,阳离子流向正极,阴离子流向负极。电池放电的负极为阳极,放电的正极为阴极,在阳极2类导体界面上发生氧化反应,在阴极的2类导体界面上发生还原反应。整个电池形成了1个由外电路的电子体系和电解质液的离子体系构成的完整放电体系,从而产生电能供电。
在化学电池中,化学能直接转变为电能是靠电池内部自发进行氧化、还原等化学反应的结果,这种反应分别在2个电极
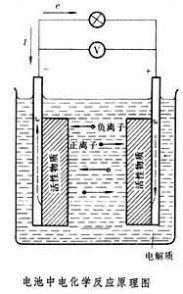
同时在电池内部,由于电解质中不存在自由电子,电荷的传递必然伴随两极活性物质与电解质界面的氧化或还原反应,以及反应物和反应产物的物质迁移。电荷在电解质中的传递也要由离子的迁移来完成。因此,电池内部正常的电荷传递和物质传递过程是保证正常输出电能的必要条件。充电时,电池内部的传电和传质过程的方向恰与放电相反;电极反应必须是可逆的,才能保证反方向传质与传电过程的正常进行。因此,电极反应可逆是构成蓄电池的必要条件。按照热力学原理,在等温等压下,电池体系所能输出的最大功即体系的自由能增量为
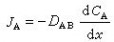
式中E为电池电动势(伏);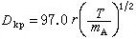
为吉布斯反应自由能增量(焦);F为法拉第常数=96500库=26.8安·小时;n为电池反应的当量数。这是电池电动势与电池反应之间的基本热力学关系式,也是计算电池能量转换效率的基本热力学方程式。实际上,当电流流过电极时,电极电势都要偏离热力学平衡的电极电势,这种现象称为极化。电流密度(单位电极面积上通过的电流)越大,极化越严重。极化现象是造成电池能量损失的重要原因之一。极化的原因有三:①由电池中各部分电阻造成的极化称为欧姆极化;②由电极-电解质界面层中电荷传递过程的阻滞造成的极化称为活化极化;③由电极-电解质界面层中传质过程迟缓而造成的极化称为浓差极化。减小极化的方法是增大电极反应面积、减小电流密度、提高反应温度以及改善电极表面的催化活性。
铿_铿电池 -电池的常用标准
IEC标准即国际电工委员会(International Electrical Commission),是由各国电工委员会组成的世界性标准化组织,其目的是为了促进世界电工电子领域的标准化。其中关于镍镉电池的标准为IEC285,关于镍氢电池的标准是IEC61436,锂离子电池目前IEC标准,一般电池行业依据的是SANYO或Panasonic的标准。
电池常用IEC标准有镍镉电池的标准为IEC602851999;镍氢电池的标准为IEC614361998.1;锂电池的标准为IEC619602000.11。
电池常用国家标准有镍镉电池的标准为GB/T11013_1996GB/T18289_2000;镍氢电池的标准为GB/T15100_1994GB/T18288_2000;锂电池的标准为GB/T10077_1998YD/T998_1999,GB/T18287_2000。
另外电池常用标准也有日本工业标准JIS C关于电池的标准及SANYOPANASONIC公司制定的关于电池企业标准。
铿_铿电池 -电池的主要特点
①可在电网或发电机不能或不易供电的场合提供直流电源;②工作时无噪声,携带方便;③由单体电池组成,可根据需要选用和组合。按照能量转换的方式,电池可分为:①利用电化学反应将化学能直接转换成电能的化学电池,这类电池种类很多,应用很广,统称化学电源;②利用光伏效应将太阳光能直接转换成电能的太阳电池;③利用塞贝克效应将热能直接转换成电能的温差发电器;④将原子核放射能直接转换为电能的核电池等。后三者都是利用物理效应,故又总称物理电源。
铿_铿电池 -电池的发展简史
1600年Gilbert(美国)建立对电池的研究基础。
1791年Gavani(意大利)提出“动物电”学说。
1800年Volta(意大利)制成了闻名当且沿袭至今的“伏打电堆”并介绍锌银电池堆。
1831年Farate(英国)宣布法拉第定律。
1836年Danide(英国)发明丹尼尔电池。
1840年Armstrong(英国)发明水力发电机。
1842年W.R.grove创制了氢-氧燃料电池。
1859年Plante(英国)发明铅酸电池 1870年采用西门子发电机将铅酸电池改为二次电池。
1866年Siemen(德国)对发电机进行改革。
1868年Leclanche(法国)研制成功Zn-MnO2电池并于1876年用树脂作粘结剂改进原电池。
1888年Gassner(美国)发明糊式勒克谢电池,其结构形式沿用至今。
1889年Jungner(瑞典)二次Zn-Ag电池。
1898年Jungner(瑞典)发明Cd-Ni碱性蓄电池。
1900年Jungner(瑞典)碱性Zn-MnO2电池研制成功。
1901年Jungner(瑞典)与Edison(美国)合作发明Fe-Ni碱性蓄电池。
1901年Michaelowski(俄罗斯)发明Zn-Ni电池。
1930年Drumm(爱尔兰)首先制备出实用的Zn-Ni电池。
1932年Ackermann(德国)发明了烧结式电极板。
1939年~1941年前苏联科学院院士A。H。ФPYMKUH研制成第一只实用型“氢-氧燃料电池”。
1947年Neumann(法国)成功研制成密封式Cd-Ni电池。
1950年前苏联、法、德 烧结式开口Cd-Ni电池开始生产、碱性MnO2电池商品化。
1960’S美、前苏联 研制成氢-镍电池。
1970’S(美国)Li-SOCL2、Li-SO2在美国军事及宇宙飞船上应用。
1984年(荷兰)飞立浦公司解决了LaNi5合金在充放电过程中的容量衰减问题,拉开了MH-Ni电池开发热潮。
1990年(日本)日本索尼公司宣布制成了锂离子蓄电池并于1992年商品化。
1994年(美国)美国Bellcore公司宣布研制成功聚合物锂离子电池。
铿_铿电池 -电池的分类
依外形区分
一般圆柱形 例:1号/2号/5号/7号等,适用于一般电子商品。
钮扣形 例:水银电池,适用于电子表、助听器等。
方形 例:9V电池,适用于无线麦克风、玩具等。
薄片形 例:太阳能电池板,适用于计算机、户外建物。
依使用次数区分
一次电池:用完即丢,无法重复使用者,如:碳锌电池、碱性电池、水银电池、锂电池。
二次电池:可充电重复使用者,如:镍镉充电电池、镍氢充电电池、锂充电电池、铅酸电池、太阳能电池。
依用途区分
工业用 例:工厂使用于产品内建者,属特定外型或多粒组成,如:电动工具、通讯用电池等。
消费性使用 例:一般消费者使用,可于市面购置更换者,使用量最多的为圆柱形凸头电池。
铿_铿电池 -电池的服务寿命
电池是1种化学物质,因而也是有一定服务寿命的,诸如干电池(包括普通的碱性电池)等一次电池是不能充电的,服务寿命当然只有一次。对于充电电池,一般我们以充电次数来衡量其服务寿命的长短。镍镉电池的循环使用寿命在 300~700 次左右,镍氢电池的可充电次数一般为 400~1000 次,锂离子电池为 500~800 次。充电电池的服务寿命不仅受制作电池采用的原料、 制作工艺等因素的影响,还与电池的充放电方法及实际使用情况有密切关系。例如,某人于1985 年开始使用的6节HITACHI (日立)镍镉电池,一直到现在都还在继续使用,只是电池容量有些降低了。看来,只要使用方法合理,充电电池是完全可以达到甚至大大超过标称的服务寿命的。
铿_铿电池 -电池的主要性能参数
电池的主要性能包括额定容量、额定电压、充放电速率、阻抗、寿命和自放电率。
额定容量在设计规定的条件(如温度、放电率、终止电压等)下,电池应能放出的最低容量,单位为安培小时,以符号C表示。容量受放电率的影响较大,所以常在字母C的右下角以阿拉伯数字标明放电率,如C20=50,表明在 20时率下的容量为50安·小时。电池的理论容量可根据电池反应式中电极活性物质的用量和按法拉第定律计算的活性物质的电化学当量精确求出。由于电池中可能发生的副反应以及设计时的特殊需要,电池的实际容量往往低于理论容量。
额定电压电池在常温下的典型工作电压,又叫标称电压。它是选用不同种类电池时的参考。电池的实际工作电压随不同使用条件而异。电池的开路电压等于正、负电极的平衡电极电势之差。它只与电极活性物质的种类有关,而与活性物质的数量无关。电池电压本质上是直流电压,但在某些特殊条件下,电极反应所引起的金属晶体或某些成相膜的相变会造成电压的微小波动,这种现象称为噪声。波动的幅度很小但频率范围很宽,故可与电路中自激噪声相区别。
充放电速率有时率和倍率2种表示法。时率是以充放电时间表示的充放电速率,数值上等于电池的额定容量 (安·小时)除以规定的充放电电流(安)所得的小时数。倍率是充放电速率的另1种表示法,其数值为时率的倒数。原电池的放电速率是以经某一固定电阻放电到终止电压的时间来表示。放电速率对电池性能的影响较大。
阻抗电池内具有很大的电极-电解质界面面积,故可将电池等效为1大电容与小电阻、电感的串联回路。但实际情况复杂得多,尤其是电池的阻抗随时间和直流电平而变化,所测得的阻抗只对具体的测量状态有效。
寿命储存寿命指从电池制成到开始使用之间允许存放的最长时间,以年为单位。包括储存期和使用期在内的总期限称电池的有效期。储存电池的寿命有干储存寿命和湿储存寿命之分。循环寿命是蓄电池在满足规定条件下所能达到的最大充放电循环次数。在规定循环寿命时必须同时规定充放电循环试验的制度,包括充放电速率、放电深度和环境温度范围等。
自放电率电池在存放过程中电容量自行损失的速率。用单位储存时间内自放电损失的容量占储存前容量的百分数表示。
原电池 经一次放电(连续或间歇)到电池容量耗尽后,不能再有效地用充电方法使其恢复到放电前状态的电池。特点是携带方便、不需维护、可长期(几个月甚至几年)储存或使用。原电池主要有锌锰电池、锌汞电池、锌空气电池、固体电解质电池和锂电池等。锌锰电池又分为干电池和碱性电池2种。
锌锰干电池制造最早而至今仍大量生产的原电池。有圆柱型和叠层型2种结构。其特点是使用方便、价格低廉、原材料来源丰富、适合大量自动化生产。但放电电压不够平稳,容量受放电率影响较大。适于中小放电率和间歇放电使用。新型锌锰干电池采用高浓度氯化锌电解液、优良的二氧化锰粉和纸板浆层结构,使容量和寿命均提高一倍,并改善了密封性能。
碱性锌锰电池以碱性电解质代替中性电解质的锌锰电池。有圆柱型和钮扣型2种。这种电池的优点是容量大,电压平稳,能大电流连续放电,可在低温(-40℃)下工作。这种电池可在规定条件下充放电数十次。
锌汞电池由美国S.罗宾发明,故又名罗宾电池。是最早发明的小型电池。有钮扣型和圆柱型2种。放电电压平稳,可用作要求不太严格的电压标准。缺点是低温性能差(只能在0℃以上使用),并且汞有毒。锌汞电池已逐渐被其他系列的电池代替。
锌空气电池以空气中的氧为正极活性物质,因此比容量大。有碱性和中性2种系列,结构上又有湿式和干式2种。湿式电池只有碱性1种,用NaOH为电解液,价格低廉,多制成大容量(100安·小时以上)固定型电池供铁路信号用。干式电池则有碱性和中性2种。中性空气干电池原料丰富、价格低廉,但只能在小电流下工作。碱性空气干电池可大电流放电,比能量大,连续放电比间歇放电性能好。所有的空气干电池都受环境湿度影响,使用期短,可靠性差,不能在密封状态下使用。
固体电解质电池以固体离子导体为电解质,分高温、常温2类。高温的有钠硫电池,可大电流工作。常温的有银碘电池,电压0.6伏,价格昂贵,尚未获得应用。已使用的是锂碘电池,电压2.7伏。这种电池可靠性很高,可用于心脏起搏器。但这种电池放电电流只能达到微安级。
锂电池以锂为负极的电池。它是60年代以后发展起来的新型高能量电池。按所用电解质不同分为:①高温熔融盐锂电池;②有机电解质锂电池;③无机非水电解质锂电池;④固体电解质锂电池;⑤锂水电池。锂电池的优点是单体电池电压高,比能量大,储存寿命长(可达10年),高低温性能好,可在-40~150℃使用。缺点是价格昂贵,另外电压滞后和安全问题尚待改善。
蓄电池 在部分或全部放电后能有效地用充电方法使其恢复到放电前状态的电池。蓄电池的特点是可以重复利用,并能输出较大电能。主要用途为汽车或飞机的起动电源,潜艇、煤矿车、工业叉车等的动力电源,电话交换机、照明、电力系统的应急电源,以及使用期较长的能源系统(如人造卫星、太阳能、风能等)的储能电源。
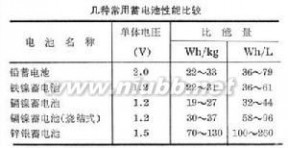
铅蓄电池最早发明而至今仍大量生产和应用的蓄电池。采用酸性电解质,原材料丰富,价格低,适用性好,但比能量低。采用低锑合金或铅钙合金板栅和优良的添加剂,并改进电池设计,已制成免维护铅蓄电池和密封型铅蓄电池。
镉镍蓄电池采用碱性电解质,有开口式、密封式和全密封式3种结构。按电极工艺分类,在压成式、极板盒式、烧结式等。以烧结式性能最好,能高倍率放电且循环寿命最长。全密封电池可供卫星使用。若以活性铁电极代替海绵镉电极即构成铁镍蓄电池。铁镍蓄电池价格较低,但充电效率低而且自放电率大,采用新型烧结式铁电极,性能已有所提高。
锌银蓄电池是蓄电池中比能量最高的1种,也可做成原电池和储备电池。这种蓄电池分为高倍率(7倍率以上)、中倍率(3.5~7倍率)、低倍率(3.5倍率以下)3种。性能良好但寿命较短,而且价格昂贵,只能用于特殊场合。为满足微电子器件的需要,已研制出1种钮扣式结构电池,可供电子手表、袖珍计算器和其他微电子器件使用。
储备电池 有2种激活方式,1种是将电解液和电极分开存放,使用前将电解液注入电池组而激活,如镁海水电池、储备式铬酸电池和锌银电池等。另1种是用熔融盐电解质,常温时电解质不导电,使用前点燃加热剂将电解质迅速熔化而激活,称为热电池。这种电池可用钙、镁或锂合金为负极,KCl和LiCl的低共熔体为电解质,CaCrO4、PbSO4或V2O5等为正极,以锆粉或铁粉为加热剂。采用全密封结构可长期储存(10年以上)。储备电池适于特殊用途。
标准电池 最著名的是惠斯顿标准电池,分饱和型和非饱和型2种。其标准电动势为 1.01864伏(20℃)。非饱和型的电压温度系数约为饱和型的1/4。
燃料电池 研究燃料电池的最初目的是使天然燃料经电化学氧化而发电,以提高能量转换效率,这个目的虽至今未获成功,却研制出可直接从特定燃料得到直流电流的燃料电池,如氢氧燃料电池,已用在航天器上。燃料电池按电解质不同分为:①离子交换膜电池;②石棉膜电池;③培根型电池(以浓 KOH为电解质)。人们正在研究地面应用的燃料电池,以磷酸为电解质,空气为氧化剂,燃料是天然碳氢化合物经重整和裂解后使用。此外还有肼燃料电池、甲醇燃料电池和高温燃料电池,均处于实验室研究阶段。
参考书目
徐国宪、章庆权:《新型化学电源》,国防工业出版社,北京,1984。
G.W.Vinal,Storage Batteries,4th ed.,Wiley,NewYork,1955.
铿_铿电池 -电池的安全性测试项目
内部短路测试
持续充电测试
过充电
大电流充电
强迫放电
坠落测试
从高处坠落测试
穿透实验
平面压碎实验
切割实验
低气压内搁置测试
热虐实验
浸水实验
灼烧实验
高压实验
烘烤实验
电子炉实
铿_铿电池 -电池型号
一般分为:1、2、3、5、7号,其中5号和7号尤为常用,所谓的AA电池就是5号电池,而AAA电池就是7号电池。AA、AAA都是说明电池型号的。AA就是我们通常所说的5号电池,一般尺寸为:直径14mm,高度49mm;AAA就是我们通常所说的7号电池,一般尺寸为:直径11mm,高度44mm。
说说常见的“AAAA,AAA,AA,A,SC,C,D,N,F”这些型号
AAAA型号少见,一次性的AAAA劲量碱性电池偶尔还能见到,一般是电脑笔里面用的。标准的AAAA(平头)电池高度41.5±0.5mm,直径8.1±0.2mm。
AAA型号电池就比较常见,一般的MP3用的都是AAA电池,标准的AAA(平头)电池高度43.6±0.5mm,直径10.1±0.2mm。
AA型号电池就更是人尽皆知,数码相机,电动玩具都少不了AA电池,标准的AA(平头)电池高度48.0±0.5mm,直径14.1±0.2mm。
只有1个A表示型号的电池不常见,这一系列通常作电池组里面的电池芯,我经常给别人换老摄像机的镍镉,镍氢电池,几乎都是4/5A,或者4/5SC的电池芯。标准的A(平头)电池高度49.0±0.5mm,直径16.8±0.2mm。
SC型号也不常见,一般是电池组里面的电池芯,多在电动工具和摄像机以及进口设备上能见到,标准的SC(平头)电池高度42.0±0.5mm,直径22.1±0.2mm。
C型号也就是二号电池,用途不少,标准的C(平头)电池高度49.5±0.5mm,直径25.3±0.2mm。
D型号就是一号电池,用途广泛,民用,军工,特异型直流电源都能找到D型电池,标准的D(平头)电池高度59.0±0.5mm,直径32.3±0.2mm。
N型号不常见,我还不知道啥东西里面用,标准的N(平头)电池高度28.5±0.5mm,直径11.7±0.2mm。
F型号电池,现在是电动助力车,动力电池的新一代产品,大有取代铅酸免维护蓄电池的趋势,一般都是作电池芯(个人见解:其实个太大,不好单独使用,呵呵)。标准的N(平头)电池高度89.0±0.5mm,直径32.3±0.2mm。
大家注意到,(平头)字样,指的是电池正极是平的,没有突起,使用做电池组点焊使用的电池芯,一般同等型号尖头的(可以用作单体电池供电的),在高度上就多了0.5mm。以此类推,我不逐一解释。还有,电池很多之际并不是规规矩矩的“AAA,AA,A,SC,C,D,N,F”这些主型号,前面还时常有分数“1/3,2/3,1/2,2/3,4/5,5/4,7/5”,这些分数表示的是池体相应的高度,例如“2/3AA”就是表示高是一般AA电池的2/3的充电电池;再如“4/5A”就是表示高是一般A电池的4/5的充电电池。
还有1种型号表示方法,是五位数字,例如,14500,17490,26500,前两位数字是指池体直径,后三位数字是指池体高,例如14500就是指AA电池,即大约14mm直径,50mm高。
铿_铿电池 -日常生活接触的电池及保养
手机电池
手机电池就其制造材料来分有3大类:镍镉电池、镍氢电池、锂离子电池。其中镍镉电池是第一代手机电池,它容量较低,有记忆效应,需要经常放电来维持容量,并且制造材料存在环境污染,目前这种电池已基本淘汰。第二代的镍氢电池容量较高,无记忆效应,制造材料对环境污染很少,人们习惯称其为环保电池。
目前手机电池的发展潮流是锂离子电池,其优点是:(1)无记忆效应,无需放电,使用时间长。(2)工作电压高。通常单体锂离子电池的电压为3.6V,镍氢,镍镉电池的电压为1.2V,相差3倍。(3)体积小、重量轻、比能量高。锂离子电池的比能量可达镍镉电池的2倍以上。与同容量镍氢电池相比,体积可减少30%,重量可降低50%。(4)寿命长。优质锂离子电池的寿命可达1200次以上,远远高于其他各类电池。(5)安全快速充电。锂离子电池因采用特殊的技术处理,因此允许在2小时之内快速充足电,而且安全性能大大提高。(6)允许工作温度范围宽。锂离子电池可在-20℃—60℃之间工作。高温放电性能优于其它各类电池。
那么如何鉴别真假锂电池呢?在非专业的条件下,可以采用以下的方法:同等容量的电池,锂电池比镍氢、镍镉电池手感要轻;用锂电池专用充电器对电池进行充电,若充电过程中电池发热,则是镍氢、镍镉电池,若温度无大的变化,则是锂电池;将电池正、负极“瞬间”短路后使用,如该电池“没电”则是锂电池,若仍“有电”则是镍氢、镍镉电池。
在使用锂电池中应注意的是,电池放置一段时间后则进入休眠状态,此时容量低于正常值,使用时间亦随之缩短。经过3—5次充电可激活电池,恢复正常容量。
当电池无意间短路时,锂电池内部保护电路会切断供电回路以确保使用者的安全,将电池取出重新充电便可恢复。
购买锂电池,应选择有售后服务,国际、国家认同的品牌电池,此种电池采用优质的原材料,具有完善的保护电路,外壳精美、耐磨、有防伪芯片,并与手机配合良好,可以达到良好的通讯效果。
笔记本电池
从电池的材料说起,目前笔记本电脑使用的电池主要分3种:1.镍铬电池、2.镍氢电池、3.锂电池;它们一般表示为:镍镉NI-CD、镍氢NI-MH、锂电LI。
笔记本电池维护:
1.激活新电池
厂商通用的做法是新笔记本在第一次开机时电池应带有3%的电量,此时,应该先不使用外接电源,而是把电池里的余电用尽,直至关机,然后再用外接电源充电。然后还要把电池的电量用尽后再充,充电时间一定要超过12小时,反复做三次,以便激活电池。
2.尽量减少使用电池的次数
电池的充放电次数直接关系到寿命,每充一次,电池就向退役前进了1步。建议大家尽量使用外接电源,使用外接电源时应将电池取下。如果经常在一天中多次插拔电源,且笔记本电脑装有电池,对电池的损坏更大。因为每次外接电源接入就相当于给电池充电一次,电池自然就折寿了。
3.电量用尽后再充电和避免充电时间过长
不管笔记本使用锂电还是镍氢电,一定要将电量用尽后再充(电量低于1%),这是避免记忆效应的最好方法。锂电同样会有记忆效应,只是它的记忆效应比镍氢小一些罢了,只到电池的电量完全使用完之后才给它充电。部分的充、放电可能导致电池里面各电芯的化学性能不一致,因而电池性能会退降。
建议每隔几个月对电池进行一次深度放电以优化电池的性能。具体做法就是用电池供电,一直使用到电池容量为0%(这时系统会自动进入休眠或待机状态,根据BIOS中设置不同)。然后接上交流充电器一直充满到100%为止。 电池经过长时间的存放,而电池都有1个自然的放电过程,已经自然放电完了,这并不影响电池的容量。第一次充电时,你应该连续地把电池充电到十二个小时,并且循环地完全充、放电三次(参阅电池保养一节)以完全地唤醒新电池,如果这块电池被存放了几个月没有使用,建议也对它进行三次完全的充、放电。如果一块电池经连续十二个小时之后或三次循环充放电之后仍然不能充电,这块电池就不能使用需要更换了。
电动自行车电池
目前的电动自行车电池大部分都是铅酸电池,主要注意事项如下:1、用完后要及时充电,不能没电状态下长时间放置,否则电池极板就硫酸盐化了;2、绿灯亮了,表示电池可以使用或基本上充足电了,但离100%还有差距,建议每周或每两周对电池作一次长时间充电,即绿灯亮了以后继续充,时间可以控制在16小时左右,这样可提高电池寿命;3、注意检查胎压,夏天可适当低一些,其他季节可以搞一些,胎压高比较省电;4、将电完全放掉后再充电的观念是不正确的,放电深度越大,电池使用寿命越短;5、如果电电动自行车长时间不使用,要注意对电池充电后再放置,每月检查一下电量;6、如果不是电摩,最好不要加防盗器,效果不大,且增加电池的负担;7、如果你每天骑行的距离为15公里左右,估计你的电池可以使用2年;8、如果充电中发现电池特别热,别再充了!赶快去检修。
电动自行车用电池的维护保养
(1)电池在电动自行车上的安装要牢固,以防骑行时电池受震动损坏。
(2)经常清除电池盒上的灰尘、污物,注意保持电池干燥、清洁,以防电池自行放电。
(3)电池不要靠近高温热源。高温季节,严禁在阳光直接暴晒(夏季存车时尤其要注意)。充电时要注意良好通风。
(4)电动自行车刚启动时,要用脚踏助力启动,以免放电电流过大而损坏电池;骑行时,要注意不能让电池过放电,过放电容易引起电池严重亏电,从而大大的缩短其使用寿命。
(5)电动自行车的载重量过大,必然导致电机电流的增大,引起电池过放电,电池早期衰减,严重影响电池的寿命。我们公司推出了大功率电机配置大容量电池的电动车,目的是为了解决出行途中经常遇到的大坡度问题。但有些消费者一味追求电动自行车的载重能力,尤其是骑车带人,如下面的图片所示,不仅严重违反了交通法规,对电动自行车本身的维护是不利的。
(6)电池在使用过后就可以充电,随用随充可保证下一次出行的顺利。电池不用时应充足电后贮存,至少三个月充电补充电一次,以免电池造成不可逆硫酸盐化。
(7)如发现电池破裂,电液渗漏是,应更换电池,以免造成酸液腐蚀。
(8)电池的电解液具有腐蚀性,请勿沾到皮肤及衣服上,更忌溅入眼内。如遇上述情况,要立即用清水冲洗,并立即送往医院诊治。
铿_铿电池 -电池的选购、存放、使用
选购电池
(1)首先应根据电器的要求,选择电池类型和规格尺寸,并根据用电器具耗电大小和特点,决定购买哪1种类型的电池,如BP机一般选用碱性锌锰电池,遥控器一般选用普通锌锰电池就可满足使用要求;(2)优选电池行业管理部门推荐的产品,购买市场销量大、品质上乘的名牌电池;
(3)注意查看电池的保质期,购买近期生产的电池,对于那些采用代吗表明保质期的电池一般购买时难以辨认,应加询问;
(4)注意查看电池外观,有无漏液迹象;
(5)商标上应标明生产厂家、电池极性、电池型号、公称电压、商标等,购买碱锰电池时应看型号或有无ALKALINE或LR字样。
存放电池
一般电池内部均存在自放电现象,俗称“跑电”,电池的存放时间及存放环境特别是温度对其有较大影响,通常存放时间越长,温度越高,电池“跑电”就越多;温度越高,湿度越大,还会使电池导电触头生锈而不易使用,且也增加电池的“跑电”,所以电池的存放条件为:
(1)电池存放区应清洁、凉爽、通风;
(2)温度应在10~30℃之间,一般不应超过40℃;相对湿度一般不大于65%为宜。
(3)存放时间不易过长,存放时应排列整齐,切勿正、负极相连,造成电池的短路。
使用电池注意事项
(1)检查电器和电池接触件是否清洁,必要时用湿布擦净,待干燥后按正确极性装入;
(2)不要将新旧电池混用,同1种型号但不同种类的电池也不能混用;
(3)不能用加热、充电或其它的方法使一次电池再生;
(4)不能将电池短路;
(5)不要拆卸电池、不要加热电池;
(6)用电器具使用之后应切断开头,长期不用应取出电池。
铿_铿电池 -废电池的处理
2003年11月正式公布的《废电池污染防治技术政策》澄清了人们在废旧电池处理上的一系列认识误区。这一政策还禁止对已收集的各种废电池进行焚烧处理。
由国家环境保护总局和国家发展与改革委员会、建设部、科技部、商务部联合制定并于2003年10月9日出台的《废电池污染防治技术政策》是一份指导性文件,自发布之日起实施。国家环保总局于11月27日上午召开新闻发布会,正式对外公布了这一技术政策。它适用于废电池的分类、收集、运输、综合利用、贮存和处理处置等全过程污染防治的技术选择,指导相应设施的规划、立项、选址、施工、运营和管理,引导相关环保产业的发展。
废电池污染防治技术政策
1. 总则铿_铿电池 -配图




干电池
纽扣电池
方形电池
镍镉电池
铿_铿电池 -相关连接
四 : 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O,
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。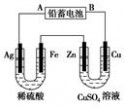 (1)A是铅蓄电池的极,铅蓄电池正极反应式为,放电过程中电解液的密度(填“减小”、“增大”或“不变”)。 (2)Ag电极的电极反应式是,该电极的电极产物共g。 (3)Cu电极的电极反应式是,CuSO4溶液的浓度(填“减小”、“增大”或“不变”) (4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示。  a.各U形管中产生的气体的体积 b.各U形管中阳极质量的减少量 c.各U形管中阴极质量的增加量 |
| (1)负 PbO2+4H++SO42-+2e-=PbSO4+2H2O 减小 (2)2H++2e-=H2↑ 0.4 (3)Cu-2e-=Cu2+不变 (4)b |
| 根据在电解过程中铁电极质量的减少可判断A是电源的负极,B是电源的正极,电解时Ag极作阴极,电极反应式为2H++2e-=H2↑,Fe作阳极,电极反应式为Fe-2e-=Fe2+,左侧U形管中总反应式为Fe+2H+=Fe2++H2↑。右侧U形管相当于电镀装置,Zn电极作阴极,电极反应式为Cu2++2e-=Cu,铜电极作阳极,电极反应式为Cu-2e-=Cu2+,电镀过程中CuSO4溶液的浓度保持不变,根据上述分析可得答案。 |
考点:
考点名称:一次电池电源:
化学电源化学电源是能够实际应用的原电池,化学电池是将化学能转变成电能的装置,它包括一次电池、二次电池和燃料电池等几大类。
一次电池:
(1)普通锌锰干电池构造简单,价格便宜,但放电时间短,放电后电压下降较快。
负极:
正极: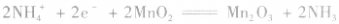

总反应式: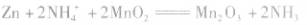
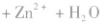
(2)碱性锌锰电池比普通锌锰干电池性能优越,比能量和可储存时间均有提高,适用于大电流和连续放电。负极是 正极是
正极是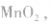 电解质是
电解质是
负极: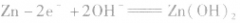
正极:
总反应式:

(3)锂电池
用金属锂作负极,石墨作止极,电解质溶液由四氯化铝锂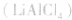 溶解在亚硫酰氯
溶解在亚硫酰氯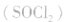 组成。
组成。
负极:
正极: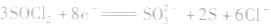
总反应式:
(4)锌银电池
负极是Zn,正极是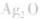 ,电解质是KOH。
,电解质是KOH。
负极: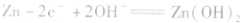
正极:
总反应式:
这种电池比能量大,电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式微型电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
原电池正、负极的判断方法:
原电池有两个电极,一个是正极,一个是负极,判断正极和负极的方法有以下几种。
1.由组成原电池的两极材料判断一般相对较活泼的金属为负极,相对不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向判断在外电路,电流由正檄流向负极;电子由负极流向正极
3.根据原电池里电解质溶液中离子的定向移动方向判断在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。
4.根据原电池两极发生的变化来判断原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
5.X极增重或减轻工作后,X极质量增加,说明X极有物质析出,X 极为正极:反之,X极质量减少,说明X极金属溶解,X 极为负极
6.X极有气泡冒出工作后,x极上有气泡冒出,一般是发生了析出H,的电极反应,说明x极为正极。
7.X极附近pH的变化析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而工作后,X极附近pH增大了,说明X极为正极。
8.特例在判断金属活泼性的规律中,有一条为“当两种金属构成原电池时,活泼金属作负极,不活泼金属作正极”,但这条规律也有例外情况,如Mg和Al为原电池的两极,KOH为电解质溶液时,虽然Mg比Al活泼,但因Mg不和KOH反应,所以Mg作原电池的正极等。



原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转化成电能的化学电池。
(1)氧氧燃料电池以氢气为燃料(作负极),以氧气为氧化剂(作正极),可用酸性电解质(如稀H2SO4),也可用碱性电解质(如KOH)。
①若电解质是酸性的,在电极反应式中不能出现OH-。
负极:
正极: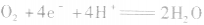
总反应式:
②若电解质是碱性的,在电极反应式中不能出现H+。
负极: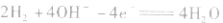
正极:
总反应式:
(2)甲烷一氧气燃料电池
若将金属铂片插入KOH溶液中作电极,在两极上分别通入甲烷和氧气。
负极:
正极: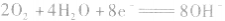
总反应式:
新型化学电源的考查及解题指导:
近几年高考试题中出现的新型电池,有“氢镍电池”“高铁电池”“锌一锰碱性电池”、我国首创的“海洋电池”“燃料电池”(如新型细菌燃料电池、CO燃料电池)、“锂离子电池”“银锌电池~纽扣电池”等。这些电池一般具有高能环保、经久耐用、电压稳定、比能量 (单位质量释放的能量)高等特点。取材于这些知识点的试题,由于题材广、信息新、陌生度大,所以,大多数考生认为这类试题难度大,而难在何处又十分迷茫。实际上这些题目主要考查的是学生对信息的迁移应用能力。具体有以下几个考查角度:
1.新型电池“放电”时正、负极的判断
2.新型电池“放电”时,电极反应式的书写首先根据电池反应分析物质得失电子情况,然后再考虑电极反应生成的物质是否跟电解质溶液巾的离子发生反应;对于较复杂的电极反应,可以利用总反幢方程式减去较简单一极的电极反应式,从而得到较复杂一极的电极反应式。
3.新型电池“充电”时阴、阳极的判断首先明确原电池放电时的正、负极,再根据充电时,阳极接正极、阴极接负极的原理进行分析。
4.新型电池充、放电时,电解质溶液中离子移动方向的判断首先分清电池是放电还是充电;再判断正、负极或阴、阳极,进而可确定离子的移动方向。
五 : 原电池的工作原理_

原电池原理 原电池的工作原理_

原电池原理 原电池的工作原理_
原电池原理 原电池的工作原理_

原电池原理 原电池的工作原理_
原电池原理 原电池的工作原理_

原电池原理 原电池的工作原理_
原电池原理 原电池的工作原理_
原电池原理 原电池的工作原理_

原电池原理 原电池的工作原理_

原电池原理 原电池的工作原理_
(www.61k.com] 本文标题:原电池的工作原理-原电池的工作原理61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1