一 : 关于蛋白酶和肽酶对肽键的不同分解作用
常有人望文生义,认为蛋白酶只水解二硫键,破坏蛋白质结构,不可以分解肽键,其实不然!去年的北京春季高考题中,就有一题考的是胰蛋白酶和糜蛋白酶一起可以消化蛋白质。二 : 胰蛋白酶的作用
胰蛋白酶是什么东西?有什么作用啊?
临床上用于脓胸、血胸、外科炎症、溃疡、创伤性损伤、瘘管等所产生的局部水肿、血肿及脓肿等。喷雾吸入,用于呼吸道疾病。也可用于治疗毒蛇咬伤。还常用于动物细胞培养前对组织的处理。
胰蛋白酶为蛋白质水解酶,能选择地水解蛋白质中由赖氨酸或精氨酸的羧基所构成的肽链,能消化溶解变性蛋质,对未变性的蛋白质无作用,因此,能使脓、痰液、血凝块等分解、变稀,易于引流排除,加速创面净化,促进肉芽组织新生,此外还有抗炎症作用。
三 : 钙蛋白酶的作用
钙蛋白酶 -作用 骨骼肌生长 骨骼肌钙蛋白酶存在于肌细胞内部,在Z线中浓度最高。快速萎缩肌肉中钙蛋白酶活性是正常肌肉的数倍,它的一个特征是Z线的降解,而肌动蛋白和肌球蛋白保持完整。肌原纤维蛋白质降解的第1步必须是肌原纤维解装配成肌丝。大量研究表明,钙蛋白酶系统参与这一解装配过程。钙蛋白酶引发肌原纤维蛋白质降解的可能机制如下:钙蛋白酶使Z线(使细肌丝固着于肌原纤维)和肌联蛋白、伴肌动蛋白(使粗肌丝和细肌丝固着于肌原纤维)降解,肌原纤维释放出肌丝。细肌丝的肌原蛋白和原肌球蛋白以及粗肌丝的C-蛋白降解,粗肌丝和细肌丝分别解离出肌球蛋白和肌动蛋白,释放出的粗肌丝和细肌丝可与母体或其他肌原纤维重新装配,也可被胞质蛋白酶或溶酶体组织蛋白酶降解成氨基酸。肌原纤维的残留部分功能完整,收缩力量减弱。
四 : 角蛋白酶对羊毛蛋白酶防毡缩整理的促进作用
摘要 采用Bacillussubtilis产角蛋白酶与蛋白酶一浴法处理羊毛,研究处理后羊毛织物的毡缩率、减量率、强力、润湿性及纤维直径等指标的变化,测试羊毛和羊毛角蛋白水解液中蛋白多肽的释放速率。结合羊毛的溴AllwSrden现象,通过SEM观察,考察2种酶协同对蛋白质的降解作用、对羊毛防毡缩性能的影响和对羊毛鳞片的去除效果。与单独使用角蛋白酶或蛋白酶处理相比,经角蛋白酶和蛋白酶一浴法处理后的羊毛织物毡缩率明显降低,可达到
机可洗的要求,但织物的减量率较高,强力下降,纤维直径减小。水解液中蛋白多肽浓度变化显示,一浴法能有效提高蛋白多肽的释放速率,并且蛋白酶对角蛋白酶的结构稳定性没有明显影响。羊毛溴Allw6rden现象和润湿性测试结果表明,鳞片表层类脂已基本去除。SEM观察结果显示羊毛鳞片已基本剥离。研究结果表明,角蛋白酶能促进蛋白酶对羊毛鳞片的降解,二者协同作用能有效去除羊毛鳞片。
(www.61k.com)关键词 角蛋白酶;蛋白酶;羊毛织物;防毡缩
羊毛的毡缩性与其表面的鳞片层结构密切相关。羊毛鳞片细胞由外到内可分为3层:位于鳞片最外层的鳞片表层,由疏水性极强的单层类脂和少量含有二硫键和酰胺键交联的蛋白质构成;鳞片外层是羊毛鳞片的主要组成部分,由角质化的蛋白质构成,由于胱氨酸二硫键的高度交联和分子间的疏水作用以及氢键作用导致其结构稳定,难以被一般的蛋白酶降解;鳞片内层由含硫量很低的非角质化蛋白质构成,化学性质活泼,易于被化学试剂、水等膨胀,可被蛋白酶分解¨。羊毛防毡缩整理的关键是分解鳞片外层的角质化蛋白质,即角蛋白。一般的蛋白酶不能降解羊毛鳞片外层的角蛋白,因此必须对羊毛进行氧化或还原等预处理,存在处理步骤复杂、成本高、处理不均匀、环境污染等问题。
角蛋白酶(keratinase)是专一性降解角蛋白的一类蛋白酶,由真菌、放线菌或细菌等多种微生物产生,能将羽毛、羊毛、头发和指甲等不溶性底物降解。角蛋白酶对角蛋白的降解机制非常复杂,目前还没有定论,普遍认为其降解过程可分为3个步骤:首先是破坏角蛋白分子中的二硫键,使其高级结构解体形成变性角蛋白,从而丧失不溶性和抗酶解的能力;然后水解变性角蛋白,生成多肽、寡肽和游离氨基酸;最后通过转氨基作用生成氨和硫化物,使角蛋白彻底分解。国内外已有多名学者对角蛋白酶的降解作用进行了研究。Khardenavis等用沙雷氏菌培养的角蛋白酶降解家禽羽毛,5d后羽毛能完全降解;Daroit等¨用亚马逊河鲳鱼体内分离出的杆菌培养的角蛋白酶降解羽毛,48h即可基本降解羽毛;张奇等将具有降角蛋白能力的芽孢菌株接种到羊毛和鸡毛的混合培养基上,发现该菌株分泌的角蛋白酶对羊毛具有较好的降解效果。
本文采用Bacilussubtilis产角蛋白酶和蛋白酶一浴法处理羊毛,通过毡缩率、减量率、SEM照片等一系列指标或方法考察其对羊毛表面鳞片的去除作用和对羊毛防毡缩性能的影响。
1试验部分
1.1试验材料
女衣呢白坯布(线密度为33tex×33tex,经密为356根/10em,纬密为226根/10em,面密度为220g/m,无锡协新毛纺厂);羊毛纤维(美利奴羊毛,直径为21.5~25m,平均长度为10cm,无锡百芳毛纺厂);Bacillussubtilis产角蛋白酶(19U/mL,浙江树人大学生物与环境工程学院提供);蛋白酶Savinase16L(20000U/mL,诺维信公司);三(羟甲基)氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、HCI(37%)(国药化学试剂有限公司,分析纯);二硫苏糖醇(DTT)(美国Sigma公司);纺织品试验专用标准合成洗涤剂(上海白猫专用化学品有限公司)。
摘要 采用Bacillussubtilis产角蛋白酶与蛋白酶一浴法处理羊毛,研究处理后羊毛织物的毡缩率、减量率、强力、润湿性及纤维直径等指标的变化,测试羊毛和羊毛角蛋白水解液中蛋白多肽的释放速率。结合羊毛的溴AllwSrden现象,通过SEM观察,考察2种酶协同对蛋白质的降解作用、对羊毛防毡缩性能的影响和对羊毛鳞片的去除效果。与单独使用角蛋白酶或蛋白酶处理相比,经角蛋白酶和蛋白酶一浴法处理后的羊毛织物毡缩率明显降低,可达到
机可洗的要求,但织物的减量率较高,强力下降,纤维直径减小。水解液中蛋白多肽浓度变化显示,一浴法能有效提高蛋白多肽的释放速率,并且蛋白酶对角蛋白酶的结构稳定性没有明显影响。羊毛溴Allw6rden现象和润湿性测试结果表明,鳞片表层类脂已基本去除。SEM观察结果显示羊毛鳞片已基本剥离。研究结果表明,角蛋白酶能促进蛋白酶对羊毛鳞片的降解,二者协同作用能有效去除羊毛鳞片。
关键词 角蛋白酶;蛋白酶;羊毛织物;防毡缩
羊毛的毡缩性与其表面的鳞片层结构密切相关。羊毛鳞片细胞由外到内可分为3层:位于鳞片最外层的鳞片表层,由疏水性极强的单层类脂和少量含有二硫键和酰胺键交联的蛋白质构成;鳞片外层是羊毛鳞片的主要组成部分,由角质化的蛋白质构成,由于胱氨酸二硫键的高度交联和分子间的疏水作用以及氢键作用导致其结构稳定,难以被一般的蛋白酶降解;鳞片内层由含硫量很低的非角质化蛋白质构成,化学性质活泼,易于被化学试剂、水等膨胀,可被蛋白酶分解¨。羊毛防毡缩整理的关键是分解鳞片外层的角质化蛋白质,即角蛋白。一般的蛋白酶不能降解羊毛鳞片外层的角蛋白,因此必须对羊毛进行氧化或还原等预处理,存在处理步骤复杂、成本高、处理不均匀、环境污染等问题。
角蛋白酶(keratinase)是专一性降解角蛋白的一类蛋白酶,由真菌、放线菌或细菌等多种微生物产生,能将羽毛、羊毛、头发和指甲等不溶性底物降解。角蛋白酶对角蛋白的降解机制非常复杂,目前还没有定论,普遍认为其降解过程可分为3个步骤:首先是破坏角蛋白分子中的二硫键,使其高级结构解体形成变性角蛋白,从而丧失不溶性和抗酶解的能力;然后水解变性角蛋白,生成多肽、寡肽和游离氨基酸;最后通过转氨基作用生成氨和硫化物,使角蛋白彻底分解。国内外已有多名学者对角蛋白酶的降解作用进行了研究。Khardenavis等用沙雷氏菌培养的角蛋白酶降解家禽羽毛,5d后羽毛能完全降解;Daroit等¨用亚马逊河鲳鱼体内分离出的杆菌培养的角蛋白酶降解羽毛,48h即可基本降解羽毛;张奇等将具有降角蛋白能力的芽孢菌株接种到羊毛和鸡毛的混合培养基上,发现该菌株分泌的角蛋白酶对羊毛具有较好的降解效果。
本文采用Bacilussubtilis产角蛋白酶和蛋白酶一浴法处理羊毛,通过毡缩率、减量率、SEM照片等一系列指标或方法考察其对羊毛表面鳞片的去除作用和对羊毛防毡缩性能的影响。
1试验部分
1.1试验材料
女衣呢白坯布(线密度为33tex×33tex,经密为356根/10em,纬密为226根/10em,面密度为220g/m,无锡协新毛纺厂);羊毛纤维(美利奴羊毛,直径为21.5~25m,平均长度为10cm,无锡百芳毛纺厂);Bacillussubtilis产角蛋白酶(19U/mL,浙江树人大学生物与环境工程学院提供);蛋白酶Savinase16L(20000U/mL,诺维信公司);三(羟甲基)氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、HCI(37%)(国药化学试剂有限公司,分析纯);二硫苏糖醇(DTT)(美国Sigma公司);纺织品试验专用标准合成洗涤剂(上海白猫专用化学品有限公司)。
1.2试验仪器
Y(B)089A型全自动缩水率试验机(温州大荣纺织仪器有限公司),DZ3视频变焦显微镜(日本Union公司),Quanta200扫描电子显微镜(荷兰FEI公司),2XA生物显微镜(上海光学仪器厂),DSAIO0型液滴形状分析仪(德国KR~SS公司),UV一2802S扫描型紫外/可见分光光度计(美国Unico公司),YG(B)026D一250型电子织物强力仪(温州大荣纺织仪器有限公司),WHYF一2F恒温振荡水浴锅(台湾瑞比公司),TDL40B高速离心机(上海安亭科学仪器厂)。
1.3处理工艺
角蛋白酶处理:酶用量为50%(O.W.f),Tris/HC1缓冲溶液(pH值为8.5),JFC1g/L,浴比为1:25,55℃处理1h。处理后试样充分净洗,50℃烘干。
蛋白酶处理:酶用量为2%(O.W.f),Tris/HC1缓冲溶液(pH值为8.5),JFC1g/L,浴比为1:25,50℃处理1h,处理后高温灭酶,净洗,50℃烘干。
角蛋白酶、蛋白酶一浴法处理:角蛋白酶%(O.W.f),蛋白酶2%(O.W.f),JFC1g/L,Tris/HC1缓冲溶液(pH值为8.5),浴比为1:25,55℃处理1h,处理后高温灭酶,净洗,5O℃烘干。
1.4羊毛角蛋白溶液的制备
称取洗净的羊毛纤维1g,剪碎,以10mL含0.7g十二烷基磺酸钠(SDS)、4.8g尿素及0.35g二硫苏糖醇(DTT)的水溶液于50℃提取5h,过滤除去不溶物,过滤后的溶液以去离子水透析3d,除去小分子物质即得角蛋白溶液。
1.5角蛋白酶活力测定
将角蛋白酶发酵液离心过滤,取1mL上清液,加入2.0mL浓度为0.05moL/L的Tris/HC1缓冲溶液(pH值为8.5),再加入10mg洗净的羊毛纤维,在40℃恒温振荡水浴中反应1h后取出,加入2.0mL10%的三氯乙酸终止反应。室温下4000r/min离心15min,取上清液测定280nm波长处吸光度。参照样在反应前加三氯乙酸终止液,其他与测试样相同。
酶活力定义:4:舳值每增加0.1为1个活力单位(U)。
1.6羊毛织物毡缩率测定
参照GB8628-1988《测定织物尺寸变化时试样的准备、标记和测量》、GB8629-1988《纺织品试验时采用的家庭洗涤及干燥程序》及IWSTMNO.31《测定羊毛、含羊毛纺织品和半成品的松弛和毡化》方法,计算织物面积毡缩率R=(洗涤前后面积差/洗涤前面积)×100%
1.7羊毛织物减量率测定
羊毛的减量率计算公式为 减量率=(处理前干态质量—处理后干态质量)/处理前干态质量×100%
羊毛处理后的干态质量用烘干称量法测定:羊毛经酶处理后,在砂芯漏斗中清水洗净过滤,将洗净后的羊毛连同过滤后的砂芯漏斗在105℃烘至恒重,最后用电子天平称得羊毛处理后的干态质量。
羊毛处理前的干态质量则采用回潮率计算。回潮率测定参照GB9994-1988《纺织材料公定回潮率》。
处理前干态质量=处理前湿态质量×(1/(1+回潮率))
1.8羊毛织物断裂强力测定
参照GB/T3923.1一l997《纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法》,在YG(B)026D一250型电子织物强力仪上测试。
1.9纤维直径测定
纤维直径按照ZBW21003-1986的显微镜法进行测试。
1.10蛋白多肽释放速率测试
在酶处理过程中,每隔10min于A=280nm处测试酶解液的吸光度。为排除水解液中悬浮物对测试结果的影响,另测试水解液在A:=310nin处的吸光度(蛋白质在该处没有吸收),由二者吸光度差绘制蛋白多肽吸光度一时间曲线。
1.11羊毛的溴Allw6rden反应
取羊毛数根置于载玻片上并加盖玻片,在视频显微镜下调焦观察,直到纤维清晰可见,从盖玻片边缘滴入饱和溴水,并开始计时,2min后拍摄照片。显微镜放大1400。
1.12羊毛织物润湿性测试
润湿时间测定参照AATCC39—1980《织物润湿性评价》,记录20L去离子水在织物表面被完全吸收所需时间(min)。润湿接触角测定使用DSA100液滴形状分析仪,记录20L去离子水滴至织物上20s时水滴在织物表面所形成的接触角,测试5次取平均值。
1.13SEM观察
将纤维表面镀金后,采用Quanta200进行测试,电压为5kV,放大倍数为2400。
2结果与讨论
2.1不同处理工艺对羊毛防毡缩效果的影响试验考察了不同工艺处理后羊毛织物的毡缩率,结果如图1所示。
从图1可看出,未处理羊毛织物的毡缩率在35%以上,单独角蛋白酶处理样的毡缩率仅略有下降。这可能是因为角蛋白酶降解底物的过程相当缓慢,如Thermoanaerobacter产角蛋白酶处理羊毛10d后才能达到很好的降解效果。单独使用蛋白酶处理样的毡缩率为18.1%,2种酶一浴法处理后,织物的毡缩率下降到4.46%,防毡缩性能显著提高,已达到机可洗效果¨。因为角蛋白酶可使羊毛鳞片外层的角蛋白丧失不溶性和抗酶解的能力,蛋白酶可在角蛋白酶作用鳞片处进一步降解鳞片内层含硫量很低的非角质化蛋白质,2种酶的协同作用能使羊毛鳞片充分降解,因此织物防毡缩性能提高。
2.2不同处理工艺对织物减量率的影响
经测试计算得知,单独使用角蛋白酶和蛋白酶处理织物的减量率仅为1.03%和2.44%,而角蛋白酶+蛋白酶一浴法处理织物的减量率达12.39%。分析原因可能为:角蛋白酶对鳞片的降解以变性作用为主,即使角蛋白的二硫键断裂形成变性角蛋白,而转氨基和水解作用不明显,变性角蛋白未进一步降解,因此单独角蛋白酶处理的羊毛织物减量不大;而角蛋白酶对鳞片的变性作用能增加蛋白酶的可及度,促进蛋白酶对鳞片的降解;因此二者一浴法能有效降解鳞片蛋白,羊毛织物减量明显。
2.3不同处理工艺对织物强力的影响
羊毛强力的损失主要与纤维皮质层的损伤有关。由于蛋白酶对表层蛋白的水解速度较慢,所以水解作用首先从鳞片内层的细胞间复合物(CMC)开始逐渐过渡到外层,从而造成羊毛的内部损伤,表现为织物强力下降。表1示出不同工艺处理后织物的强力和纤维直径。
从表1可看出:单独使用角蛋白酶处理后,织物强力相比未处理样降低了3.9%;单独使用蛋白酶处理后,织物强力下降到358N,强力损失为21.8%;使用2种酶一浴法处理后强力下降较多,强力损失率达到34.7%,纤维直径变化也较为明显。
分析原因可能为:单独使用角蛋白酶处理只对鳞片的二硫键产生破坏,作用不到鳞片内层的细胞间复合物,内部皮质层未受损伤,因此强力下降不多,鳞片未降解,纤维直径变化较小;角蛋白酶+蛋白酶的协同作用对鳞片的内外层以及细胞间复合物均有破坏,纤维内部的无定形区与交联较少的区域也可能被蛋白酶水解,损伤触及到了内部皮质层,因此织物强力损伤严重,羊毛纤维也由于鳞片的降解而变细,直径减小。这也是一浴法存在的最大问题,需进一步优化2种酶的比例和用量,以期降低强力损伤,并获得理想的毡缩率。
2.4不同处理工艺对蛋白多肽释放速率影响
测试了不同酶处理工艺对羊毛纤维和羊毛角蛋白溶液的降解作用,水解液中蛋白多肽含量随处理时间的变化如图2、3所示。
从图2可看出,羊毛酶解液中蛋白多肽含量随处理时间的延长而逐渐增加。单独使用蛋白酶处理和角蛋白酶+蛋白酶一浴法处理水解液的初始蛋白多肽含量相同,且高于单独使用角蛋白酶处理的水解液,但一浴法处理的水解液中蛋白多肽增长速率明显更快。这表明角蛋白酶对蛋白酶的水解有促进作用,能使蛋白酶酶解效率提高,对羊毛的降解效果更好。
为进一步探讨2种酶一浴法的协同作用,采用羊毛角蛋白溶液作为底物进行酶解测试。因为角蛋白为角蛋白酶的特异性降解底物,而蛋白酶因为角蛋白中高含量的二硫键结构,对其没有降解作用。
由图3可知:蛋白酶对羊毛角蛋白溶液的降解效果很差,多肽的释放速率非常慢;角蛋白酶对角蛋白溶液有较高的降解速率;二者一浴后,角蛋白多肽的释放速率相比单独使用角蛋白酶的明显更快。由此推测一浴法的协同效应其实就是角蛋白酶对角蛋白二硫键断裂的变性作用,使得角蛋白高级结构解体,变性成为能被蛋白酶降解的底物,所以尽管单独使用蛋白酶对角蛋白底物没有降解作用,但在角蛋白酶存在的水溶液中,蛋白酶可降解变性后的角蛋白,使一浴法中蛋白多肽的释放速率提高。这同时也可证明蛋白酶对角蛋白酶的结构稳定性没有明显的影响,因为如果角蛋白酶被蛋白酶破坏或降解,那么2种酶一浴法的多肽释放速率曲线应与单独使用蛋白酶的相似,不可能出现角蛋白多肽释放速率反而提高的现象。
2.5不同工艺处理后羊毛的溴AllwOrden现象
当羊毛纤维浸入饱和溴水中时,纤维表面会出现很多囊泡,这种现象被称为溴Allwtirden反应。如果羊毛的外表皮严重损伤或被去除,或者角质层蛋白质预先被降解成低分子质量的物质,在纤维溶胀前就会扩散出来,则囊泡会延迟出现或根本不会发生,因此溴Allw0rden反应是羊毛表面分析的有利手段。
由图4可看出,未处理羊毛纤维四周的液泡大而密。这是因为滴加饱和溴水以后,由于羊毛鳞片表层的限制,引起内外压差而产生大量液泡。单独使用角蛋白酶处理只对羊毛鳞片外层的部分二硫键进行破坏,对蛋白质的水解程度极低,对溴Allw0rden反应没有什么影响,因此和空白样的现象类似。单独使用蛋白酶处理后,羊毛的溴Allw0rden反应囊泡仍然存在,但部分区域囊泡变小,形状变得扁平。这主要是由于蛋白酶的酶解作用使CMC中的部分蛋白质水解流出,使外表皮膜和纤维本体的结合力减弱或产生某种“缺陷”,当进行溴Allw0rden反应时,水分子易从这些地方逸出,因此囊泡不能充分鼓起或出现不规则的形状-.,但鳞片表层的类脂结构并没有因为酶处理而产生太大的变化,大量鳞片仍保持完整性,所以溴Alw0rden反应现象依旧明显。经角蛋白酶+蛋白酶一浴法处理后的羊毛纤维没有产生溴Allw0rden囊泡,证明在2种酶的协同作用下,鳞片类脂层和酰胺键均受到破坏,鳞片蛋白水解较完全。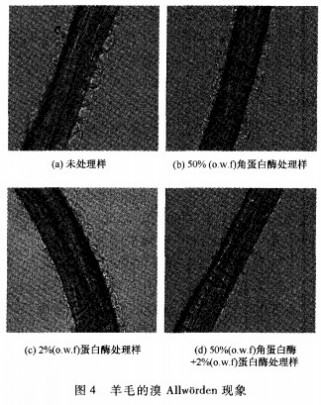
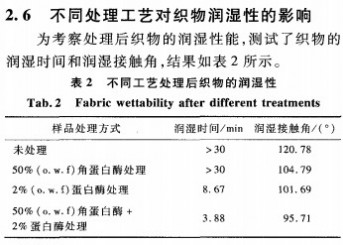
由表2可知,未处理的羊毛织物润湿性很差。单独使用角蛋白酶处理的织物,润湿性稍有提高。因为角蛋白酶虽然能使羊毛鳞片的二硫交联键打开,鳞片层中部分一S—S一还可能被还原成亲水性的mSH或-sso~-’,但鳞片中的拒水性类脂层没有被破坏,因此润湿性改善较少。角蛋白酶+蛋白酶一浴法处理后,织物润湿时间降低至3.88min,润湿接触角为95.71。润湿性明显改善。分析其原因可能为:角蛋白酶对二硫键的断裂作用能使鳞片外层的可及度增大,纤维的亲水性增强,蛋白酶更易攻击鳞片内层,渗入纤维内部,水解皮质层和CMC;在蛋白酶的水解作用下鳞片表层的拒水性类脂物随鳞片蛋白的水解而剥离,因此润湿性提高。
2.7不同工艺处理后羊毛的SEM
将羊毛未处理样、单独使用角蛋白酶处理样、单独使用蛋白酶处理样和角蛋白酶+蛋白酶一浴法处理样进行电镜扫描,结果如图5所示。
从图5可看出,未处理羊毛纤维表面鳞片完整光滑,轮廓清晰,排列紧密。单独使用角蛋白酶处理后,羊毛鳞片依然很完整,只是边缘有一点凸起。这是因为单独使用角蛋白酶处理对鳞片的降解不够强烈,鳞片破坏不明显。单独使用蛋白酶处理后,羊毛纤维表层变得粗糙,鳞片张开且边缘翘起,说明蛋白酶的水解作用主要是针对鳞片细胞问复合物。经角蛋白酶+蛋白酶一浴法处理后,羊毛表面鳞片明显受到破坏,大部分鳞片已基本剥离,纤维表面变得光滑。说明角蛋白酶+蛋白酶一浴法处理的降解效果相当强烈,羊毛鳞片已基本剥离。
3结论
角蛋白酶+蛋白酶一浴法处理能有效提高羊毛织物的防毡缩性能,使毡缩率达到机可洗的要求,但织物强力损失较大,失重较多,这也是一浴法处理存在的主要问题。羊毛的溴AllwOrden现象、润湿性和SEM分析结果显示,角蛋白酶+蛋白酶一浴法对羊毛的处理效果非常明显,二者的协同作用能有效剥离羊毛的鳞片。
五 : 蛋白酶的作用
乍一看店名“宁国府”,准以为那是做红楼宴的,至少也是钟鸣鼎食之家,诗礼簪缨之族。实际上,“宁国府”与这两种说法是没有关系的。那是因为店老板施武的外婆家在黄山脚下的安徽宁国县,店内许多食材都来自苏浙皖闽地区的山野不毛之地。
。www.61k.com)前几天,遇见大侠,他一脸神秘地告诉我:“施武的‘宁国府’有了和火腿一起腌渍的鸭子,名叫‘火腿鸭’,那个香,那个鲜……”他自己讲得咽了咽口水,我则两眼发光,迫不及待与他约好,同去!
深知我“食性”的施武上的第一道菜就是“清蒸火腿鸭”。服务生将菜端在桌子上,远远就闻到了香气。挟起一片尝尝,鲜得不得了。大侠说:“即使火腿放在鲜鸭腿上蒸,也不是这个味。那是表面香、鲜,里面没那个味。如今是里外都香、鲜,而且鲜到骨头里。”一块嚼完,再嚼一块时,我对施武说:“这火腿鸭还可以煮,煮到一半取出斩块当冷盆,汤则可以煮豆腐。还有,斩1/4只,与鲜鸭一起笃,再加点笋、百页结,岂不是‘鸭版腌笃鲜’?”不过我更关心,这火腿鸭是怎么来的。施武告诉我,是在腌火腿时,放入鸭子一起腌,就和火腿缸里有一条狗腿是一样的道理。
正在余味无穷之际,上了一个“酱油水炒花蛤”。酱油水,就是美极鲜酱油和其他调料调好味,让小厨师们烹制时不至于太“走味”。而花蛤,闽台一带又叫“花甲”,故菜名往往看不懂,以为出自花甲厨师之手。花蛤很鲜,洗净后焯水;另起锅放底油,煸香蒜片,再倒入花蛤、酱油水翻炒即可。食之有鲜酱香及淡淡的蒜香。
每人又上了一盅汤,是“泡椒水炖排骨”。汤里有排骨、菌菇、泡椒,加清水小火炖半小时,那是一种清鲜的微酸辣味。
临吃饭时,又上了一盘自制“腌鲜鲳鱼”,施武强调“刚下船”,来自舟山。暴腌鲳鱼,冲洗干净装盒加盖,入蒸箱蒸8分钟即可。因为新鲜,果然好吃。
报载作家阿城说:“人还未发育成熟的时候,蛋白酶的构成有很多可能性,随着进入小肠的食物种类,蛋白酶的种类和结构开始逐渐形成以致固定……思乡这个东西,就是思饮食,思饮食的过程,思饮食的气氛。为什么会思这些?因为蛋白酶在作怪。”
宁国府
地址:上海市杨浦区吉浦路309号
电话:021-****9879
人均:75元
原文地址.html
乍一看店名“宁国府”,准以为那是做红楼宴的,至少也是钟鸣鼎食之家,诗礼簪缨之族。实际上,“宁国府”与这两种说法是没有关系的。那是因为店老板施武的外婆家在黄山脚下的安徽宁国县,店内许多食材都来自苏浙皖闽地区的山野不毛之地。前几天,遇见大侠,他一脸神秘地告诉我:“施武的‘宁国府’有了和火腿一起腌渍的鸭子,名叫‘火腿鸭’,那个香,那个鲜……”他自己讲得咽了咽口水,我则两眼发光,迫不及待与他约好,同去!
深知我“食性”的施武上的第一道菜就是“清蒸火腿鸭”。服务生将菜端在桌子上,远远就闻到了香气。挟起一片尝尝,鲜得不得了。大侠说:“即使火腿放在鲜鸭腿上蒸,也不是这个味。那是表面香、鲜,里面没那个味。如今是里外都香、鲜,而且鲜到骨头里。”一块嚼完,再嚼一块时,我对施武说:“这火腿鸭还可以煮,煮到一半取出斩块当冷盆,汤则可以煮豆腐。还有,斩1/4只,与鲜鸭一起笃,再加点笋、百页结,岂不是‘鸭版腌笃鲜’?”不过我更关心,这火腿鸭是怎么来的。施武告诉我,是在腌火腿时,放入鸭子一起腌,就和火腿缸里有一条狗腿是一样的道理。
正在余味无穷之际,上了一个“酱油水炒花蛤”。酱油水,就是美极鲜酱油和其他调料调好味,让小厨师们烹制时不至于太“走味”。而花蛤,闽台一带又叫“花甲”,故菜名往往看不懂,以为出自花甲厨师之手。花蛤很鲜,洗净后焯水;另起锅放底油,煸香蒜片,再倒入花蛤、酱油水翻炒即可。食之有鲜酱香及淡淡的蒜香。
每人又上了一盅汤,是“泡椒水炖排骨”。汤里有排骨、菌菇、泡椒,加清水小火炖半小时,那是一种清鲜的微酸辣味。
临吃饭时,又上了一盘自制“腌鲜鲳鱼”,施武强调“刚下船”,来自舟山。暴腌鲳鱼,冲洗干净装盒加盖,入蒸箱蒸8分钟即可。因为新鲜,果然好吃。
报载作家阿城说:“人还未发育成熟的时候,蛋白酶的构成有很多可能性,随着进入小肠的食物种类,蛋白酶的种类和结构开始逐渐形成以致固定……思乡这个东西,就是思饮食,思饮食的过程,思饮食的气氛。为什么会思这些?因为蛋白酶在作怪。”
宁国府
地址:上海市杨浦区吉浦路309号
电话:021-****9879
人均:75元
本的变革,这一方法把它的影响范围从非人类的自然界扩展到人类社会的发展领域以及人类与自然和人类相互关系及其评价上。基于生态自然观的人类之间的相互尊重和对自然的尊重是深层次生态保护方法的主要组成部分。为了解决生态问题,需要改变的是人类的态度与行为,而不是把这些改变强加到自然界。因此,必须加强宣传力度,增强全民环保意识,提高公众的生态道德水平和参与程度,彻底革除以食“野味”而标榜的社会风气,把爱护环境、保护生物多样性上升为一种自发行为。通过电视台和其他媒体、广告,开展生物多样性信息传播活动,编制普及性生物多样性信息教材,例如野外手册、培训教材、图片、画册、多媒体光盘和通讯等;建立培训各经济部门的计划,帮助他们将生物多样性保护纳入这些部门的工作中。
除了通过媒体网络、政策规章、立法执法等方面对社会公众加强宣传教育外,学校教育是生态自然观教育的主渠道。在教育部门系统地开展教师培训活动,将生物多样性和生态系统的信息纳入各层次的教学课本中,将其视为公民素质教育的重要内容之一,将环保意识深深地根植于人们的思想中。作为教育工作者,尤其是生物学教育工作者,更要视生态自然观的教育为己任,充分利用现有教学资源,结合生物类学科课程的教学,在教学中贯彻生态自然观的思想。
对此,我们曾经进行了一些有益的探索,主要做法有:在学校层面上积极探索“三结合”的教学模式,即:必修与选修课程相结合,如在开设相关专业必修课《植物学》、《动物学》、《生态学》、《淡水生物学》、《微生物学》、《马克思主义哲学》等课程的同时,又开设了
《人与自然》、《生物多样性》、《保护生物学》等相应的选修课程,采用实例教学,结合如上述国内外历史上发生的有关生物多样性及生态系统受到破坏的案例,阐述分析其后果,提高警示作用,以加强生态自然观思想教育;校内与校外教育相结合,利用校园广播电视、网站、墙报等宣传阵地,倡导建设绿色校园、和谐校园,与校外的公园、动植物园、自然保护区等单位共建生态环保教育基地;定期与不定期活动相结合,如定期出版环保通讯,定期到基地参观,定期邀请校内外专家、学者做报告,另外不定期地开展座谈会、辩论会、读书报告会等活动。
为避免以上举措流于形式,我们对教师和学生都提出了相应的要求。例如对教师提出四个“一”要求,即讲好一堂课,带好一个兴趣小组,参观一个教学基地,写好一篇论文。这主要是指教师除了利用生物类学科课堂主渠道,在课堂中加强生态自然观教育,积极组织开展第二课堂活动,指导学生“环保协会”、动植物兴趣小组的活动,定期与不定期参观考察我市境内的丹顶鹤等珍禽保护区、麋鹿保护区,并完成一篇考察报告或相关论文。对学生提出“五个一”要求,即听好一堂课,参加一项活动,过好一个节,写出一篇小报告,出一期板报。鼓励他们利用有关的特殊日子,如“植树节”、“爱鸟周”、“世界环境日”等,学习并宣传生物多样性与环境保护的重要性,提高公众环保意识和自觉性。
尽管如此,在中学阶段实施保护生物多样性、加强生态自然观的教育依然任重道远,但全社会已基本形成共识,相信我们会逐步走出目前生物多样性所面临的困境!
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
!"#$蛋白酶作用于什么部位
%&’()*+,-./0123****89:;0?@ABCDEF8GHI0J/KLMNOP3!QRSTUVWX0"YVZ[’(5@A]’()8^_‘abc!Qdef@A]ghPc"YiVZfjg5k@A]^_‘albc!Qdefm2ghPcj_@A‘an2ghopq275r4s#tTuvwxbc
U]pyVWoz{|w?’()3}~
阅读详情.html
Z阅读详情.html
o阅读详情.html
?CGHIz{o’()*+
阅读详情.html
/o阅读详情.html
E阅读详情.html
’(5P阅读详情.html
’(5阅读详情.html
r4阅读详情.html
I阅读详情.html
GI阅读详情.html
GI阅读详情.html
GI阅读详情.html
GI阅读详情.html
G阅读详情.html
G阅读详情.html
gh阅读详情.html
0阅读详情.html
EF8’()BCDEF8¡gP’()3阅读详情.html
/0¢£阅读详情.html
¤*+D¥0阅读详情.html
¦§¨¥E阅读详情.html
©’(5阅读详情.html
ª’(5阅读详情.html
«g5阅读详情.html
g5阅读详情.html
P©’(5¬>?®阅读详情.html
I阅读详情.html
¯阅读详情.html
I8«H°±8ghPª’(58@A2>?²4阅读详情.html
I阅读详情.html
I阅读详情.html
I阅读详情.html
«H°±8ghP¥阅读详情.html
m4#³´t’(5oµ¶·t¸¹oL>?º阅读详情.html
I阅读详情.html
I阅读详情.html
»阅读详情.html
I阅读详情.html
I阅读详情.html
¼³½¾¿阅读详情.html
HI8«H°±8ghP?È阅读详情.html
HIÉHP«g54#阅读详情.html
$ʳoEÅËC«g5%阅读详情.html
«g5&P«g5%Ì|>?¼³阅读详情.html
t阅读详情.html
HIC«HÍÇα8ghP«g5&Ì|>?®阅读详情.html
I阅读详情.html
¯阅读详情.html
I阅读详情.html
Ït阅读详情.html
HIC«HÍÇα8ghPÐ阅读详情.html
g5Ñ>?阅读详情.html
HÍÇ8ghPÒÓÔÕo¼³’(5
阅读详情.html
g5ÖJn@A]ghÓo×@A8gh24Ôq£8Pp7°±gh8Êy阅读详情.html
HI4ØÙ8U阅读详情.html
PÚÛoµ758s#tÜÝ阅读详情.html
quvwPÞßFàÞê
ë
áâãâäåâä
阅读详情.html
"æçèÓò
’()*’(é’***+’é
ìíQî "Yïð""ñ
!!
维普资讯
生物学教 学 2 7 第3卷) 1期 0 年( 2 第 2 0
・
6l ・
胰 蛋 白 酶 的 作 用 机 理
韩巧芳 ( 肃 庆 第 中 70 ) 甘 省 阳 一 学 40 50
胰蛋 白酶是 胰腺 的外 分泌部分泌 的 , 在小肠里 对
但在病变的情况下胰腺组织受胰蛋白酶的 自身消化作 用 。胰腺炎时 , 因某些 因素会激活胰 蛋 白酶 , 后者又激 活了其他酶反应 , 对胰腺发生 自身消化作用 , 促进 了其
坏死溶解。如 , 在胰 腺腺泡 的酶原 颗粒 中含有 高浓度 的弹性硬蛋 白酶 , 在胰腺 分泌液 中含 有无活性 的该 酶 前体 , 后者 可被胰蛋 白酶激活而能溶 解弹性组织 , 从而 破坏血管壁及胰腺导管 。
蛋 白质 消化有无 法替代 的作用 , 动物细胞 培养 中可 在
用于分散组织 中的细胞 以及使 贴壁生长 的细胞脱 落 。 但在学 习过程 中 , 多人会 担心胰 蛋 白酶是 否会对 细 许

胞蛋白质 造成 破坏 ?是否 会分 解 小肠 里其 他 的 消化
酶?下 面来看看这些 担心的情况会不会发生。
成人每 日分泌约 1— L胰液。胰 液中主要有 胰淀 2 粉酶 、 胰脂肪酶 、 胰蛋 白酶原 和糜蛋 白酶原 。当胰 液进 入十二指肠后 , 胰蛋 白酶原被 胆 汁和肠液 中的肠致 活 酶激活成为具有活性 的胰蛋 白酶 。酸和胰蛋 白酶也能 使胰蛋 白酶原 活化 。糜蛋 白酶原则 由胰蛋 白酶激 活为 糜蛋 白酶 。胰蛋 白酶 和糜蛋 白酶都 能分解 蛋 白质 , 两
豆浆 和鸡 蛋 都 是 蛋 白质 含量 高 的食 物 , 浆 每 豆 lO 含蛋 白质 1 8 , 蛋 每 lO Og . g鸡 O g含蛋 白质 1 . g 因 28,
而消化它们 都离 不开 胰 蛋 白酶。这 些 蛋 白质进入 小
肠, 经胃蛋 白酶和胰蛋 白酶分解 为氨基酸 , 而后 由小肠 吸收 。其 中胰蛋 白酶作用 明显 , 豆浆 中含有一 种胰 但 蛋 白酶抑制物质 , 能破坏胰 蛋 白酶的活性 , 影响蛋 白质 的消化和吸收。鸡 蛋 中含 有一种 粘液性 蛋 白, 与胰 能 蛋 白酶结合 , 使胰蛋 白酶失去作 用 , 而阻碍蛋 白质的 从 分解。因此 , 豆浆和鸡蛋要煮熟食用 , 而且鸡蛋 与豆浆
尽 量不要同时食用 , 隔一段 时间食 用。当然这不 是 应
者共 同作用时 , 可使蛋 白质分 解 为小分子 的多肽 和氨 基酸 。胰蛋 白酶能选择性地水解蛋 白质 中赖氨 酸或精
氨酸 的羧基端肽键 , 能消化溶解变性蛋 白质 , 对未 变性
的蛋 白质无作用 , 因此 , 对活细胞的蛋 白质 以及有 活性
的消化酶不起 作用。 在正常情 况下 , 胰腺细胞 内的胰蛋 白酶
原无 活性 ,
胰蛋 白酶的错 , 是抑制胰蛋 白酶物质作 用的结果 。
谈 人 的色 觉 与 色盲
党凤 良 ( 北 石 庄 第 学 001 河 省 家 市 一中 55) 0
色 盲是 种典 型的遗传性 疾病 , 中学生物 学教 在
要么是缺少 一种锥 细胞 , 要么是锥 细胞 的吸 收峰值 不
正常。
科书中常常将其作 为伴性 遗传 的典型实 例。 同时 , 色
盲患者不仅会在就业 、 升学等方面遇到种种 限制 , 也会
先天性 色觉缺陷基本上都是 L一锥细胞 或 M一锥
细胞 的缺失或有缺陷造成的。全色盲 和蓝光感觉缺失 是相 当罕见 的。L一锥细胞 和 M一锥 细胞缺 失即我们 所熟知的红绿 色盲 , 因为他 们 区分这两 种颜 色的能力 减退 。而蓝色盲则是 由于更加 罕见 的 s一锥细胞缺失
造成的。 ,
影响他们 正确 感受 五彩缤纷 的现实世 界 , 阻塞 他们 获
取信息的渠道 , 因而对色盲 的研究越来越受到重视。 l 色觉原理及 色盲 的成 因
虽然对于色觉形成 的机制 , 目前 尚未完全清楚 , 但
普遍认 为视网膜上 的锥细胞 是观察颜 色 的重要结 构 。 色觉正常的人 具有三 种不 同的锥细胞 , 分别接 收 长波
色盲 主要是一种先天性缺陷 。然 而也有色盲是后
天的 , 如疾病 或意外 伤害就有 可能 导致色 盲。这 种情
长(0 7 O m) ( 60~ 8 h 光 红色 ) 中波 长( 0 5 O m)光 、 5 0— 3 h
( 绿色) 和短波 长 (0 40—4O t) ( 5n 光 蓝色 ) 分 别被 称 o ,
作 L一 锥细胞 、 M一锥细胞和 S 一锥细胞 。不同颜 色的 光线刺激视网膜 , 会引起三种锥细胞不 同程度 的兴奋 ,
况下 , 色觉缺陷往往是 由于 眼睛和大 脑 的视 觉中枢 间
的神经通路受 伤造成 的 , 而不是 眼睛 锥细胞 功能丧失 的缘 故。例如 , 失全部 色觉 的全 色盲 就可能 是后天 丧
通过确定来 自不 同类 型的锥细 胞 的信 号 的比率 , 脑 大 就能确定我们所 看到 的物体是 什么颜 色 , 如果 三种 锥
细胞兴奋程度相 同, 就会 产生 白色的感觉 。因此 , 的 人 色觉是三种锥细胞各 自不 同程度兴奋在 大脑 中的综合 效应。大部 分色盲患 者的锥 细胞组 成 与正常人 不 同 ,
的脑外 伤造成 的结果 ; 帕金森 氏病常 常会 引发类似蓝
色盲的症状 。
2 色盲 的类型
根据锥细胞发 生的变化 程度 和缺 失状况 , 究人 研
员一般将色盲分 成三色 觉异 常、 二色性 色盲 和全色盲
多胚蛋白酶
--------不增加饲料成本的情况下增加饲料蛋白的新原料
-----------降低饲料配方成本,还足够保持饲料配比平衡
-----------解决了胚芽蛋白不易被吸收的问题
-----------任何饲料、任何生长阶段都能使用
产品介绍
酶制剂作为一种新型高效的饲料添加剂,可以提高畜禽生产性能和减少排泄物的污染,同时也为开辟饲料资源、降低饲料成本提供了有效的途径。
多胚蛋白酶是多种植物的胚芽蛋白酶。是一种可以将植物中不易被吸收利用的胚芽蛋白,充分转化为优质的 易被吸收利用的必需氨基酸的高效复合酶;获得政府认可的高科技产品。国内已有多家大型饲料企业引用该项科研成果,并产生了很高的利润回报。
多胚蛋白酶作用原理:
一、多胚蛋白酶是解决饲料中各种植物胚芽养分消化吸收的新型复合酶。
饲料配比图片 玉米胚芽
饲料中含有60-70%的能量饲料(玉米、麦类等)。能量饲料(玉米)中含有28-30%的胚芽,所以可以算出全价料中大概含有20%的植物胚芽。
胚芽是高蛋白物质,但是其品质不良,不能被动物直接吸收利用,大多有粪便排出体外,粪便中未消化玉米颗粒多是玉米胚芽部分。现在,我们通过多胚蛋白酶将胚芽粗蛋白分解为各种氨基酸,可以充分吸收利用。于是,我们使用多胚蛋白酶相当于每百公斤全价料中多增加了20公斤蛋白饲料,通过蛋白质的丰富利用,可以使畜禽长的更快、体型更好,更加节省饲料,可以使蛋禽更多的产蛋。
二、植物胚芽中也有丰富的胡萝卜素、核黄素、不饱和脂肪酸,随着胚芽完
全吸收,也被充分利用。所以多胚蛋白酶也可使畜禽皮毛光亮,蛋壳蛋黄更加鲜艳。
三、植物胚芽中富含核苷酸,随着吸收率提高,可以再动物体内合成更多的干扰素,于是多胚蛋白酶可以提高动物的免疫力,减少畜禽发病。
多胚蛋白酶在饲料配方中的应用
在玉米豆粕型日粮中存在抗营养因子,其中主要是蛋白酶抑制因子、非
淀粉粘多糖、抗原蛋白等,这些抗营养因子一定程度上降低了饲料的消化利用率,加入符合多胚蛋白酶后,恰恰解决了蛋白酶抑制因子的困扰
1、肉鸡饲料配方中的应用:肉鸡饲料中添加多胚蛋白酶制剂后,圣保罗大学试验中代谢能值提高2.5%,蛋白质消化率提高3.6%。
2、猪饲料配方中的应用:国内外研究表明:猪饲料添加酶制剂后,动物增重提高5%-15.2%,料肉比下降3%-8%,饲料转化率提高3.5-10%,仔猪料中添加后,平均日增重提高10.09%,料肉比下降9.3%。
3、在蛋鸡饲料配比中的应用:在蛋鸡日粮中添加后,试验组较对照组产蛋率提高8.7%(P
多胚蛋白酶短期饲喂对照效果:
一、饲喂3天内,饲喂组明显增强畜禽食欲,采食量加大。
二、7天后可见饲喂组比对照组畜禽更加皮红毛亮,蛋壳蛋黄鲜艳。粪便更加细腻,粪便中玉米颗粒减少或消失。
三、15天后,饲喂组比对照组猪多增重3-9斤,肉禽多增重10%,蛋禽蛋重每枚增加1-2克。
四、对比饲喂过程中,饲喂组畜禽发病率明显下降。
在增重增肥,及抗病力等生产性能的应用:
一、明显增加猪体重:多胚蛋白酶将胚芽粗蛋白分解为各种氨基酸,可以充分吸收利用。于是,我们使用多胚蛋白酶相当于每百公斤全价料中多增加了20公斤蛋白饲料,通过蛋白质的丰富利用,可以使猪长的更快、体型更好,更加节省饲料,
1、2012年3月,开封县李淑云种猪场,将20头日龄相当的断奶仔猪随机分为两组,每组10头,试验结果如下:
2、2011年冬,安徽省淮北市刘根生新引进大肉鸡AA鸡苗6000只,分为两组做对照试验,试验结果如下:
二、合成干扰素,提高肉猪成活率
植物胚芽富含核苷酸,核苷酸与多胚蛋白酶结合可以在动物体内合成干扰素,干扰素可以提高机体的免疫力,对病毒病、呼吸道病等有很强的抗病力。
1、2011年底,原阳县王国强种猪场,200头后备猪作对比实验,通过半个月饲喂,饲喂组比对照组每头平均增重6斤1两。当时天气干燥、疫情较严重,半月后流行高热病,添加本产品实验组的100头猪有2头轻微感染疾病,经治疗5天后痊愈,对照组的100头猪死亡18头,充分证明了多胚蛋白酶不但可以增加猪的体重,也很好的保障了猪的成活率。
2、2012年8月,湖南醴陵绿荫养殖公司放养的一万只麻鸡分两组饲喂实验,饲喂组与对照组各五千只,从20日龄开始对比饲喂。一个月后,当地开始流行传染性呼吸道病,饲喂组与对照组同在一块林坡地,结果饲喂组除有几十只弱鸡染病淘汰后没有大批感染,对照组则出现大量伤亡,死亡率达到28%。三月龄后出栏,饲喂组比对照组平均每只增重2两。
在蛋鸡产蛋性能中的应用:
一、 产品功能及作用原理
1、 通过多胚蛋白酶将饲料中含有的18%的植物胚芽蛋白分解为蛋氨酸、
赖氨酸等必需氨基酸,充分被蛋禽吸收利用,从而使蛋禽产蛋重量增加,产蛋数量增多。通过多胚蛋白酶把植物胚芽中的核苷酸转化为干扰素,提高了蛋禽免疫力,预防各种疾病发生。特别是玉米胚芽富含多种微量元素与胡萝卜素、黄色素,随着玉米胚芽的充分吸收,蛋壳、蛋黄品质与色泽短期内可以迅速改善。
案例回放
1、河南省汝州县韩军养肉种鸭5000只,日龄180天,因发病产蛋率由70%下降至25%,病愈后产蛋率没有明显回升。要求用本品饲喂对比,随将种鸭分两组各2500只,
表三:提高产蛋率的实验分析图
2、 2011年春天,柏杨集团在郑州牧专养鸡场搞效能测定,选初产蛋鸡2000只,分饲喂组与对照组各1000只,两组蛋鸡在品种、饲料、环境、管理完全相同的条件下开始饲喂对比。饲喂一周后,饲喂组明显看到,蛋壳光亮、均匀,蛋黄鲜艳,鸡粪细腻,无未消化的玉米颗粒。对照组则表现一般,粪便里含有未消化的玉米颗粒。饲喂半月观察,饲喂组羽毛有光泽,精神好、反应灵敏,蛋个增大。对照组则无以上表现。经测定饲喂组比对照组每枚鸡蛋增重1.35克。饲喂第45天观察,饲喂组当天共拾蛋901枚,对照组883枚。经检测饲喂组比对照组蛋清粘稠度明显提高。饲喂第180天观察,饲喂组当天拾蛋912枚,对照组875枚。饲喂第360天观察,饲喂组存栏946只,当天拾蛋662枚。对照组存栏903只,当天拾蛋541枚。对照组随时淘汰,饲喂组30天后淘汰。
本对比实验经专家严格检测结论如下:
只总蛋重=产蛋后期在60%产蛋率淘汰时1只鸡的总产蛋重量。
多胚蛋白酶系列产品:
一、猪用型,可用于肉猪、种猪
功能:节省饲料、促生长、改善体形、提高瘦肉率、促发情、促排卵、
多仔、多奶、强壮、健康、增食。
二、肉禽型,可用于肉鸡、肉鸭等各种肉用禽鸟
功能:增食、促生长、防病、催肥、改善料肉比。
三、蛋禽型,可用于各种产蛋、种蛋禽
功能:增蛋、延长产蛋高峰期,后期减缓降蛋,提高种禽受精与孵化率,
防病,省料。
用法用量:本品1000g拌料10吨。
包装规格:1000g/袋
维普资讯
本 的变革 , 这一 方法把 它 的影 响范 围从 非人类 的 自然 界 扩展 到 人类 社 会 的发 展 领 域 以及 人类 与 自然 和人 类相互关系及其 评价上 。基于生 态 自然 观的人类之 间 的相 互尊 重 和对 自然 的尊 重 是深 层 次 生 态保 护 方 法
的主要组成部 分 。 了解 决生态 问题 , 为 需要 改变 的是 人
《 人与 自 、 然》《 生物多样性》《 、 保护生物学》 等相应的选 修课 程 , 用实例教 学 , 采 结合 如上述 国内外历史上发 生
的有关生 物多样性及 生态 系统受 到破坏 的案例 ,阐述
分析其后果, 提高警示作用 , 以加强生态 自 然观思想教
育 ; 内与校外教育相 结合 , 校 园广播 电视 、 校 利用 网站 、
类 的态度与行 为 , 而不是 把这些 改变强加 到 自然界 。 因
墙报等宣传阵地 , 倡导建设绿色校园 、 和谐校园 , 与校
外的公 园 、 动植物 园 、 自然保护 区等单位 共建生态环保
此, 必须加强宣传力度, 增强全民环保意识 , 提高公众 的生态道 德水平 和参 与 程度 , 彻底革 除 以食 “ 味 ” 野 而
标榜 的社 会风气 , 把爱护 环境 、 保护 生物多样性 上升 为
一
教育基地; 定期与不定期活动相结合 , 如定期 出版环 保通讯 , 定期到基地参观, 定期邀请校 内外专家 、 学者
做报告 , 外不 定期 地开展 座谈会 、 论会 、 书报告 另 辩 读 会等活 动 。 为 避 免 以上举 措 流于形 式 , 我们 对教 师和学 生都 提 出了相应 的要求 。例如对 教师 提 出 四个 “ ” 一 要求 , 即讲 好 一堂 课 , 好 一 个兴 趣小 组 , 带 参观 一个 教 学基 地 , 好一 篇论文 。这 主要 是指 教 师除 了利用 生物类 写 学科课 堂 主渠道 ,在课 堂 中加强 生态 自然 观教 育 , 积
种 自发行为 。通过 电视 台和其 他媒体 、 广告 , 开展 生
物多样性信息传播活动 , 编制普及性生物多样性信息
教材 , 如野外 手册 、 例 培训 教 材 、 图片 、 画册 、 多媒 体 光 盘和通讯等 ; 立培训各 经济部 门的计划 , 建 帮助他们 将
生物多 样性保护 纳入这些 部 门的工作 中。

除 了通过 媒 体 网络 、 政策 规 章 、 法 执法 等 方 面 立 对社 会公 众 加强 宣 传 教育 外 ,学 校 教 育 是 生 态 自然 观 教育 的主 渠 道 。在 教 育 部 门系 统地 开展 教 师 培 训
极组织开展第二课堂活动 , 指导学生“ 环保协会” 动 、 植物兴趣小组的活动 , 定期与不定期参观考察我市境 内的丹顶鹤等珍禽保护区 、 麇鹿保护区 , 并完成一篇 考察报告或
相关论文。对学生提 出“ 五个一” 要求 , 即 听好一 堂课 , 参加 一项 活 动 , 过好 一个 节 , 出一篇小 写
报告 , 出一 期板报 。 励他们 利用 有关 的特殊 日子 , 鼓 如
活动 , 将生物多样性和生态系统的信 息纳入各层次的 教学课本 中 ,将其视 为公 民素质教育 的重要 内容之
一
,
将环保意识深深地根植于人们的思想中。作为教
育工 作 者 , 其是 生 物 学 教 育工 作 者 , 要视 生 态 自 尤 更 然 观 的教 育 为 己任 , 分 利用 现 有 教学 资 源 , 合 生 充 结 物类 学科 课程 的教学 , 教学 中贯 彻 生态 自然 观 的思 在
想。
“ 植树节”“ 、爱鸟周”“ 、世界环境 日” , 等 学习并宣传生 物多样 性 与环境保 护 的重要 性 , 提高 公众 环保 意识 和
自觉性 。
对此 , 我们曾经进行了一些有益的探索 , 主要做
法有 : 在学 校层 面 上 积 极探 索 “ 结 合 ” 三 的教 学模 式 , 即 : 修 与 选 修课 程相 结 合 , 在 开设 相 关专 业 必 修 必 如
尽 管 如此 ,在 中学阶段 实施 保 护生 物多样 性 、 加 强生态 自然观 的教 育依然任 重道 远 , 但全 社会 已基本
课 《 植物学》《 、动物学》 《 、生态学》《 、 淡水生物学》《 、微 生物学》 ( 克思主义哲学》 、- B 等课程的同时 , 又开设 了
形成共识 , 相信我们会逐步走出目前生物多样性所面
临的 困境 !
教 学一得
蛋 白酶作用于什 么部位
外源 蛋 白质进 入 人 体 内后 , 是在 有 酶 参 与 的条 件 下 , 过 水 解作 用 变为 小 分子 的 氨基 酸 , 总 经 然后 才能被 吸 收 。 在教 师讲 到 相 关 问
题时 , 学生问遭:蛋 白酶作 用于蛋 白质的什 么部位? 教 师回答 :作 用于肽键 。 学生再 问道 :那肽酶又作 用于什 么部位呢?” “ ” “ ” “ 教师回
答 :还 是 肽 键 。” 那 么作 用部 位 都 是 肽键 , 不是 与 酶 具 有 专一 性 相 矛盾 了吗 ? ” “ “ 这
关于 这 个 问题 , 先要 了解 蛋 白质 在 哺 乳 动 物 消化 道 中 , 解 为氨 基 酸 经过 的 一 系列过 程 , 具 体 分 析 蛋 白酶 和肽 酶 到 底 作 用 首 降 并
于什 么部 位 。
首 先 , 白质 进 八 胃后 , 激 胃分泌 胃蛋 白酶 。 胃蛋 白酶 催 化 具 有 苯 丙氨 酸 、 氨 酸 、 蛋 刺 酪 色氨 酸 以厦 亮 氨 酸 、 氨 酸 、 氨 酰 氨等 肽 谷 谷 键 断裂 , 大 分子 的蛋 白质 变为 小分 子 的 多肽 。 白质在 胃 中消 化后 , 同 胃液 进 入 小肠 , 激 十 二 指肠 分 泌 胰 蛋 白酶 、 蛋 白酶 、 使 蛋 连 刺 糜 麓
肽酶 和 氨 肽 酶等 。胰
蛋 白酶 可 水 解 由赖 氨 酸 、 氨 酸 的羧 基 形 成 的肽 键 。糜 蛋 白酶 的 作 用是 水解 合 有 苯 丙氨 酸 、 氨 酸 、 精 酷 色氨 酸 等 装 基 形 成 的 肽键 。肠 中还 有 一 种 弹性 蛋 白酶 , 特 异性 最低 , 其 能水 解 缬氨 酸 、 氨 醴 、 氨 酸 以 及 丙氨 酸等 各 种 脂肪 族 氨 基 酸 的羧 基 形 亮 丝 成 的肽键 。经 胃蛋 白酶 、 蛋 白酶 、 蛋 白酶 厦 弹性 蛋 白酶作 用后 的 蛋 白质 , 胰 糜 已经 变成 短链 的 肽和 部 分 游 离氨 基 酸 。短 肽 又 经 羧 肽酶 和氨 肽 酶 作 用 , 别从 肽链 的 C 端 和 N 端 水 解掉 氨 基 酸残 基 。 肽 酶 有 A、 两种 , 分 羧 B 分别 称 为 鞋肽 酶 A 和 羧 肽酶 B 羧 肽 酶 A 主要 水 。
解 由各 种 中性氨 基 酸 为燕 基 末端 构 成 的肽 键 。 肽 酶 B主 要 水 解 由赖 氨 酸 、 氨 酸 等碱 性 氨 基 酸 为鞋 基 末 端 构成 的 肽键 。而氨 肽 酶 驻 精
则 水 解氨 基 末 端的 肽键 。
综 上 所 述 。 种蛋 白酶 和肽 酶 虽然 都 作 用 于肽键 上 , 作 用 的肽键 是 有 所不 同的 。 与 形 成肽 键 的 两 个氨 基 酸 有 密切 的 关 系。 各 但 这 因
此 , 与酶 的专 一 性也 就 并 不 矛 盾 了 。 其 ( 子 杰 江 苏省 苏州 市 苏 州 中学 因区枝 林 2 52 ) 10 1
( 靳
琰
华东师范大学生命科 学学院
上海
20 6 ) 0 02
第14卷第5期
1998年10月中国生物化学与分子生物学报ChineseJournalofBiochemistryandMolecularBiologyVol.14,No.5Oct.1998
胰蛋白酶与ANS的相互作用
胡梁言 阮康成**
(中国科学院上海生物化学研究所,上海200031)*
摘要 利用荧光光谱法研究了在不同pH、压力及不同浓度的脲作用时荧光探针1,8-ANS(1-anilionnaphthalene-8-sulfonicacid)与胰蛋白酶的相互作用.发现在低pH时ANS可以结合到胰蛋白酶上,其中以pH2.0、3.0时结合最强.进一步的研究发现脲变性对胰蛋白酶结合ANS的能力有很大的影响:1.5mol/L的脲即可使得胰蛋白酶结合ANS的能力大大降低,但有趣的是即使高达4mol/L的脲对胰蛋白酶色氨酸残基荧光也无明显影响.另外,在pH猝变、脲变性、及逐渐改变压力时,胰蛋白酶色氨酸残基荧光和结合到胰蛋白酶分子上的ANS的荧光的变化大不相同.上述结果暗示胰蛋白酶的色氨酸残基所在的区域和其结合ANS的区域是两个不相同的区域.
关键词:胰蛋白酶,荧光探针(ANS),荧光光谱
TheInteractionbetweenTrypsin
*andFluorescenceprobeANS
HuLiang-Yan RuanKang-Cheng**
(ShanghaiInstituteofBiochemistry,AcademiaSinica,Shanghai200031)
Abstract Theinteractionbetweentrypsinandfluorescenceprobe1,8-ANSatdifferentpH,hydrostaticpressureanddifferentconcentrationofureawasdescribed.ANScouldbindtotrypsinmoleculeatlowpH,especiallyatpH2.0and3.0.FurtherstudyindicatedthatureaobviouslyaffectedANSbindingtotrypsinmolecule:1.5mol/LureagreatlydecreasedANSbindingtotrypsinmolecule.However,itwasinterestingthatnoobviouschangeinthetrypto-phanfluorescencespectrumoftrypsinevenin4mol/Lurea.ItwasfoundthatthechangesinthetryptophanfluorescenceoftrypsinandinthefluorescenceofANSboundtotrypsinmoleculeweredifferentupontheapplicationofhydrostaticpressure,therapidpHchangeandureadenaturation,implyingthatthereexisttwodomainsinthetrypsinmolecule:oneisrelat-edtotryptophanresidues,andtheothertotheANSbinding.
Keywords:Trypsin,FluorescenceprobeANS,Fluorescencespectrum
胰蛋白酶是一种重要的蛋白酶,在体内以胰蛋白酶原的形式合成,激活时切去C端肽段,即可特异性地水解蛋白中的Arg、Lys残基右侧肽健.自从该酶发现以来,人们对其进行了大* 国家自然科学基金资助项目(39770165)
**通讯联系人
收稿日期:1997-03-31,修回日期:1997-06-16
量的研究[1-5],但在低pH、高压力下的研究却很少见有报导.近来,我们在研究高压力对胰蛋白酶的影响时,发现在一定的高静压力下胰蛋白酶可以结合ANS.本文利用荧光光谱法详细研究了不同条件下胰蛋白酶与ANS的相互作用,得到了一些有意义的结果.
1 材料与方法
1.1 试剂
牛胰蛋白酶(trypsin)购自Sigma公司,SDS-PAGE中仅显一条条带,ANS购自美国MolecularProbe公司,其它试剂均为分析纯.
实验中所用的缓冲液(pH>6.5)为50mmol/L的Tris-HCl,pH4.2~6.5间采用50mmol/L的柠檬酸-柠檬酸钠缓冲液,低pH(pH
1.2 解离平衡常数的确定
ANS和胰蛋白酶分子结合的解离平衡常数系利用胰蛋白酶的内源荧光被结合的ANS淬灭,通过该进的Sterm-Volmer公式来确定:
F0/(F0-F)=1+Kd/c
式中F0和F分别表示没有任何ANS结合和有ANS结合时的内源荧光强度,Kd表示ANS和胰蛋白酶结合的解离平衡常数,c表示ANS在溶液中的浓度.
1.3 荧光测量
除测定ANS和胰蛋白酶的解离平衡常数时采用日立F4010荧光分光光度计外,其它的测量均在美国SLM-48000荧光分光光度计上完成.有关高压力的设备和测量详见Paladinni和Weber及Ruan和Weber的有关文献[8,9].
pH由3.0突变到7.6,以及5mol/L的脲变性都在一小型停-留装置上进行.[7]0.1%[6]
2 结果和讨论
2.1 pH对胰蛋白酶结合ANS的影响
Fig.1为有胰蛋白酶存在时ANS荧光的最大发射波长随pH的变化.从图中可以看到当pH>6.5时,ANS荧光的最大发射波长在539nm.从插图中可以得知此时ANS的荧光谱和自由ANS的荧光谱一样(不同pH引起的自由ANS的荧光变化很小),这说明在高pH时ANS不能结合到胰蛋白酶分子上.随着pH的降低,ANS荧光的最大发射波长逐渐蓝移,荧光强度也持续增强.pH降低到3.0时,ANS的荧光最大发射波长蓝移到500nm,荧光强度为自由ANS荧光强度的2倍之多;当pH进一步下降时,ANS的荧光谱不再蓝移,但荧光强度在pH2.0时达到最强,pH降到1.0后荧光强度反而降低.根据ANS和Bis-ANS这类极性荧光探针的特性,上述现象说明随着pH的改变,胰蛋白酶的构象发生了变化:在高pH时胰蛋白酶分子不具有能结合ANS的疏水区;低pH时胰蛋白酶分子的构象发生了改变,出现了能够结合ANS的疏水区.有意思的是从胰蛋白酶的色氨酸荧光对pH的依赖性来看,其最大发射波长在pH1.0~pH9.0间没有显著改变,这说明pH改变对胰蛋白酶分子的色氨酸残基周围的环境无明显的影响,而只是影响其与ANS结合有关的区域.
Fig.2A系以295nm激发时得到的ANS-trypsin的发射光谱,此时胰蛋白酶中的内源荧光发射团只有色氨酸残基被激发.从图中可以看到胰蛋白酶的色氨酸荧光在pH3.0时比[10]
pH7.3时弱,并且可以观察到480nm处的
荧光峰,而在pH7.3时则没有该峰(此时的
荧光谱和ANS单独存在时一样).类似的
荧光淬灭现象Parasad、阮康成等在研究其
它蛋白时也有发现,他们将其归结为色氨
酸残基和结合到蛋白质上的ANS间发生
了能量转移,从而引起色氨酸荧光的淬
灭[7,11].上述现象也同时证实在pH3.0时
胰蛋白酶可以结合ANS(一般来讲只有在
同一分子上的两个荧光发射团间才可能产
生能量转移).从以上的实验可以得知胰蛋
白酶的构象在不同pH有明显的差别,也提
示可以利用ANS荧光来监测低pH下胰蛋
白酶的构象变化.从Fig.2B中可以看到
pH3.0时,随着ANS浓度的增高,胰蛋白
酶中的色氨酸荧光(330nm)逐渐降低,而
ANS的荧光(500nm)逐渐增强.利用结合
到胰蛋白酶分子上的ANS与其色氨酸残
基间的能量转移,我们测定了pH2.0和
3.0时ANS和胰蛋白酶结合的解离常数,
分别为23.0
原文地址蛋白酶的作用.htm
mol/L和55.6原文地址蛋白酶的作用.htm
mol/L.Fig.1 FluorescenceemissionmaximumwavelengthofANSinthepresenceoftrypsinatdifferentpHExcitationat370nm,emissionat500nmInsert:FluorescencespectraofANSinthepresenceoftrypsinatdifferentpH1.pH2.0;2.pH1.0;3.pH3.0;4.pH4.9;5.pH7.3;6.freeANSExcitationat370nmTrypsinconcentration:40
原文地址蛋白酶的作用.htm
g/ml,ANSconcentration:17原文地址蛋白酶的作用.htm
mol/LFig.2

(A)FluorescenceemissionspectraofANS-trypsinatdifferentpH
1.pH7.3;2.pH3.0;3.freeANS.ANSconcentration:17
原文地址蛋白酶的作用.htm
mol/L(B)FluorescenceintensitiesoftrypsinatdifferentconcentrationofANS
Trypsinconcentration:60
原文地址蛋白酶的作用.htm
g/mlExcitationat295nm
根据前人的研究,pH3.0时胰蛋白酶最稳定.Fig.3显示了pH从3.0突变到7.3时ANS-Trypsin的ANS荧光及胰蛋白酶单独存在时其色氨酸荧光随时间的变化.从图中可以[3]
看到pH改变后ANS-trypsin在500nm处
的荧光逐渐降低,200秒内即从原来的4.2
降到2.4(曲线2),该值和同样条件下自由
ANS荧光(2.2)接近,以上结果表明胰蛋白
酶分子在pH从3.0跃变到7.3时,其
ANS结合区的构象发生了变化,从而丧失
结合ANS的能力.与此不同的是内源荧光
基本上不受上述pH改变的影响(曲线1),
这说明胰蛋白酶分子中的色氨酸残基周围
环境无明显改变.结合Fig.1的结果,可以
推断胰蛋白酶中的色氨酸残基所处的环境
和其ANS结合区的相关性很小,否则在其
完全丧失结合ANS的能力的情况下色氨
酸残基的荧光特性不可能没有改变.
2.2 脲变性对胰蛋白酶-ANS相互作用的
影响
上述实验表明在低pH下胰蛋白酶可
以结合ANS,因此可利用ANS来研究
pH3.0时脲变性对胰蛋白酶构象的影响.
Fig.4给出了不同浓度的脲对胰蛋白酶色
氨酸荧光和结合到胰蛋白酶上的ANS的
荧光的影响.在脲低于4mol/L时,色氨酸
荧光的最大发射波长基本不变,这说明4
mol/L以下的脲对色氨酸残基周围环境影
响很小.更高浓度的脲才可使色氨酸残基
荧光发生明显变化:6mol/L的脲使其最
大发射波长红移到338nm,8mol/L时则
红移到348nm,此时胰蛋白酶的荧光谱已
和自由色氨酸在同一缓冲液中的基本一
样,说明胰蛋白酶已完全变性.但是,结合
在胰蛋白酶分子上的ANS荧光随脲浓度
的变化则与此大不相同:1.5mol/L脲即可
使其最大发射波长发生红移,同时荧光强
度下降达45%,说明低浓度的脲对胰蛋白
酶分子中的ANS结合区的微环境已有相Fig.3 FluorescenceintensityoftrypsinandANS-trypsinuponthepHchangefrom3.0to7.3Curve1.Fluorescenceintensityoftrypsinat330nm.Excitationat295nm.Curve2.FluorescenceintensityofANS-trypsi:1.67
原文地址蛋白酶的作用.htm
mol/L,ANSconcentration:17原文地址蛋白酶的作用.htm
mol/LFig.4 TheinfluenceofureaonfluorescenceoftrypsinandANS-trypsin■—■ Themaxmiumemissionwavelengthoftrypsin.Excitationat295nm○—○ ThemaximumemissionwavelengthofANS-trypsin.Excitationat370nmTrypsinconcentration:1.7
原文地址蛋白酶的作用.htm
mol/L,ANSconcentration:17原文地址蛋白酶的作用.htm
mol/L
当大的影响;2mol/L的脲使其最大发射波长红移达10nm,并引起荧光强度的进一步下降;当脲浓度达到4.5mol/L时,ANS的最大发射波长已红移到539nm,其荧光发射谱和自由ANS的基本一样,说明4.5mol/L的脲已使得胰蛋白酶分子中的ANS结合区发生了相当大的变化,ANS不能再和胰蛋白酶结合;更高浓度的脲不再引起ANS荧光谱的改变也支持这一结论.这些事实又一次表明胰蛋白酶的色氨酸残基所处的区域和其ANS结合区的相关性较
小,似为两个不同的区域,否则它们对脲变性的响应应当相似
.
pH3.0时,加入5mol/L的脲后胰蛋白酶的
色氨酸荧光及ANS-trypsin的ANS荧光随时间
的变化见Fig5.加入脲后,胰蛋白酶的色氨酸荧
光强度逐渐降低(曲线1),说明胰蛋白酶分子中
的色氨酸残基周围环境极性在逐渐增强,经拟合
计算得到驰豫时间为117s..而加入同样量的脲
之后,ANS-trypsin的ANS荧光强度随时间的变
化则要快得多,50s内即降低到和自由的ANS的
荧光一致,表明结合在胰蛋白酶上的ANS很快解
离下来.经拟合得到其驰豫时间为11s.该实验
说明在5mol/L的脲变性的情况下,胰蛋白酶的
ANS结合区的构象变化要比其色氨酸残基周围
环境的快得多,表明脲变性对胰蛋白酶的色氨酸
残基所在区域和其ANS结合区的影响有很大的
差异.
2.3 高压力对ANS与胰蛋白酶的相互作用的影
响Fig.5 Theeffectof5mol/Lureaonthefluores-cenceintensitiesoftrypsinandANS-trypsinatpH3.0Curve1.Fluorescenceintensityoftrypsinat330nm.Excitationat295nmCurve2.FluorescenceintensityofANS-trypsinat500nm.Excitationat370nmTrypsinconcentration:1.7
原文地址蛋白酶的作用.htm
mol/L,ANSconcentra-tion:17
原文地址蛋白酶的作用.htm
mol/L在研究高压力对胰蛋白酶的影响时,也同样观察到胰蛋白酶色氨酸荧光和ANS的荧光随压力的变化很不相同.Fig.6分别为在pH3.0时加压和减压过程中胰蛋白酶色氨酸荧光及ANS-trypsin的ANS荧光的变化.随着压力的逐渐升高,色氨酸荧光光谱质量中心(centermassofspectrum)逐渐红移,表明色氨酸残基所处环境的极性随着压力的升高在增加,这是由于压力引起的胰蛋白酶变性所致.压力高于600MPa后,进一步增加压力时荧光质量中心不再红移,说明色氨酸残基的周围环境已进入一稳[9]
Fig.6 TheeffectofhydrostaticpressureonthefluorescenceoftrypsinandANS-trypsinatpH3.0
(A)Thecenterofspectralmassoftrypsinatdifferentpressure.Excitationat295nm
(B)ThefluorescenceintensitiesofANS-trypsinatdifferentpressure.Excitationat370nm
○—○Increasepressure,△—△Decreasepressure
Trypsinconcentration:1.7
原文地址蛋白酶的作用.htm
mol/L,ANSconcentration:17原文地址蛋白酶的作用.htm
mol/L
定状态.从650MPa逐步降压到200MPa时,色氨酸残基的荧光质量中心回复的程度很小,和加压时产生的红移程度相比要明显低得多,这说明在降压时色氨酸残基周围的构象并未完全同步恢复.压力降到200MPa以后,色氨酸荧光的质量中心随压力降低而发生蓝移的趋势才较明显,尤以150MPa后更为突出.压力降到0.1MPa时,色氨酸荧光质量中心回到原来水平.简而言之,在减压过程中色氨酸残基荧光质量中心随压力变化的滞后现象非常明显.结合在胰蛋白酶上的ANS的荧光随压力的变化如下:压力从0.1MPa增至200MPa时,ANS的荧光强度随压力增加略有降低(ANS单独存在时也是如此);但压力超过200MPa后荧光强度逐渐增加,说明高压力引起的蛋白变化促进了ANS与胰蛋白酶的结合.有意思的是当压力超过600MPa后,ANS的荧光随着压力还在继续增加,而没有象色氨酸荧光那样达到一恒定值,这样的现象Li等在研究胰凝乳蛋白酶时也同样观察到[12].ANS荧光与色氨酸荧光随压力变化的显著不同主要表现在降压过程中:从650MPa开始降压,ANS荧光强度随着压力的降低而明显下降,而不象色氨酸残基荧光那样观察到明显的滞后.压力降到200MPa时ANS的荧光强度完全恢复到加压时的水平,而且随着压力的进一步降低,ANS荧光强度完全按加压时的趋势逆转.上述现象进一步证实胰蛋白酶的色氨酸残基所在的区域与ANS结合区性质差别很大,应为两个不同的区域.
综合以上的实验结果,我们得出以下的结论:(1)胰蛋白酶在不同pH时构象有明显的差异,低pH时它能结合ANS,而高pH时则不能,并且高压力可以促进ANS与胰蛋白酶的结合.(2)胰蛋白酶可能具有两个不同的区域:其一和ANS结合相关,另一个则和分子中的色氨酸残基有关.这两个区域受到pH改变、脲变性及高压力作用时有着明显不同的行为.有意思的是现有的胰蛋白酶的电子能谱和晶体X射线衍射研究也指出:胰蛋白酶含有两个各由6条反平行
原文地址蛋白酶的作用.htm
折叠组成的区域,而活性中心位于这两个区域之间[2,3],这似和我们所得到的结论一致,但目前尚不能确定这二者之间的对应关系,还须进一步详细研究.References
1 WangSS,CarpenterFH.KinecticsofthetrypsinhydrolysisoftheoxidizedBchainofbovineinsulin.Biochemistry,1967,6:215~224
2 StroundRM,KayC,DickersonRE.Structureofbovinetrypsin,electrondensitymapsoftheinhibitedenzymeat5
原文地址蛋白酶的作用.htm
and2.7原文地址蛋白酶的作用.htm
resolution.JMolBiol,1974,83:185~2083 PerkinsSJ,SmithKF.Identityoftheputativeserineproteinasefoldinproteinsofthecomplementsystemwithninerelevantcrystalstructures.BiochemJ,1993,295:109~114
4 BodeW,SchwagerP.Singlecalcium-bindingsiteofcrystalinebovine
原文地址蛋白酶的作用.htm
-trypsin.FEBSLett.1975,56:139~1435 LazdunskiM,DelaageM.Structuralstudiesoftrypsinogenandtrypsin,statediagrams.BiochimBiophysActa,1967,140:417~4346 ColemanPL.Somesensitivemethodsfortheassayoftryosinlikeenzymes.I.NewYork.AcademicPress,1976,Vol.14:12~26
7 ParasadAR.DetectionofenergytransferbetweentryptophanresiduesinthetublinmoleculeandboundBis(8-anilinon-aphthaleno-1-sulfonate),aninhibitorofmicrotubuleassembly,thatbindstoaflexibleregionontubulin.Biochemistry,1986,25:3536~3540
8 PaladinniAA,WeberG.Pressure-inducedreversibledissociationofenolase.Biochemistry,1981,20:2587~25939 RuanKC,WeberG.Dissociationofyeasthexokinasebyhydrostaticpressure.Biocheistry,1988,27:3295~3301
10 StryerL.Theinteractionofanaphthalenedyewithapomyoglobinandapohemoglobin,Afluorescentprobeofnonpolar
bindingsites.JMolBiol,1965,13:482~495
11 阮康成.荧光探针Bis-ANS与磷酸丙糖异构酶的相互作用.生物物理学报(RuanKang-Cheng.Theinteractionbe-
tweenfluorescenceprobeBis-ANSandphosphotrioseisomerase.ActaBiophysSin),1992,8:563~568
12 LiTM,HookJ,DrickamerHG,WeberG.Theinteractionofanaphthalenedyewithapomyoglobinandapohemoglobin,
afluorescentprobeofnonpolarbindingsites.Biochemistry,1976,15:5571~5580第14卷第5期
1998年10月中国生物化学与分子生物学报ChineseJournalofBiochemistryandMolecularBiologyVol.14,No.5Oct.1998
胰蛋白酶与ANS的相互作用
胡梁言 阮康成**
(中国科学院上海生物化学研究所,上海200031)*
摘要 利用荧光光谱法研究了在不同pH、压力及不同浓度的脲作用时荧光探针1,8-ANS(1-anilionnaphthalene-8-sulfonicacid)与胰蛋白酶的相互作用.发现在低pH时ANS可以结合到胰蛋白酶上,其中以pH2.0、3.0时结合最强.进一步的研究发现脲变性对胰蛋白酶结合ANS的能力有很大的影响:1.5mol/L的脲即可使得胰蛋白酶结合ANS的能力大大降低,但有趣的是即使高达4mol/L的脲对胰蛋白酶色氨酸残基荧光也无明显影响.另外,在pH猝变、脲变性、及逐渐改变压力时,胰蛋白酶色氨酸残基荧光和结合到胰蛋白酶分子上的ANS的荧光的变化大不相同.上述结果暗示胰蛋白酶的色氨酸残基所在的区域和其结合ANS的区域是两个不相同的区域.
关键词:胰蛋白酶,荧光探针(ANS),荧光光谱
TheInteractionbetweenTrypsin
*andFluorescenceprobeANS
HuLiang-Yan RuanKang-Cheng**
(ShanghaiInstituteofBiochemistry,AcademiaSinica,Shanghai200031)
Abstract Theinteractionbetweentrypsinandfluorescenceprobe1,8-ANSatdifferentpH,hydrostaticpressureanddifferentconcentrationofureawasdescribed.ANScouldbindtotrypsinmoleculeatlowpH,especiallyatpH2.0and3.0.FurtherstudyindicatedthatureaobviouslyaffectedANSbindingtotrypsinmolecule:1.5mol/LureagreatlydecreasedANSbindingtotrypsinmolecule.However,itwasinterestingthatnoobviouschangeinthetrypto-phanfluorescencespectrumoftrypsinevenin4mol/Lurea.ItwasfoundthatthechangesinthetryptophanfluorescenceoftrypsinandinthefluorescenceofANSboundtotrypsinmoleculeweredifferentupontheapplicationofhydrostaticpressure,therapidpHchangeandureadenaturation,implyingthatthereexisttwodomainsinthetrypsinmolecule:oneisrelat-edtotryptophanresidues,andtheothertotheANSbinding.
Keywords:Trypsin,FluorescenceprobeANS,Fluorescencespectrum
胰蛋白酶是一种重要的蛋白酶,在体内以胰蛋白酶原的形式合成,激活时切去C端肽段,即可特异性地水解蛋白中的Arg、Lys残基右侧肽健.自从该酶发现以来,人们对其进行了大* 国家自然科学基金资助项目(39770165)
**通讯联系人
收稿日期:1997-03-31,修回日期:1997-06-16
量的研究[1-5],但在低pH、高压力下的研究却很少见有报导.近来,我们在研究高压力对胰蛋白酶的影响时,发现在一定的高静压力下胰蛋白酶可以结合ANS.本文利用荧光光谱法详细研究了不同条件下胰蛋白酶与ANS的相互作用,得到了一些有意义的结果.
1 材料与方法
1.1 试剂
牛胰蛋白酶(trypsin)购自Sigma公司,SDS-PAGE中仅显一条条带,ANS购自美国MolecularProbe公司,其它试剂均为分析纯.
实验中所用的缓冲液(pH>6.5)为50mmol/L的Tris-HCl,pH4.2~6.5间采用50mmol/L的柠檬酸-柠檬酸钠缓冲液,低pH(pH
1.2 解离平衡常数的确定
ANS和胰蛋白酶分子结合的解离平衡常数系利用胰蛋白酶的内源荧光被结合的ANS淬灭,通过该进的Sterm-Volmer公式来确定:
F0/(F0-F)=1+Kd/c
式中F0和F分别表示没有任何ANS结合和有ANS结合时的内源荧光强度,Kd表示ANS和胰蛋白酶结合的解离平衡常数,c表示ANS在溶液中的浓度.
1.3 荧光测量
除测定ANS和胰蛋白酶的解离平衡常数时采用日立F4010荧光分光光度计外,其它的测量均在美国SLM-48000荧光分光光度计上完成.有关高压力的设备和测量详见Paladinni和Weber及Ruan和Weber的有关文献[8,9].
pH由3.0突变到7.6,以及5mol/L的脲变性都在一小型停-留装置上进行.[7]0.1%[6]
2 结果和讨论
2.1 pH对胰蛋白酶结合ANS的影响
Fig.1为有胰蛋白酶存在时ANS荧光的最大发射波长随pH的变化.从图中可以看到当pH>6.5时,ANS荧光的最大发射波长在539nm.从插图中可以得知此时ANS的荧光谱和自由ANS的荧光谱一样(不同pH引起的自由ANS的荧光变化很小),这说明在高pH时ANS不能结合到胰蛋白酶分子上.随着pH的降低,ANS荧光的最大发射波长逐渐蓝移,荧光强度也持续增强.pH降低到3.0时,ANS的荧光最大发射波长蓝移到500nm,荧光强度为自由ANS荧光强度的2倍之多;当pH进一步下降时,ANS的荧光谱不再蓝移,但荧光强度在pH2.0时达到最强,pH降到1.0后荧光强度反而降低.根据ANS和Bis-ANS这类极性荧光探针的特性,上述现象说明随着pH的改变,胰蛋白酶的构象发生了变化:在高pH时胰蛋白酶分子不具有能结合ANS的疏水区;低pH时胰蛋白酶分子的构象发生了改变,出现了能够结合ANS的疏水区.有意思的是从胰蛋白酶的色氨酸荧光对pH的依赖性来看,其最大发射波长在pH1.0~pH9.0间没有显著改变,这说明pH改变对胰蛋白酶分子的色氨酸残基周围的环境无明显的影响,而只是影响其与ANS结合有关的区域.
Fig.2A系以295nm激发时得到的ANS-trypsin的发射光谱,此时胰蛋白酶中的内源荧光发射团只有色氨酸残基被激发.从图中可以看到胰蛋白酶的色氨酸荧光在pH3.0时比[10]
pH7.3时弱,并且可以观察到480nm处的
荧光峰,而在pH7.3时则没有该峰(此时的
荧光谱和ANS单独存在时一样).类似的
荧光淬灭现象Parasad、阮康成等在研究其
它蛋白时也有发现,他们将其归结为色氨
酸残基和结合到蛋白质上的ANS间发生
了能量转移,从而引起色氨酸荧光的淬
灭[7,11].上述现象也同时证实在pH3.0时
胰蛋白酶可以结合ANS(一般来讲只有在
同一分子上的两个荧光发射团间才可能产
生能量转移).从以上的实验可以得知胰蛋
白酶的构象在不同pH有明显的差别,也提
示可以利用ANS荧光来监测低pH下胰蛋
白酶的构象变化.从Fig.2B中可以看到
pH3.0时,随着ANS浓度的增高,胰蛋白
酶中的色氨酸荧光(330nm)逐渐降低,而
ANS的荧光(500nm)逐渐增强.利用结合
到胰蛋白酶分子上的ANS与其色氨酸残
基间的能量转移,我们测定了pH2.0和
3.0时ANS和胰蛋白酶结合的解离常数,
分别为23.0
阅读详情.html
mol/L和55.6阅读详情.html
mol/L.Fig.1 FluorescenceemissionmaximumwavelengthofANSinthepresenceoftrypsinatdifferentpHExcitationat370nm,emissionat500nmInsert:FluorescencespectraofANSinthepresenceoftrypsinatdifferentpH1.pH2.0;2.pH1.0;3.pH3.0;4.pH4.9;5.pH7.3;6.freeANSExcitationat370nmTrypsinconcentration:40
阅读详情.html
g/ml,ANSconcentration:17阅读详情.html
mol/LFig.2
(A)FluorescenceemissionspectraofANS-trypsinatdifferentpH
1.pH7.3;2.pH3.0;3.freeANS.ANSconcentration:17
阅读详情.html
mol/L(B)FluorescenceintensitiesoftrypsinatdifferentconcentrationofANS
Trypsinconcentration:60
阅读详情.html
g/mlExcitationat295nm
根据前人的研究,pH3.0时胰蛋白酶最稳定.Fig.3显示了pH从3.0突变到7.3时ANS-Trypsin的ANS荧光及胰蛋白酶单独存在时其色氨酸荧光随时间的变化.从图中可以[3]
看到pH改变后ANS-trypsin在500nm处
的荧光逐渐降低,200秒内即从原来的4.2
降到2.4(曲线2),该值和同样条件下自由
ANS荧光(2.2)接近,以上结果表明胰蛋白
酶分子在pH从3.0跃变到7.3时,其
ANS结合区的构象发生了变化,从而丧失
结合ANS的能力.与此不同的是内源荧光
基本上不受上述pH改变的影响(曲线1),
这说明胰蛋白酶分子中的色氨酸残基周围
环境无明显改变.结合Fig.1的结果,可以
推断胰蛋白酶中的色氨酸残基所处的环境
和其ANS结合区的相关性很小,否则在其
完全丧失结合ANS的能力的情况下色氨
酸残基的荧光特性不可能没有改变.
2.2 脲变性对胰蛋白酶-ANS相互作用的
影响
上述实验表明在低pH下胰蛋白酶可
以结合ANS,因此可利用ANS来研究
pH3.0时脲变性对胰蛋白酶构象的影响.
Fig.4给出了不同浓度的脲对胰蛋白酶色
氨酸荧光和结合到胰蛋白酶上的ANS的
荧光的影响.在脲低于4mol/L时,色氨酸
荧光的最大发射波长基本不变,这说明4
mol/L以下的脲对色氨酸残基周围环境影
响很小.更高浓度的脲才可使色氨酸残基
荧光发生明显变化:6mol/L的脲使其最
大发射波长红移到338nm,8mol/L时则
红移到348nm,此时胰蛋白酶的荧光谱已
和自由色氨酸在同一缓冲液中的基本一
样,说明胰蛋白酶已完全变性.但是,结合
在胰蛋白酶分子上的ANS荧光随脲浓度
的变化则与此大不相同:1.5mol/L脲即可
使其最大发射波长发生红移,同时荧光强
度下降达45%,说明低浓度的脲对胰蛋白
酶分子中的ANS结合区的微环境已有相Fig.3 FluorescenceintensityoftrypsinandANS-trypsinuponthepHchangefrom3.0to7.3Curve1.Fluorescenceintensityoftrypsinat330nm.Excitationat295nm.Curve2.FluorescenceintensityofANS-trypsi:1.67
阅读详情.html
mol/L,ANSconcentration:17阅读详情.html
mol/LFig.4 TheinfluenceofureaonfluorescenceoftrypsinandANS-trypsin■—■ Themaxmiumemissionwavelengthoftrypsin.Excitationat295nm○—○ ThemaximumemissionwavelengthofANS-trypsin.Excitationat370nmTrypsinconcentration:1.7
阅读详情.html
mol/L,ANSconcentration:17阅读详情.html
mol/L
当大的影响;2mol/L的脲使其最大发射波长红移达10nm,并引起荧光强度的进一步下降;当脲浓度达到4.5mol/L时,ANS的最大发射波长已红移到539nm,其荧光发射谱和自由ANS的基本一样,说明4.5mol/L的脲已使得胰蛋白酶分子中的ANS结合区发生了相当大的变化,ANS不能再和胰蛋白酶结合;更高浓度的脲不再引起ANS荧光谱的改变也支持这一结论.这些事实又一次表明胰蛋白酶的色氨酸残基所处的区域和其ANS结合区的相关性较
小,似为两个不同的区域,否则它们对脲变性的响应应当相似
.
pH3.0时,加入5mol/L的脲后胰蛋白酶的
色氨酸荧光及ANS-trypsin的ANS荧光随时间
的变化见Fig5.加入脲后,胰蛋白酶的色氨酸荧
光强度逐渐降低(曲线1),说明胰蛋白酶分子中
的色氨酸残基周围环境极性在逐渐增强,经拟合
计算得到驰豫时间为117s..而加入同样量的脲
之后,ANS-trypsin的ANS荧光强度随时间的变
化则要快得多,50s内即降低到和自由的ANS的
荧光一致,表明结合在胰蛋白酶上的ANS很快解
离下来.经拟合得到其驰豫时间为11s.该实验
说明在5mol/L的脲变性的情况下,胰蛋白酶的
ANS结合区的构象变化要比其色氨酸残基周围
环境的快得多,表明脲变性对胰蛋白酶的色氨酸
残基所在区域和其ANS结合区的影响有很大的
差异.
2.3 高压力对ANS与胰蛋白酶的相互作用的影
响Fig.5 Theeffectof5mol/Lureaonthefluores-cenceintensitiesoftrypsinandANS-trypsinatpH3.0Curve1.Fluorescenceintensityoftrypsinat330nm.Excitationat295nmCurve2.FluorescenceintensityofANS-trypsinat500nm.Excitationat370nmTrypsinconcentration:1.7
阅读详情.html
mol/L,ANSconcentra-tion:17
阅读详情.html
mol/L在研究高压力对胰蛋白酶的影响时,也同样观察到胰蛋白酶色氨酸荧光和ANS的荧光随压力的变化很不相同.Fig.6分别为在pH3.0时加压和减压过程中胰蛋白酶色氨酸荧光及ANS-trypsin的ANS荧光的变化.随着压力的逐渐升高,色氨酸荧光光谱质量中心(centermassofspectrum)逐渐红移,表明色氨酸残基所处环境的极性随着压力的升高在增加,这是由于压力引起的胰蛋白酶变性所致.压力高于600MPa后,进一步增加压力时荧光质量中心不再红移,说明色氨酸残基的周围环境已进入一稳[9]
Fig.6 TheeffectofhydrostaticpressureonthefluorescenceoftrypsinandANS-trypsinatpH3.0
(A)Thecenterofspectralmassoftrypsinatdifferentpressure.Excitationat295nm
(B)ThefluorescenceintensitiesofANS-trypsinatdifferentpressure.Excitationat370nm
○—○Increasepressure,△—△Decreasepressure
Trypsinconcentration:1.7
阅读详情.html
mol/L,ANSconcentration:17阅读详情.html
mol/L
定状态.从650MPa逐步降压到200MPa时,色氨酸残基的荧光质量中心回复的程度很小,和加压时产生的红移程度相比要明显低得多,这说明在降压时色氨酸残基周围的构象并未完全同步恢复.压力降到200MPa以后,色氨酸荧光的质量中心随压力降低而发生蓝移的趋势才较明显,尤以150MPa后更为突出.压力降到0.1MPa时,色氨酸荧光质量中心回到原来水平.简而言之,在减压过程中色氨酸残基荧光质量中心随压力变化的滞后现象非常明显.结合在胰蛋白酶上的ANS的荧光随压力的变化如下:压力从0.1MPa增至200MPa时,ANS的荧光强度随压力增加略有降低(ANS单独存在时也是如此);但压力超过200MPa后荧光强度逐渐增加,说明高压力引起的蛋白变化促进了ANS与胰蛋白酶的结合.有意思的是当压力超过600MPa后,ANS的荧光随着压力还在继续增加,而没有象色氨酸荧光那样达到一恒定值,这样的现象Li等在研究胰凝乳蛋白酶时也同样观察到[12].ANS荧光与色氨酸荧光随压力变化的显著不同主要表现在降压过程中:从650MPa开始降压,ANS荧光强度随着压力的降低而明显下降,而不象色氨酸残基荧光那样观察到明显的滞后.压力降到200MPa时ANS的荧光强度完全恢复到加压时的水平,而且随着压力的进一步降低,ANS荧光强度完全按加压时的趋势逆转.上述现象进一步证实胰蛋白酶的色氨酸残基所在的区域与ANS结合区性质差别很大,应为两个不同的区域.
综合以上的实验结果,我们得出以下的结论:(1)胰蛋白酶在不同pH时构象有明显的差异,低pH时它能结合ANS,而高pH时则不能,并且高压力可以促进ANS与胰蛋白酶的结合.(2)胰蛋白酶可能具有两个不同的区域:其一和ANS结合相关,另一个则和分子中的色氨酸残基有关.这两个区域受到pH改变、脲变性及高压力作用时有着明显不同的行为.有意思的是现有的胰蛋白酶的电子能谱和晶体X射线衍射研究也指出:胰蛋白酶含有两个各由6条反平行
阅读详情.html
折叠组成的区域,而活性中心位于这两个区域之间[2,3],这似和我们所得到的结论一致,但目前尚不能确定这二者之间的对应关系,还须进一步详细研究.References
1 WangSS,CarpenterFH.KinecticsofthetrypsinhydrolysisoftheoxidizedBchainofbovineinsulin.Biochemistry,1967,6:215~224
2 StroundRM,KayC,DickersonRE.Structureofbovinetrypsin,electrondensitymapsoftheinhibitedenzymeat5
阅读详情.html
and2.7阅读详情.html
resolution.JMolBiol,1974,83:185~2083 PerkinsSJ,SmithKF.Identityoftheputativeserineproteinasefoldinproteinsofthecomplementsystemwithninerelevantcrystalstructures.BiochemJ,1993,295:109~114
4 BodeW,SchwagerP.Singlecalcium-bindingsiteofcrystalinebovine
阅读详情.html
-trypsin.FEBSLett.1975,56:139~1435 LazdunskiM,DelaageM.Structuralstudiesoftrypsinogenandtrypsin,statediagrams.BiochimBiophysActa,1967,140:417~4346 ColemanPL.Somesensitivemethodsfortheassayoftryosinlikeenzymes.I.NewYork.AcademicPress,1976,Vol.14:12~26
7 ParasadAR.DetectionofenergytransferbetweentryptophanresiduesinthetublinmoleculeandboundBis(8-anilinon-aphthaleno-1-sulfonate),aninhibitorofmicrotubuleassembly,thatbindstoaflexibleregionontubulin.Biochemistry,1986,25:3536~3540
8 PaladinniAA,WeberG.Pressure-inducedreversibledissociationofenolase.Biochemistry,1981,20:2587~25939 RuanKC,WeberG.Dissociationofyeasthexokinasebyhydrostaticpressure.Biocheistry,1988,27:3295~3301
10 StryerL.Theinteractionofanaphthalenedyewithapomyoglobinandapohemoglobin,Afluorescentprobeofnonpolar
bindingsites.JMolBiol,1965,13:482~495
11 阮康成.荧光探针Bis-ANS与磷酸丙糖异构酶的相互作用.生物物理学报(RuanKang-Cheng.Theinteractionbe-
tweenfluorescenceprobeBis-ANSandphosphotrioseisomerase.ActaBiophysSin),1992,8:563~568
12 LiTM,HookJ,DrickamerHG,WeberG.Theinteractionofanaphthalenedyewithapomyoglobinandapohemoglobin,
afluorescentprobeofnonpolarbindingsites.Biochemistry,1976,15:5571~5580
[摘要]牙龈卟啉单胞菌是引起和加重牙周炎的重要致病菌,其分泌的牙龈蛋白酶是其主要的毒力因子之一。本文就牙龈卟啉单胞菌牙龈蛋白酶以及牙龈蛋白酶对细菌生长和黏附的影响、对组织的破坏作用、对宿主防御机制的作用等研究进展作一综述。
[关键词]牙龈卟啉单胞菌;牙龈蛋白酶;致病;作用
[中图分类号]Q 55[文献标志码]A[doi]10.3969/j.issn.1673-5749.2012.06.024
Gingipain and its pathogenicityFeng Qin1,2, Zhang Fengqiu1.(1. Dept. of Periodontics and Mucosa Disease, The Affiliated Beijing Stomatological Hospital of Capital Medical University, Beijing 100050, China; 2. Dept. of Stomatology, General Hospital of Beijing Jingmei Group, Beijing 102300, China)
[Abstract]Porphyromonas gingivalis(P.gingivalis)is recognized as the most important pathogen of periodontitis. Gingipain is thought to be one of the most important virulence factors of P.gingivalis. This paper reviews gingipain and its effects on the growth and adhesion of bacteria, tissue destruction and host defence mechanism.
[Key words]Porphyromonas gingivalis;gingipain;pathogenicity;effect细胞内,是一类结构和功能十分相似的蛋白质[6]。牙龈蛋白酶根据其水解肽段是精氨酸特异性的还是赖氨酸特异性的分为精氨酸特异性半胱氨酸牙龈蛋白酶R(gingipain R,rgp)和赖氨酸特异性半胱氨酸牙龈蛋白酶K(gingipain K,kgp)。rgp以rgpA和rgpB两种形式存在,分别由rgpA和rgpB基因编码;kgp由kgp基因编码。rgpA基因编码的蛋白质由N末端前肽体,相对分子质量4.5×104的精氨酸特异性钙稳定性的rgpA催化结构域和四个序列相关性的黏附结构域rgpAA1、rgpAA2、rgpAA3和rgpAA4组成。rgpB基因编码的rgpB蛋白由N末端前肽区和催化结构域构成,无C末端黏附结构域。kgp基因编码的蛋白质由N末端前肽体,相对分子质量4.8×104的赖氨酸特异性kgp催化结构域和5个C末端黏附结构域kgpA1、kgpA2、kgpA3、kgpA4和kgpA5组成[7]。牙龈蛋白酶催化结构域主要参与分解宿主组织,黏附结构域既具有黏附和凝集功能,还有具免疫原性[6]。2牙龈蛋白酶的致病作用
2.1牙龈蛋白酶对细菌生长和黏附的影响
牙龈卟啉单胞菌是不酵解糖的产黑色素菌,
matrix proteins and escapes recognition by host immune systems[J]. Infect Immun, 2005, 73(2):883-893.
[13]Umeda JE, Missailidis C, Longo PL, et al. Adhesion and invasion to epithelial cells by fimA genotypes of Porphyromonas gingivalis[J]. Oral Microbiol Immunol, 2006, 21(6):415-419.
[14]Sheets SM, Potempa J, Travis J, et al. Gingipain from PorphyromonasgingivalisW83inducecelladhesion molecule cleavage and apoptosis in endothelial cells[J]. Infect Immun, 2005, 73(3):1543-1552.
[15]陈旭,潘亚萍,宗志红.牙龈卟啉单胞菌的牙龈蛋白酶K活性与青春期龈炎的临床相关性[J].口腔医学研究, 2007, 23(2):135-137.
[16]Chen Z, Casiano CA, Fletcher HM. Protease-active extracellular protein preparations from Porphyromonas gingivalis W83 induce N-cadherin proteolysis, loss of cell adhesion, and apoptosis in human epithelial cells[J]. J Periodontol, 2001, 72(5):641-650.
[17]Andrian E, Grenier D, Rouabhia M. In vitro models of tissue penetration and destruction by Porphyromonas gingivalis[J]. Infect Immun, 2004, 72(8):4689-4698.
[18]Nagasawa T, Kiji M, Yashiro R, et al. Roles of receptor activator of nuclear factor-kappaB ligand(RANKL)and osteoprotegerin in periodontal health and disease[J]. Periodontol 2000, 2007, 43:65-84.
[19]Stathopoulou PG, Benakanakere MR, Galicia JC, et al. The host cytokine response to Porphyromonas gingivalis is modified by gingipain[J]. Oral Microbiol Immunol, 2009, 24(1):11-17.
[20]Yun PL, Decarlo AA, Chapple CC, et al. Binding of Porphyromonas gingivalis gingipain to human CD4(+)T cells preferentially down-regulates surface CD2 and CD4 with little affect on co-stimulatory molecule expression[J]. Microb Pathog, 2005, 38(2/3):85-96.
[21]Kishimoto M, Yoshimura A, Naito M, et al. gingipain inactivate a cell surface ligand on Porphyromonas gingivalis that induces TLR2-and TLR4-independent signaling[J]. Microbiol Immunol, 2006, 50(4):315-325.
[22]Tam V, O’Brien-Simpson NM, Chen YY, et al. The rgpA-kgp proteinase-adhesin complexes of Porphyromonas gingivalis inactivate the Th2 cytokines interleukin-4 and interleukin-5[J]. Infect Immun, 2009, 77(4):1451-1458.
胃蛋白酶原操作流程图
加样 100ul
洗板 5遍
加酶 100ul
洗板5遍
加底物 100ul
加终止 50ul 37℃ 60分钟 37℃ 特别注意事项 30分钟 37℃15分钟 终止立即读数
4加3孵2洗
PGI和PGII项目分开做 特别注意:严格控制好反应温度(36℃-37℃)
如果水浴锅温浴,一定不要浸泡酶标板!
(用架子隔离水或添加湿盒) 同一批试剂,相同批号的底物液、终止液和洗液可以混用,
其它组分不能混用。
胃蛋白酶原标准操作规范
1. 实验前将试剂盒及样品平衡至室温(20℃-25℃),时间不少于30分钟;
注意:冷冻保存的血清样本使用前需要在室温中完全融化并充分混合后再使
用,并且要尽量避免血清反复冻融。
2. 加样:空白液、5个校准品、质控品及待测血清标本均100μl/孔加样;
注意:试剂和待测样本加样前要混匀后再加样,加样时避免产生气泡,吸头
不要接触孔壁,并注意更换吸头,不用严重溶血和大量脂血样品;每块酶标
板加样起始至结束时间严格控制在10分钟以内。
3. 孵育:37℃孵育60分钟(加盖封板膜);
注意:时间从微孔板放入37℃温育中开始计时。
4. 洗板:洗板5次,洗液板后于吸水纸上扣干残余液体(如果浓缩洗液有结晶
析出,稀释前可在水浴中加温助溶,混匀后使用不影响检测结果);
注意: 严禁使用自来水冲洗微孔板或用自来水稀释洗液;
手工洗板时,每次洗液都应加满微孔(约350μl/孔);
机器洗板时确保注液量不少于300μl/孔、洗板机清洁、无故障;
洗板后在干净的无纸屑吸水纸上扣干;
无论手工洗板还是机器洗板不要考虑或设臵浸泡时间。
5. 加酶:酶结合物加入量100μl/孔;
注意:建议使用排枪加酶(加样时间控制在5分钟内),移液器吸头不要接触
孔壁,防止交叉污染影响检测结果。
6. 孵育:37℃孵育30分钟(加盖封板膜);
注意:时间从微孔板放入37℃温育中开始计时。
7. 洗板:洗板5次,洗液板后于吸水纸上扣干残余液体;
注意:洗板过程注意事项如步骤4。
8. 显色:底物液加入量为100μl/孔,37℃避光显色15分钟;
注意:时间从微孔板放入37℃温育中开始计时;
加入底物液过程中避免加样吸头与板孔、手指或其它物品接触;
加盖封板膜避光显示,并严格控制显色时间。
9. 终止:建议用多道移液器加样,终止液加入量50μl/孔;
注意:加样时间控制在两分钟之内。
10. 测量:450nm检测读数,确保终止后10分钟内进行测量读数;
注意:如果使用水浴进行温浴,检测前一定要擦干板底的水滴。
11. 数据分析(单波长450nm检测或者双波长450nm、630 nm);
注意:试剂本底(空白液检测值):OD450nm≤0.100;
建议PGI使用双对数拟合方法【ln(Y:浓度)-ln(X:1000×OD)】; 450
建议PGII使用二项式拟合方法【浓度(Y)-OD450(X)】;
线性:在规定的线性范围内,曲线相关系数r2应不低于0.9900。
12. 其它注意事项
操作前应仔细阅读使用说明书,严格按照说明书操作程序进行;
同一批试剂相同批号底物液、终止液和洗液可以混用,其它组分不能混用;
微孔板开封后,剩余要2-8℃密封干燥保存,并建议在半个月之内用完;
各试剂使用前应平衡到室温并摇匀后使用,严格控制反应温度和时间;
加样操作应快速、准确、手法一致,慢吸快打,缩短加样时间;
为防止样品和试剂蒸发及避免污染,温育时将反应板覆盖一层封板膜。
试验报告与理论研究ExperimentalReports&TheoreticalResearches
蛋白酶对大豆分离蛋白作用的探讨
杨
振
)256500
(山东香驰豆业集团有限公司,山东博兴
摘要:通过蛋白酶对大豆分离蛋白凝乳的水解试验,发现适当提高大豆分离蛋白的水解度,可降低其粘度,提高其分散性,改善其在乳制品中的应用。关键词:蛋白酶;水解度;粘度;分散性中图分类号:TS201.2文献标识码:A
大豆蛋白作为一种高纯优质的蛋白被广泛添加在各类食品中。但作为营养强化剂向配方乳粉中添加,
又存在着冲调时分散性较差的问题。有在适宜的条件下对大豆蛋白质进行轻使部分蛋白质转化为分子质量较小的
同时可提高蛋白质
1.2.21.2.2.1
操作要点
大豆分离蛋白凝乳制取
取生产现场大豆
在磁力
蛋白凝乳,调整凝乳固形物为13% ̄14%,
资料表明,度的水解,多肽,
搅拌器作用下调整pH在6.6 ̄6.8。pH调整要快速准确,
避免局部蛋白受浓碱作用时间较长。酶解反应
把制备好的大豆分离蛋白凝乳
可以有效降低其粘度,1.2.2.2搅拌器,
在水中的分散性[1]。本实验通过蛋白酶对大豆分离蛋白作用,
提高大豆分离蛋白的水解度,
使分散
在恒温水浴锅升温至43 ̄50℃。打开电动调速定时
加入0.2%酶制剂,
温度控制在45℃,
定
性得到了改善。至此,为进一步提高大豆分离蛋时分别为1h、2h、3h、4h,注意,
进行恒温酶解反应。
避免局部
白的分散性提供了参考。在蛋白凝乳升温时要均匀快速,
导致部分蛋白变性,蛋白凝乳发生酸败。
升温过快,同时要防止升温
1
1.1
材料与方法材料与设备
大豆分离蛋白凝乳:
山东御馨豆业蛋白有限
时间过长,
1.2.2.3巴氏杀菌采用80 ̄90℃,5 ̄10min杀菌,
对酶灭活。
公司,凝乳固形物含量13%;
德国AB酶制剂公司;
2
2.1
结果与分析
在进行实验过程中,
不仅对酶解蛋白水解度
蛋白酶制剂:
HHS型恒温水浴锅:上海博迅实业有限公司;JJ-1电动调速定时搅拌器:中国常州奥森电器
进行测定[2]比较,同时对酶解后产品风味也进行了
水解度随酶解时间的延
风味在开始1h
此
2008
年第
11
有限公司;粗浅的研究。研究发现:长在提高,较差,
DELTA320Ph计:HALOGENMOISTUREAN-ALYZERHG53梅特勒!托利多公司;
KJELTECTM2300定蛋仪:福斯公司;标准40目筛:
浙江上虞市道墟张兴纱筛厂;
杂质度过滤机:哈尔滨南岗区乳品检测技术研究所。
2h后水解度提高缓慢;
见表1。
随着时间延长,2h风味有了较大改善,
后风味变化不大,
表1
时
间
卷第
4
1.21.2.1
水解度、风味变化与酶解时间关系
项
目
实验方法工艺流程
酶解反应
巴氏杀菌
干燥
成品
1h
水解度风味
(%)23.68较差
2h
(%)30.54较好
3h
(%)32.60较好
4h
(%)34.96较好
期
大豆分离蛋白凝乳
[收稿日期]2007-05-23
(1977-),男,新疆石河子大学食品科学与工程专业毕业,本科,学士学位,主要研究方向:大豆蛋白应用以及乳制品加工。[作者简介]杨振
24
ExperimentalReports&TheoreticalResearches
试验报告与理论研究
2.2
分散性的研究参照乳品中速溶乳粉分散性的
司的蛋白酶进行大豆分离蛋白酶解改性时,
综合
标准[3]以及液体纯牛奶的杂质检验方法[4]。具体方考虑时间、水解度、风味、分散稳定性等因素,法是:
水与酶解蛋白比例为8∶1,
水温60 ̄70℃,
在酶添加量为0.2%,凝乳温度45℃时,
酶解2h为
先加水后加酶解蛋白,之后,
用玻棒迅速搅拌均
最佳。
匀。用同样的方法制取两份100ml样,
一份静置
0.5h后,看是否分层,然后摇匀过40目筛,
对筛
参考文献
上不溶团块计数(小于5个为此项合格);另一份过[1]殷涌光,刘静波.大豆食品工艺学[M].北京:化学工业出版社,杂质度过滤机,以全部样顺利通过为合格,结果
2005,11 ̄117.
见表2。
[2]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,表2
水解度与分散性的对照实验
15(11):65 ̄67.
水
解
度
[3]郭本恒.乳粉[M].北京:化学工业出版社,2003,76 ̄77.项目
23.68
(%)30.54(%)32.60(%)34.96(%)[4]翁鸿珍主编.乳品与乳制品检测技术[M].北京:中国轻工业出版社,是否分层分层
轻微分层
轻微分层
轻微分层
2006,66 ̄68.
过筛计数>5
0
0
0
过滤机
不合格
合格
合格
合格
3结论通过本实验,
可以看出应用德国AB酶制剂公
Discussionofeffectsofproteinaseonsoyproteinisolate
YANGZhen
(ShandongScentsSoybeanIndustrialGroupCo.,Ltd.,Boxing256500,Shandong,China)
Abstract:Theexperimentsofhydrolyzingsoyproteinisolatecurdwithproteinasedisclosedthattheappropriateincreaseofdegreeofhydrolysisofsoyproteinisolatecouldreducethesubstance’sviscosity,enhanceitsdispersivity,andimproveitsuseindairyproducts.
Keywords:proteinase;degreeofhydrolysis;viscosity;dispersivity
汇源果汁(1886.HK)近日公9.49亿元;毛利率上升3个百分果汁的平均价格上升,令浓缩果
布去年业绩:实现净利润6.4亿
点至35.7%。
汁及果酱成本升55%。
元人民币,
同比增长1.89倍;每
公司表示,
若撇除可换股债
公司副总裁兼首席财务官吴股盈利46.9分,期内营业额增长券、上市后所得资金利息收入及育强表示,去年进口浓缩橙汁成
29%至26.6亿元。
上市前派发给员工的部分行使股本上升,
但预期今年有关的进口
去年公司果汁产品整体销量权,
去年核心盈利上升44%,
至
成本价格会放缓,而部分原料采增加18.8%至79.35万吨;
平均
3.195亿元。期内公司销售成本用非橙类的果汁,
预期今年内地
售价提高7.5%。公司销售额增上升22.8%,
至1.7亿元。成本
采购成本有压力。今年整体原材长,
令期内毛利增长40.4%至
上升主因是生产增加及进口浓缩
料成本稳中有升,
中长线毛利率
可维持在30% ̄35%。吴育强表示,2008年资本开支为10 ̄11亿元,
由于过去将资金投放在新增汇源果汁去年净利增长1.9倍
厂房,
相信今年资本开支主要用
作增设新机器,
预期今年底至
2009年初的产能可达270 ̄280万吨。(中国食品商务网
2008-04-02
)2008
年第
11
卷第
4
期
25
出丕医药2QQ!生筮垒垒鲞筻堑塑
菠萝蛋白酶的临床应用及作用机制
祝远彬。赵铭山’
(滨州医学院附属医院,山东滨州256603)
[关键词】菠萝蛋白酶;烧伤;感染;肿瘤;哮喘
R977.3
[中图分类号][文献标识码】A[文章编号】1002-266X(2008)46-0114-02
菠萝蛋白酶是热带水果菠萝的树干和果实中所特有的一系列巯基蛋白水解酶的总称。体外及体内实验发现,菠萝蛋白酶具有多种功能。现就其临床应用及作用机制作一综述。
业烧伤医务人员情况下或者有大量创伤患者时三甲丁酸则较外科处理效果明显。以上表明菠萝蛋白酶可能成为外科清创术之外的另一种选择。2风湿性疾病的治疗
目前骨性关节炎治疗中,非甾体抗炎药(NSAIDs)为第一线治疗药物,但其胃肠道不良反应较大。菠萝蛋白酶已经被证明在多种关节炎中有治疗作用,而且患者具有很好的耐受性。Klein等”’采用双盲实验比较菠萝蛋白酶与NSAIDs治疗骨性关节炎的效果,发现两种药物作用效果差别不明显。实验期间,菠萝蛋白酶组未见有患者因为药物原因退出,相反NSAIDs组有多例因胃肠道反应退出。Klein等在双氯芬酸与菠萝蛋白酶治疗肩关节炎时,通过测量胃蛋白酶A和C(能够反映胃肠黏膜的功能及形态变化),表明后者口服时具有很好的胃肠耐受性。认为菠萝蛋白酶可能通过以下机制发挥作用,即释放炎症调节因子、调节细胞间黏附因子、降低免疫复合物及增强纤维蛋白溶解。以上研究菠萝蛋白酶治疗骨关节炎时,治疗时间较短,干预的药物不仅含有菠萝蛋白酶,而且还有其他酶类。为了更严密研究菠萝蛋白酶在疗程足够长及单独作用下治疗骨性关节炎患者时的疗效,Bfien等po进行了12周的双盲临床实验。干预组为患者每天口服800mg菠萝蛋白酶,对照组只给予安慰剂处理,最后发现菠萝蛋白酶与安慰剂组比较,前者未见明显治疗作用。
1烧伤清创
深度烧伤后形成的结痂易形成急性筋膜室综合征(BICS),可造成神经肌肉等组织不可逆性损害。菠萝蛋白酶与外科手术比较,可以明显减少水电解质丢失,降低皮下感染机会,减轻神经肌肉血管损害。三甲丁酯(Debridase)是一种来源于菠萝蛋白酶衍生物的混合酶,动物实验及临床研究证实,创伤时用三甲丁酯进行清创,不仅没有局部及全身不良反应,而且不会对正常组织造成不利影响。Rosenberg等…对130例Ⅲ或Ⅳ度烧伤患者的研究发现,三甲丁酯l一2次应用即可将结痂处理完全。K_,'ieqer等12o制作猪四肢BICS模型证明菠萝蛋白酶治疗作用与外科清创术相当,给予三甲丁酯外用后30rain内,组织间隔内压力降低至30mmHg以下,并可维持4h以上。此前Yuval在临床上发现,四肢深度烧伤的患者给予菠萝蛋白酶作用2—4h后,组织间隔内压力下降,而且没有患者发展到BICS。三甲丁酸通过酶的融痂发挥作用,与外科清创处理比较,发挥作用较慢,
但是考虑到有时诊断BICS可能延迟,在诊断不明确、缺少专
・通讯作者
因此,可见菠萝蛋白酶用于治疗骨性关节炎还需要更进一步
却无存活。ARDS研究小组的研究中发现,对于插管之前的ARDS患者给与小剂量激素,可以改善肺的顺应性和减少机械通气的时间,但对于总体病死率无明显影响。对于IPF患者如果各种治疗无效,肺移植是最后治疗选择。单肺移植后,理论上未移植的肺肺功能可以改善。目前IPF患者和急性间质性肺炎患者已经有单肺移植后未移植肺肺功能改善的个案报道。
[参考文献】
[1]St矗eter
RM.Pathogenesisandnaturalhistoryofusualinterstitial
wholestory
or
AmJClin
Pathol,2003。119(5):709-714.
exacerbation(aeube
in—
[4]Churg
lung
A.MullerNL,SilvaCI,da1.Acute
injuryofunknownc叫8e)inUIPandotherformsoffibrotie
terstitial284.
pneumonias[J].Am
JSurgPathol,2007,31(2):277-
[5]Kondoh
Y,TaniguchiH,Kitaichi
pneumonia
M,et
a1.Acuteexacerbationof
interstitial
following
surgjcallungbiop8y(J].Respir
Med,2006,100(10):1753-1759.
[6]Patel
SR,KarmpaliotisD,Ayas
in
NT,et
a1.Theroleof
open—lung
pneumonia.The[2]Noble
into
thelastchapterof
biopsy
a
longnovel[J].
ARDS[J].Chest。2004,125(1):197-202.
V,CancellieriA,Chilosi
M,et
a
Chest,2005,128(Suppll):526-532.
PW,HomerIu.Idiopathicpulmonaryfibrosis:nestIrinsights
[7]Ambrosini
a1.Acuteexacerbationof
Respir
idiopathicpulmonaryfibrosis:reportofseries[J].Eur
J,
pathogenesis[J].ClinChestMed。2004,25(4):749-758.
D,et
2003,22(5):821-826.
(收稿日期:2008・11—12)
[3]RiceAJ,WellsAU,Bouros
damage
inrelationtointerstitialpneumonias.Anautopsystudy[J].
万方数据
114
山东医药2008年第48卷第46期
的研究.
3抗感染
Chandler用肠毒性大肠杆菌感染猪制作成腹泻模型,证明菠萝蛋白酶可以降低K88阳性菌引起腹泻的发生率,考虑与蛋白酶作用细菌的结合受体有关。进一步的实验中还发现菠萝蛋白酶可以增强K88阳性产肠毒素大肠埃希菌(ETEC)感染动物对其他疾病的抵抗力。另外菠萝蛋白酶还抑制各种原因引起的肠道分泌反应。Roselli等一j将菠萝蛋白酶作用于受ETEC感染的细胞,结果发现蛋白酶可以保护因ETEC增加的膜的渗透性,表明菠萝蛋白酶可以降低感染对细胞膜的损害,这也可能是菠萝蛋白酶抗感染的机制之一。蛋白酶可以调节患者的免疫力和促进脓毒症患者早日复原。B6ez等∞1选择了60例脓毒症患儿进行双盲随机试验,结果表明与对照组比较,应用菠萝蛋白酶患者体温降至正常及需要的血液动力学支持时间明显减少。4抗肿瘤
Kalra等o¨治疗肿瘤时发现,除了MB—F10黑色素瘤组外,其他组的生存指数在菠萝蛋白酶处理后都明显提高,各组抗肿瘤作用均强于5.FU。Seeor等¨’在肿瘤动物模型中研究菠萝蛋白酶作用效果时发现,菠萝蛋白酶上调p53和Bax进而激动easpase3和c鹄p鹞e9时同时降低抗凋亡蛋白Bcl-2在小鼠皮肤上的表达,而且通过阻断其磷酸化及重组人NF.KB抑制物的降解而显著抑制Cox-2的表达及灭活NF-xB。可以推测菠萝蛋白酶通过是通过阻断MAPK和
Akt/proteinkinase
B信号转导,进而诱导凋亡相关蛋白及抑制NF.KB驱动的Cox-2的表达,这可能是菠萝蛋白酶治疗肿瘤的作用机制。Befit等研究发现,菠萝蛋白酶可以减少码和B,整连蛋白和透明质烷受体CD。(HCAM)的表达,从而可逆性抑制神经瘤细胞侵袭和转移。并且菠萝蛋白酶作用还可以传导到细胞内部,进而影响信号级联放大和蛋白翻译过程,可逆性中断神经胶质瘤细胞的黏附和迁移。5治疗哮喘
Hale—o建立哮喘小鼠模型,通过腹腔途径给予菠萝蛋白酶后发现,菠萝蛋白酶可显著减少肺泡灌洗液中炎性细胞数量,同时还改变CD4*/CDf的比例。表明菠萝蛋白酶全身应用可以减轻过敏性物质引起的气道炎症反应,在T细胞介导的炎症反应中发挥抗炎作用。菠萝蛋白酶已经被证明可降低cD44的表达,提示肺泡灌洗液中cDf、cDf、CD;CD,+。T细胞和嗜酸性粒细胞的降低,可能与菠萝蛋白酶作用于
c儿有关。然而对肺泡灌洗液及外周血中分离出来的淋巴
细胞及嗜酸性细胞进行比较发现,对照组和菠萝蛋白酶组
c乩表达无明显差别。给予菠萝蛋白酶处理哮喘组与未处
理哮喘组比较,支气管肺泡灌洗液中IL.13明显降低。而IL-5表达明显升高。因为IL-5已经被证明与调节嗜酸性粒细胞的募集有关,提示IL-5不是肺泡灌洗液中嗜酸性粒细胞降低的主要机制,而IL.13水平降低则可以通过降低黏液分泌而起到抑制哮喘作用。
万
方数据6其他作用
Wen等-”:在小鼠模型中发现,口服菠萝蛋白酶可以改善排便,并且菠萝蛋白酶在小鼠结肠中抑制iNOSmRNA的过表达及下凋KBmRNA抑制剂的表达,至少部分通过NF—KB途径抑制结肠iNOS过表达,改善手术后肠梗阻。Hale等制作IL.10小鼠炎症性肠病模型,给予菠萝蛋白酶后可以明显降低自发性大肠炎的发生率和严重程度。
目前,菠萝蛋白酶的应用价值一般来源于动物实验和临床应用观察,而且由于实验者所用菠萝蛋白酶的种类、实验时间长短或方法等原因,在一些疾病中的应用价值还存在争议。因此,还需要更多的动物实验和临床应用来进一步验证。
[参考文献]
[1]RosenborgL,LapidO,Bogdanov—Bcrezovsky
A,et
a1.Safetyand
efficacy
of
a
pTotellytic
enzyme
for
enzymatic
bumdebridement:a
preliminary
report[J].Bums,2004,30(8):843-850.
[2]KrieqerY,RosenberqL,LapidO。eta1.Escharotomy
using
an
cnzy—marie
debfidement
agentfortreatingexperimentalbum-・induced
com・・
pm'tmentsyndromeinananimalmodel[J].JTraurna,2005,58(6):
1259.1264.
【3]KleinG,KulliehW.Short—term
13"eatment
ofpainful
osteoarthfitisof
the
kneewithoralenzymes
a
randomised,double—blindstudyvenms
dclofenac[J].ClinDrug
Invest,2000,19(1):15-23.
[4]BrienS,tewithG,Walker
AF,ct
a1.Bromelain∞∞adjunctive
treatment
for
moderate—to—severeooteoarthrifisoftheknee:rttndom・
izedplacebo—controlledpilotstudy[J].QJM,2006,99(12):841・
850.
[5]Roselli
M,Britti
MS,LeHuemu・Lumn
I。et
a1.Effectofdifferent
plant
extracts
andnaturalsubstances(PENS)againstmembrane
dmage
inducedby
enterotoxigenic
eseherichiacellK88
inpig
intes-
tinal
cells[J].ToxicolIn
Vitro,2007,21(2):224-229.
[6]B纰R,Lopes
MT,SalasCE,eta1.In
vivo
antitumoral
activity
of
stem
pineapple(Ananascomosu8)bromelain[J】.PlantaMed,
2007,73(13):1377-1383.
[7]KabaN,BhuiK,RoyP,,nuclearfactor
kappaBandcyclooxygenase-2
expression
bybremelain
throu#,tsrge-
ring
mitagen-activated
protein
kinase
pathway
in
mouse
skin[J].
ToxicolApplPbormaeoi,2008,226(1):30-37.
[8]SecorER,CarsonWF,CloutierMM,eta1.Bromelain
exerts
anti—in—
flammatory
effects
in
8n
ovalbumin.inducedmurine
modelofallergic
airway
disease[J].CellularImmunology,2005,237(1):68-75.
[9]HaleLP.Proteelytic
activity
andimmunogenicity
oforalbromelain
withinthegastrointestinal
tract
of
mice[J].Intlmmunopharmacol,
2004,4(2):255-264.
[10]wenS。HuangrrH,LiGQ,eta1.Bmmclainimprovesdecrease
in
defecation
in
postoperativerats:modulationofcolonic
geneexpres—
sion
ofinducible
nitric
oxide
synthase[J].LifoSci.2006,78(9):
995.1002.
(收稿口期:2008-07-12)
115
本文标题:蛋白酶的作用-关于蛋白酶和肽酶对肽键的不同分解作用61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1