一 : 溶液在我们日常生活中有很广泛的用途,下列属于溶液的是[]A.蒸馏水B.碘酒C.石灰浆D.植物油
| 溶液在我们日常生活中有很广泛的用途,下列属于溶液的是 |
| [ ] |
| A .蒸馏水 B .碘酒 C .石灰浆 D .植物油 |
| B |
考点:
考点名称:溶液的定义、组成及特征溶液的概念:
一种或几种物质分散到另一种物质中,形成均一的,稳定的混合物,叫做溶液
二 : 硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下: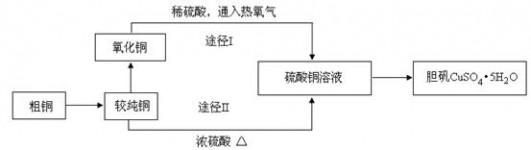 (1)“较纯铜”转化为氧化铜时,应将其置于内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是。 a.灼烧过程中部分氧化铜被还原b.该条件下铜无法被氧气氧化 c.氧化铜在加热过程中分解生成铜d.灼烧不充分铜未被完全氧化 (2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点: ① 。 ②。 (3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。 a.加热后容器未放入干燥器中冷却 b.最后两次加热后的质量相差较大 c.加热前称量时容器未完全干燥 d.加热过程中有少量溅失 (4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。  请通过计算,推断该实验条件下硫酸铜分解的化学方程式:。 |
| (1)坩埚;油脂在碱性条件下发生水解而除去 (2分,各1分)。 ad(2分,各1分) (2)蒸发浓缩过滤洗涤(2分,各1分)。①产生等量胆矾,途径I消耗硫酸少;②途径I不产生污染大气的气体(2分,各1分) (3)cd(2分,各1分) (4) 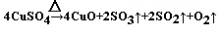 (2分,产物质正确1分,配平1分) (2分,产物质正确1分,配平1分) |
试题分析:(1)进行灼烧所需的温度较高应选择坩埚,“粗铜”表面的油脂可以用热碱溶液洗去,原因是油脂在碱性条件下发生水解而除去。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是a.灼烧过程中部分氧化铜被还原 d.灼烧不充分铜未被完全氧化。 (2)过滤完后还要进行蒸发浓缩然后冷却结晶、过滤洗涤,最后再自然干燥。途径Ⅰ有明显的两个优点:①对照反应转化情况可知产生等量胆矾,途径I消耗硫酸少;②途径I不产生污染大气的气体。 (3)测定的相对误差大于零说明水的量较多或固体的质量较少,a.加热后容器未放入干燥器中冷却不一定产生误差;b.最后两次加热后的质量相差较大也可能会使水的质量减小; c.加热前称量时容器未完全干燥,会有水将会使水的量增多,正确;d.加热过程中有少量溅失,将会使剩下的固体质量减少,相当于水的量增多,正确; (4)加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃,说明有氧气生成。由记录的数据可得出生成酸性气体质量是4.5g,生成氧气是0.5g,生成固体物质45g,根据电子守恒,由生成氧气0.5g,失电子数(0.5/32)*4mol。得电子可能是生成了二氧化硫,即生成二氧化硫的量为:(0.5/32)*2mol,质量为2g,还有酸性气体应该是三氧化硫,质量为2.5g,物质的量为2.5/80mol,即物质的量之比:二氧化硫:三氧化硫:氧气=2:2:1,根据原子守恒可知生成黑色固体为氧化铜,化学方程式为 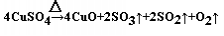 。 。 |
考点:
考点名称:气体的收集、净化、干燥收集方法及装置:

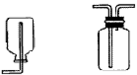



氯气的实验室制法:
(1)实验室用浓盐酸和二氧化锰反应制取氯气。 
(2)装置图: 
(3) 步骤: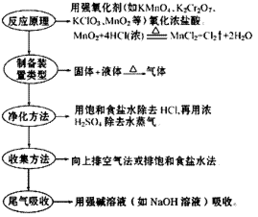

氯气的工业制法:
(1)电解饱和食盐水(氯碱工业),化学方程式为: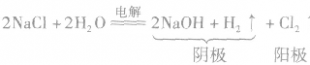
(2)电解熔融的氯化钠(可制得金属蚋),化学方程式为:
(3)电解熔融的氯化镁(可制得金属镁),化学方程式为:
 CH4+Na2CO3
CH4+Na2CO3 气
气  Na2SO4+2HCl?
Na2SO4+2HCl?

乙烯的制取:
(1)实验室里是把酒精和浓硫酸按1:3混合迅速加热到170℃,使酒精分解制得。浓硫酸在反应过程里起催化剂和脱水剂的作用。
制取乙烯的反应属于液--液加热型
C2H6O CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)装置图:
(3) 注意事项:
①酒精和浓硫酸按体积1比3混和,使乙醇利用率提高,必须使用无水酒精,而且必须控制170摄氏度才能制得乙烯。装置连接时由下至上,由左至右。温度计插入液面下。
②烧瓶内加沸石以避免暴沸。
③温度计水银头插入液面下,但不要接触烧瓶底部,以测定液体温度。
④要使液面温度迅速升到170摄氏度,以避免副反应发生。
(4)收集方法:乙烯的密度与空气相当,所以不能用排空气取气法,只能用排水法收集。
检验:点燃时火焰明亮,冒黑烟,产物为水和CO2;通入酸性高锰酸钾溶液中,紫色高锰酸钾褪色。
(5)实验现象:生成无色气体,烧瓶内液体颜色逐渐加深。
(6)两点说明
①实验室中用无水乙醇和浓硫酸制取乙烯气体,加热不久圆底烧瓶内的液体容易变黑,原因是:浓硫酸将无水乙醇氧化生成碳单质等多种物质,碳单质使烧瓶内的液体带上了黑色。制得的C2H4中往往混有 等气体。
等气体。
②实验时要求使反应温度迅速卜升到170℃并稳定在170℃左右,因该温度下主要产物是乙烯和水,而在140℃时主要产物是乙醚和水,当温度高于170℃ 时,乙醇和浓硫酸发生的氧化反应更加突出,反应产物有 等多种物质。相关反应方程式为:
等多种物质。相关反应方程式为: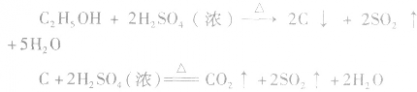
三 : 化学反应原理在科研和生产中有广泛应用。(1)利用“化学
| 化学反应原理在科研和生产中有广泛应用。 (1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应: TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0(I) TaI4(g)+S2(g) ΔH>0(I)反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。 (2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。  (3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为______________________。 (4)25℃时,H2SO3  HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中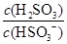 将________(填“增大”“减小”或“不变”)。 将________(填“增大”“减小”或“不变”)。 |
| (1)[c(TaI4)·c(S2)]/c2(I2) 66.7% (2)< I2(3)淀粉 I2+H2SO3+H2O=4H++2I-+SO42- (4)1×10-12增大 |
| 结合题给可逆反应的特点,应用化学平衡移动原理,分析化学平衡、电离平衡和水解平衡问题。 (1)反应(Ⅰ)中,TaS2为固体,则平衡常数表达式K=[c(TaI4)·c(S2)/c2(I2)]。设平衡时,I2转化的物质的量为x,则有 TaS2(s)+2I2(g)  TaI4(g)+S2(g) TaI4(g)+S2(g)起始/mol100 转化/mol x0.5x0.5x 平衡/mol1-x 0.5x 0.5x 此时平衡常数K为1,则有[(0.5x)·(0.5x)]/(1-x)2=1,从而可得x=2/3 mol,I2(g)的转化率为(2/3 mol)/1 mol×100%≈66.7%。 (2)由题意可知,未提纯的TaS2粉末变成纯净TaS2晶体,要经过两步转化:①TaS2+2I2=TaI4+S2,②TaI4+S2=TaS2+2I2,即反应(Ⅰ)先在温度T2端正向进行,后在温度T1端逆向进行,反应(Ⅰ)的ΔH大于0,因此温度T1小于T2,该过程中循环使用的是I2。 (3)淀粉遇单质I2显蓝色,利用I2溶液滴定H2SO3时,常用淀粉作指示剂,达到终点时,溶液由无色变成蓝色,滴定反应的离子方程式为I2+H2SO3+H2O=4H++2I-+SO42-。 (4)H2SO3的电离常数Ka=[c(HSO3-)·c(H+)]/c(H2SO3)=1×10-2mol·L-1,水的离子积常数KW=c(H+)·c(OH-)=1×10-14mol2·L-2,综上可得Ka=[c(HSO3-)·KW]/[c(H2SO3)·c(OH-)]。NaHSO3溶液中HSO3-的水解反应为HSO3-+H2O  H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。 H2SO3+OH-,则水解平衡常数Kh=[c(H2SO3)·c(OH-)]/c(HSO3-)=KW/Ka=(1×10-14mol2·L-2)/(1×10-2mol·L-1)=1×10-12mol·L-1。NaHSO3溶液中加入少量I2,二者发生氧化还原反应,溶液中c(HSO3-)减小,HSO3-的水解程度增大,c(H2SO3)/c(HSO3-)将增大。点拨:知识:平衡常数及转化率;平衡移动及影响因素;氧化还原滴定及指示剂的选择;电离平衡常数和水解平衡常数的计算。能力:考查考生的综合应用能力、分析问题和解决问题的能力,以及简单计算的能力。试题难度:较大。 |
考点:
考点名称:化学平衡的有关计算化学平衡计算的一般思路和方法: pC(g)+ qD(g)
pC(g)+ qD(g) 

 ,对于生成物
,对于生成物





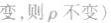
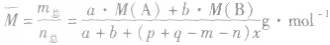
 来说,加压,
来说,加压, 增大、
增大、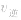 增大,
增大, 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压, 均减小,
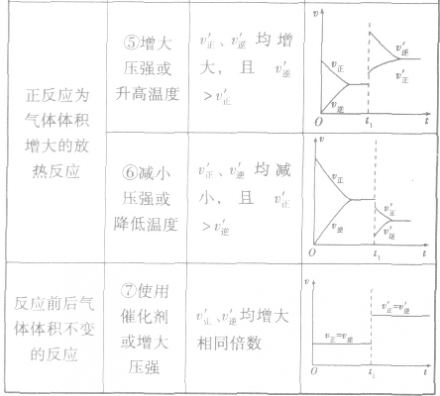
均减小,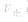 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
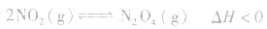 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图: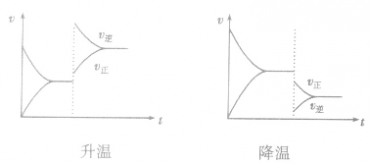
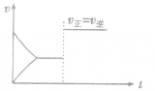
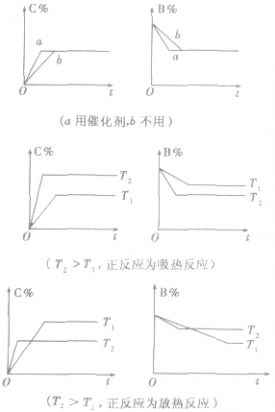
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。  容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。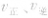 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
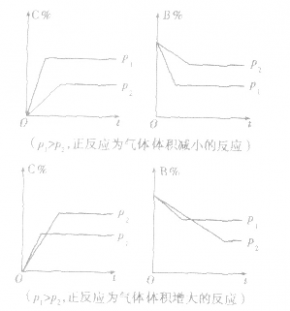
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
 cC(g)+dD(g):
cC(g)+dD(g): 
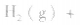
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。  ,
, ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让
 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 
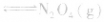 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物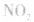 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小考点名称:达到化学平衡的标志化学平衡移动的含义:
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小考点名称:达到化学平衡的标志化学平衡移动的含义:
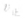 >
>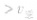 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动; ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 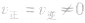 。
。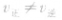 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断: 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 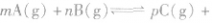 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
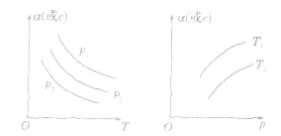
 考点名称:化学平衡常数定义:
考点名称:化学平衡常数定义: pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: 化学平衡常数的意义:
化学平衡常数的意义:


四 : 香精香料在日常生活中的应用
香精香料不是醒目的商品,但我们的日常生活却充满香气。如我们所用化妆品的香气争奇斗艳、各种洗涤用品香气清爽淡雅、各种食品充满诱人的香味。尽管人类的嗅觉动物相比已经退化(如远远不如狗,见表1-1),但在人的生活中,香味具有让人无法相信的魅力,往往令人逐然心动,微妙地支配人的感情。人类的嗅觉虽然不如动物,但在人类的生活中,香味自古以来就扮演着重要的角色。
表 1-1 阈值( 1 毫升空气中的分子数)
物质 | 人 | 狗 |
醋酸 | 5.0×1018 | 5.0×105 |
酪酸 | 7.0×109 | 9.0×103 |
戊酸 | 6.0×1010 | 3.5×104 |
α - 紫罗兰酮 | 3.0×108 | 1.0×105 |
乙硫醇 | 4.0×108 | 2.0×105 |
羊油酸 | 2.0×1011 | 4.0×104 |
从表1-1可见,狗的嗅觉阈值远比人类敏锐,对酪酸来说其敏锐程度为人类的 106倍。人的脚心汗腺约为 1000 个/cm2,24 小时之内分泌汗液约16ml,汗中0.04%为酪酸,即使仅有它的10-3倍落于地面,每个足迹上约残留 2.5×1011个酪酸分子,这个浓度是狗的嗅觉阈值的106倍。当然犬类追踪的是酪酸、吲羟、吲哚、酚类、丁二酮等混合物的综合气味,并根据各组分浓度的不同分辨出每个人。
随着社会文明的进步,人们需求愉快的芳香以增加生活的情趣。香精香料需求量快速增长,因此天然香料远远不能满足社会的需要,人造香料、合成香料的迅速发展,大大缓解了这一矛盾。日常生活中我们经常接触的香味产品有化妆品、香皂、洗涤剂、牙膏、医药品、各类食品、酒类、杀虫剂、空气清新剂、防臭剂、涂料、文具用品,橡胶、塑料制品、皮革、电影胶片、印刷油墨和城市煤气等。
以上资料由香精香料英才网(xjxl.j[www.61k.com]ob1001.com)提供,官方微博:http://weibo.com/xjxljob1001
本文标题:铝制品在日常生活中应用广泛-溶液在我们日常生活中有很广泛的用途,下列属于溶液的是[]A.蒸馏水B.碘酒C.石灰浆D.植物油61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1