一 : 如何配制高锰酸钾溶液?
高锰酸钾是一种强氧化剂,近年在防治瓜类蔬菜枯萎病等毁灭性病害方面大显神通,防效达95%以上,而且无污染、安全可靠、成本低,还为瓜菜提供了钾、锰等营养元素,促进生长。配制高锰酸钾溶液应注意以下几点:
二 : 高锰酸钾溶液是什么?
哪里有卖,要买怎么样的?要怎么用,用多久?
高锰酸钾就是非常常见的药物,到药店买就可以的,可以清洗一周观察看看的
三 : 区别植物油和矿物油的正确方法是[]A.加酸性高锰酸钾溶液,振荡B.加NaOH溶液,加热C.加新制的氢
| 区别植物油和矿物油的正确方法是 |
| [ ] |
| A.加酸性高锰酸钾溶液,振荡 B.加NaOH溶液,加热 C.加新制的氢氧化铜,加热 D.加溴水,振荡 |
| B |
考点:
考点名称:物质的鉴别鉴别原则:互滴现象不同的化学反应:
1.Na2CO3与稀盐酸的反应
(1)向稀盐酸中滴加Na2CO3溶液,立即有气泡产生。
(2)向Na2CO3溶液中滴加稀盐酸,边滴加边振荡,开始不产生气泡,后来产生气泡。
2.Ca(OH)2溶液与H3PO4溶液的反应
(1)向H3PO4溶液中滴加Ca(OH)2溶液,开始不产生白色沉淀,后来产生白色沉淀。
(2)向Ca(OH)2溶液中滴加H3PO4溶液,肝始有白色沉淀,后来白色沉淀逐渐消失。
3.NaOH溶液与AlCl3溶液的反应
(1)向AlCl3溶液中滴加NaOH溶液,开始产生白色沉淀,后来白色沉淀逐渐消失j
(2)向NaOH溶液中滴加AlCl3溶液,开始不产生白色沉淀,后来产生白色沉淀。
4.NaAlO2溶液与稀盐酸反应
(1)向NaAlO2溶液中滴加稀盐酸,开始有白色沉淀产生,后来白色沉淀逐渐消失。
(2)向稀盐酸中滴加NaAlO2溶液,开始不产生白色沉淀,后来产生白色沉淀。
5.AgNO3溶液与NH3·H2O反应
(1)向NH3·H2O中滴加AgNO3溶液,开始不产生沉淀
(2)向AgNO3溶液中滴加NH3·H2O,开始出现沉淀,最终沉淀消失。
有机化合物的鉴别方法:
(1)烯烃、二烯、炔烃:
①溴的四氯化碳溶液,红色腿去
②高锰酸钾溶液,紫色腿去。
(2)含有炔氢的炔烃:
①硝酸银,生成炔化银白色沉淀
②氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
(3)小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色
(4)卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
(5)醇:
①与金属钠反应放出氢气(鉴别6个碳原子以下的醇);
②用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
(6)酚或烯醇类化合物:
①用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
②苯酚与溴水生成三溴苯酚白色沉淀。
(7)羰基化合物:
①鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;
②区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;
③区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;
④鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
(8)甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
(9)胺:区别伯、仲、叔胺有两种方法
①用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
②用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
(10)糖:
①单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;
②葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
③麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
(11)使溴水褪色的有机物有:
①不饱和烃(烯、炔、二烯、苯乙烯等);
②不饱和烃的衍生物(烯醇、烯醛等);
③石油产品(裂化气、裂解气、裂化石油等);
④天然橡胶;
⑤苯酚(生成白色沉淀)。
(12)因萃取使溴水褪色的物质有:
①密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);
②密度小于1的溶剂(液态的饱和烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱和酯)。
(13)使酸性高锰酸钾溶液褪色的有机物有:
①不饱和烃;②苯的同系物;③不饱和烃的衍生物;④部分醇类有机物;⑤含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐;⑥石油产品(裂解气、裂化气、裂化石油);⑦天然橡胶。
四 : 1:5000的高锰酸钾溶液怎么配
性别:男
年龄:30
一片0.2g的要用多少ml的水,冷水还是热水,使用方法上写着 皮肤消毒:取一片加水45ml配制成含高锰酸钾4000mg/L溶液,擦洗3分钟,在网上看到颜色应该是粉红色的,但是这样配置起来是深紫色的,要怎么用啊,配好要泡多久
一片0.2g的要用1000g的水啊
以配制1∶5000的溶液为例,正确做法是:在清洁的器皿中加入1克高锰酸钾粉,兑入5000毫升凉水或温开水,温度不宜过高,否则会分解失效,要搅拌均匀,肉眼观察为粉红色即可使用。
五 : (14分)医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:H++MnO4
| (14分)医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题: H++MnO4-+H2C2O4→CO2↑+Mn2++□ (1)配平以上离子方程式,并在□中填上所需的微粒。 (2)该反应中的还原剂是。 (3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为mol。  (4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。 (4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。①稀硫酸溶解CaC2O4沉淀的化学方程式是。 ②溶解沉淀时(能或不能)用稀盐酸,原因是。 ③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙g。 |
 |
| 略 |
考点:
考点名称:氧化还原反应与基本反应类型的关系氧化还原反应与基本反应类型的关系: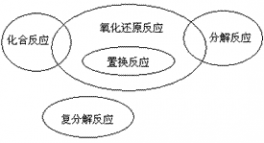
化学反应的分类:
化学反应按照不同的分类标准,可以分成不同的反应类型
根据原子(原子团)的组合形式来分类,把化学反应分为化合反应、分解反应、置换反应、复分解反应,氧化还原反应的发展史:
物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。有化合价升降的反应属于氧化还原反应。有电子得失或偏移的反应属于氧化还原反应。对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
氧化还原反应中应注意的几个问题:
1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;
还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al
2、有新单质参加或生成的反应不一定是氧化还原反应 eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)
3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)
4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性! eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
氧化还原的表示可用单线桥也可用双线桥:
一、双线桥法:
此法不仅能表示出电子转移的方向和总数,还能表示出元素化合价升降和氧化、还原关系。双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团。
标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。
连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素)
标得失 1.标电子转移或偏离数 明确标出得失电子数,格式为“得/失发生氧化还原反应原子个数×单位原子得失电子数”
2.标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等
3.标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确
4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。
例如: 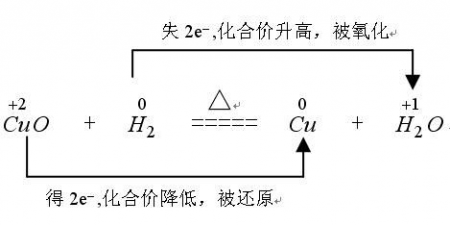
二、单线桥法:
在氧化还原反应中,有电子发生转移(得失或偏移),也就是在反应物中有元素电子发生得失或偏移,这时用一条带箭头的曲线从失去电子的元素指向得到电子的元素,并在“桥”上标出转移的电子数,这种表示方法叫单线桥法。
(1)标价态明确标明发生氧化还原反应的元素的化合价
(2)连单线连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
例如: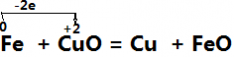
注意事项:
(1)不得标明"得"或"失",否则是错的
(2)箭头表示电子转移的方向,指向氧化剂注意:为了规范起见,单线桥法最好不用于自身氧化还原的反应,因为那样标记会使反应中的电子去向不明确,故在自身氧化还原的反应方程式中最好用双线桥法表示电子转移。
考点名称:氧化还原反应的配平配平简介:
化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。

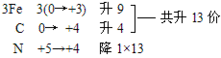
氧化还原反应方程式配平的一般方法与步骤:
一般方法:从左向右配。步骤:标变价,找变化,求总数,配系数。标出元素化合价变化的始态和终态求升价元素或降价元素化合价的变化数求化合价变化数的最小公倍数,分别作为氧化剂或还原剂的系数配平变价元素用观察法配平其他元素检查配平后的方程式是否符合质量守恒定律(离子方程式还要看电荷是否守恒)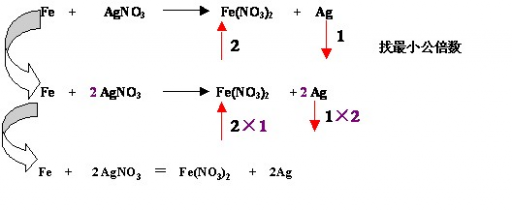
特殊技巧:
配平时若同一物质内既有元素的化合价上升又有元素的化合价下降,若从左向右配平较困难,可以采用从右向左配平,成为逆向配平法。
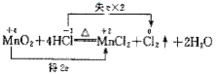
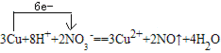
单线桥法步骤:
(1)标价态:明确标明发生氧化还原反应的元素的化合价
(2)连单线:连接方程式左边的氧化剂与还原剂,箭头一律指向氧化剂
(3)不注得失:标出转移的电子的总数,这里不用像双线桥那样,仅需直接标出电子总数
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1