一 : 什么是皂化反应和酯化反应??
什么是皂化反应和酯化反应??化学问题
皂化反应
皂化反应 皂化反应是碱催化下的酯水解反应,尤指油脂的水解。 狭义的讲,皂化反应仅限于油脂与氢氧化钠混合,得到高级脂肪酸的钠盐和甘油的反应(还有部分水)。这个反应是制造肥皂流程中的一步,因此而得名。 皂化反应除常见的油脂与氢氧化钠反应外,还有油脂与浓氨水的反应。 脂肪和植物油的主要成分是甘油三酯,它们在碱性条件下水解的方程式为: CH2OCOR | 加热 CHOCOR + 3NaOH --------> 3R-COONa + CH2OH-CHOH-CH2OH | CH2OCOR R基可能不同,但生成的R-COONa都可以做肥皂。常见的R-有: CH-:8-十七碳烯基。R-COOH为油酸。 CH-:正十五烷基。R-COOH为软脂酸。 CH-:正十七烷基。R-COOH为硬脂酸。 油酸是单不饱和脂肪酸,由油水解得;软、硬脂酸都是饱和脂肪酸,由脂肪水解得。 如果使用KOH水解,得到的肥皂是软的。 向溶液中加入氯化钠可以分离出脂肪酸钠,这一过程叫盐析。高级脂肪酸钠是肥皂的主要成分,经填充剂处理可得块状肥皂。 现象:在皂化锅中,充分搅拌并加热,油脂层逐渐减少,最后液体不出现分层,即说明皂化反应完成。 加入NaCl细颗粒,在液体上方出现固体,即析出的高级脂肪酸钠。 可用纱布过滤,干燥,添加一些添加剂,成型,即得到肥皂。 皂化反应和酯化反应不是互为可逆反应。
(www.61k.com”酯化反应 百科名片 酯化反应酯化反应,是一类有机化学反应,是醇跟羧酸或含氧无机酸生成酯和水的反应。分为羧酸跟醇反应和无机含氧酸跟醇反应何和无机强酸跟醇的反应两类。羧酸跟醇的酯化反应是可逆的,并且一般反应极缓慢,故常用浓硫酸作催化剂。多元羧酸跟醇反应,则可生成多种酯。无机强酸跟醇的反应,其速度一般较快。典型的酯化反应有乙醇和醋酸的反应,生成具有芳香气味的乙酸乙酯,是制造染料和医药的原料。酯化反应广泛的应用于有机合成等领域。目录[隐藏]
基本简介
反应特点
反应机理
典型反应
反应类型
基本简介
反应特点
反应机理
典型反应
反应类型
二 : 乙酸乙脂:乙酸乙脂-反应 ,乙酸乙脂-介绍
乙酸乙脂是一种无毒的化工原料,广泛应用于轻工业、食品工业、环保油漆、高档油墨、高档胶粘剂业和塑料薄膜印刷,作为药用辅料时必须是高质量乙酸乙酯。
乙脂_乙酸乙脂 -反应
当乙醇(CH3CH2OH)与乙酸(CH3COOH)反应时,乙醇脱去氢(H),乙酸脱去羟基(-OH),氢与羟基结合成水(H2O),那么,乙醇与乙酸剩下的部分结合成乙酸乙脂(CH3CH2COOCH3)。乙脂_乙酸乙脂 -介绍
近年来市场对乙酸乙脂的用量愈来愈大,由于它用途广泛,轻工业、食品工业、环保油漆、高档油墨、高档胶粘剂业和塑料薄膜印刷的发展,要求高质量乙酸乙脂作原料和溶剂。乙脂_乙酸乙脂 -乙酸乙酯的制取
CH3CH2OH+CH3COOH在有浓硫酸催化作用和加热条件下制得CH3COOCH2CH3和H2O乙脂_乙酸乙脂 -溶解性
微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。乙脂_乙酸乙脂 -外观与性状
外观:无色澄清油状液体。乙脂_乙酸乙脂 -用途
近年来市场对乙酸乙酯的用量愈来愈大,由于它用途广泛,轻工业、食品工业、环保油漆、高档油墨、高档胶粘剂业和塑料薄膜印刷的发展,要求高质量乙酸乙酯作原料和溶剂。三 : 实验报告 乙酸乙酯皂化反应 (超全思考题)
聊城大学 化学化工学院 聂虎 洋洋
乙酸乙酯皂化反应速度常相数的测定
一、实验目的
1.通过电导法测定乙酸乙酯皂化反应速度常数。
2.求反应的活化能。
3.进一步理解二级反应的特点。
4.掌握电导仪的使用方法。
二、基本原理
乙酸乙酯的皂化反应是一个典型的二级反应:
CH3COOC2H5?OH????CH3COO??C2H5OH
设在时间t时生成浓度为x,则该反应的动力学方程式为
?dx?k(a?x)(b?x) (8-1) dt
式中,a,b分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
dx?k(a?x)2 (8-2) dt
1x积分上式得: k?? (8-3) ta(a?x)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作x对t图,如果所的是直线,也可证明反应是二级(a?x)
反应,并可从直线的斜率求出k值。
不同时间下生成物的浓度可用化学分析法测定,也可用物理化学分析法测定。本实验用电导法测定x值,测定的根据是:
(1) 溶液中OH?离子的电导率比离子(即CH3COO?)的电导率要大很多。因此,
随着反应的进行,OH?离子的浓度不断降低,溶液的电导率就随着下降。
(2) 在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率
聊城大学 化学化工学院 聂虎 洋洋
就等于组成溶液的电解质的电导率之和。
依据上述两点,对乙酸乙酯皂化反应来说,反映物和生成物只有NaOH和NaAc是
强电解质,乙酸乙酯和乙醇不具有明显的导电性,它们的浓度变化不至于影响电导率的数值。如果是在稀溶液下进行反应,则
?0?A1a
???A2a
?t?A1(a?x)?A2x
式中:A1,A2是与温度、溶剂、电解质NaOH和NaAc的性质有关的比例常数;
?0,??分别为反应开始和终了是溶液的总电导率;?t为时间t时溶液的总电导率。由此三式可以得到:
x?(?0??t)a (8-4) ?0???
若乙酸乙酯与NaOH的起始浓度相等,将(8-4)式代入(8-3)式得:
k?
由上式变换为: 1?0??t? (8-5) ta?t???
?t?
作?t~?0??tkat??? (8-6) ?0??t
t图,由直线的斜率可求k值,即
m?11,k? kama
由(8-3)式可知,本反应的半衰期为:
t1/2?1 (8-7) ka
可见,两反应物起始浓度相同的二级反应,其半衰期t1/2与起始浓度成反比,由(8-7)式可知,此处t1/2亦即作图所得直线之斜率。
若由实验求得两个不同温度下的速度常数k,则可利用公式(8-8)计算出反应的活化能Ea。
聊城大学 化学化工学院 聂虎 洋洋 lnk2Ea?11????? (8-8) k1R?T1T2?
三、仪器和试剂
恒温槽1套;
电导仪1套;
锥形瓶(250mL)2只;
停表1块;
烧杯(250mL)1只;
容量瓶(100mL)2只; 移液管(20mL)2支; 比色管(50mL)2支; 0.02mol?L?1NaOH溶液; 0.02mol?L?1CH3COOC2H5溶液; 0.01mol?L?1NaOH溶液; 0.01mol?L?1CH3COONa溶液。
四、操作步骤
1.准确配制0.02mol?L?1的NaOH溶液和CH3COOC2H5溶液。调节恒温槽温度至25℃,调试好电导仪。将电导池(如图8-1)及0.02mol?L?1的NaOH溶液和CH3COOC2H5溶液浸入恒温槽中恒温待用。
2.分别取适量0.01mol?L?1的NaOH溶液和CH3COONa溶液注入干燥的比色管中,插入电极,溶液面必须浸没铂黑电极,置于恒温槽中恒温15分钟,待其恒温后测其电导,分别为G0和G?值,记下数据。
3.取20mL0.02mol?L?1的CH3COOC2H5溶液和20mL0.02mol?L?1的NaOH溶液,分别注入双叉管的两个叉管中(注意勿使二溶液混合),插入电极并置于恒温槽中恒温10分钟。然后摇动双叉管,使两种溶液均匀混合并导入装有电极一侧的叉管之中,同时开动停表,作为反应的起始时间。从计时开始,在第5、10、15、20、25、30、40、50、60分钟各测一次电导值。
4.在30℃下按上述三步骤进行实验。
五、数据记录和处理
将测得数据记录于下表:
聊城大学 化学化工学院 聂虎 洋洋
室温:18.6℃ 大气压:721.5
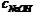
=0.02

=0.01
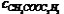

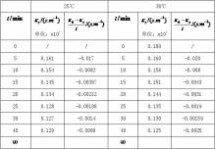
说明:其中温度为30℃时的实验数据为我小组所测,25℃时的数据是参考其他小组多得。
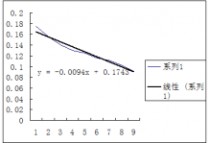
1.利用表中数据以对作图求两温度下的。
聊城大学 化学化工学院 聂虎 洋洋
25℃时的—图
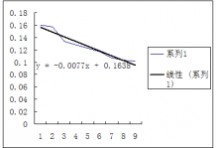
30℃时的 —图
2.利用所作之图求两温度下的25℃:测量的30℃:测量的=0.1964=0.1850,并与测量所得之 作图所得 作图所得进行比较。 =0.1743=0.1638
可以看出作图所求的两温度下的比测量值小一些,说明可能是测量时间太短,反应不完全所造成的,再就是可能数据处理存在着误差,使得结果偏小。
3.求此反应在25℃和35℃时的半衰期
由图象法可以求出半衰期分别为:25℃:
4.计算此反应的活化能。
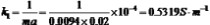
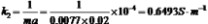
值。 30℃:

四 : 乙酸乙酯皂化反应
乙酸乙酯皂化反应
实验目的
1.测定乙酸乙酯皂化反应速率常数,了解反应活化能的测定方法。
2.了解二级反应的特点,学会用图解计算法求出二级反应的反应速率常数。 3.熟悉电导仪的使用方法。
实验原理
乙酸乙酯皂化反应是二级反应,反应式为:
CH3COOC2H5+Na++OH-→CH3COO-+Na++C2H5OH
反应的动力学方程为:
dx/dt=k(a-x)(b-x)
若a=b=c,dx/dt=k(c-x)2
积分后的:k=x/(t*c(c-x))
测得不同t时的x值,可由上式计算出不同t时的k值,如果k常数,就可证明反应是二级。作x/(c-x)-t图,若所得的是直线,也就证明反应是二级的,并可从直线的斜率求出k值。
用电导测定x的依据是:
1.假定整个反应是在稀溶液里进行的,可以认为是全部电离的,Na+反应前后浓度不变。OH-的电导率比Ac-大很多,随着反应的进行,溶液的电导率随着下降。
2.在稀溶液中,强电解质的电导率与其浓度成正比,总电导率等于溶液电解质的导电率之和。
L0=A1CNaOH L∞=A2CHAc
Lt=A1(C-x)+A2x
x=C*( L0- Lt)/( L0- L∞)
若乙酸乙酯与NaOH起始浓度相等(a=b)计算公式为:
( L0- Lt)/( Lt- L∞)=Ckt或1/( Lt- L∞)=Ck/( L0- Lt)*t
若乙酸乙酯与NaOH起始浓度不相等(a>b)计算公式为: ln(a*( L0- L∞)-b*( L0- Lt))/a(Lt- L∞)=(a-b)kt
仪器与药品
DJS-308型电导率仪1 台、恒温槽1套、分析天平1台、铂黑电极1只、双
管电导池1支、秒表1支…
新鲜制备的0.0200mol*L-1NaOH ,0.0100 mol*L-1NaAc,0.0100 mol*L-1NaOH,
0.0200mol*L-1CH3COOC2H5。
实验步骤
1.电导率仪的调节
2.溶液的配制
配制0.0100mol*L-1NaAc、0.0100mol*L-1NaOH、0.0200mol*L-1NaOH、
0.0200mol*L-1CH3COOC2H5的溶液。
3. L0和L∞的测量
用0.0100 mol*L-1NaAc装入干净的电导池A管中,液面高出铂黑片1cm为宜。25℃恒温10min,然后接通电导率仪,测定其电导率,即为L∞;测定0.0100 mol*L-1NaOH的电导,便为L0。
测量时每种溶液都必须更换一次,重复测定,同时误差在一定的范围之内。每次电导池都要先用蒸馏水淋洗电导池的铂电极三次,接着用待测液洗三次。
4. Lt的测定
将干燥、洁净的电导池放在恒温槽中夹好,用移液管分别移取25mL0.0200mol*L-1NaOH放入A管,25mL0.0200mol*L-1CH3COOC2H5放入B管。塞好塞子,以防挥发。
将铂电极经电导水冲洗后,用滤纸吸干电极上的水,(不要碰到铂黑),然后将电极插入A管中,恒温10min,打开B管塞子,用吸耳球迅速的将乙酸乙酯压入A管,压入一半时开始计时,反复抽压几次,便可混合均匀。每隔5min读一次数据,共测定1h。
实验结束后,将电极用蒸馏水洗净,插入有蒸馏水的试管中。
数据处理
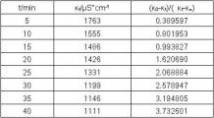
-1 -1
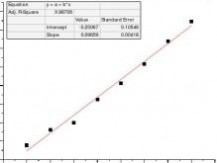
(k0-kt)/(kt-k∞
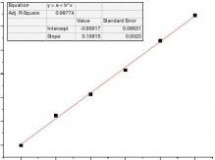
)t/min
乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低,反应速率也偏低,舍去5、10min两点作图。
(k0-kt)/(kt-k∞)t/min
速率常数测量值k=5.408dm3*mol-1*min-1 理论值k=6.42 dm3*mol-1*min-1 相对误差Er=-15.77%
思考题
1.为何本实验要在恒温条件下进行,而且乙酸乙酯和NaOH溶液在混合前还要预先恒温?
因反应速度与温度有关,温度每升高10℃,反应速度约增加2~4倍,同时电导率也与温度有关,所以实验过程中须恒温。且NaOH溶液和CH3COOC2H5溶液混合前要预先恒温,以保证反应在实验温度下进行。
2.制备乙酸乙酯溶液时,为什么在容量瓶中要事先加入适量的重蒸馏水?
乙酸乙酯沸点为77.06℃,挥发性强,可明显的问到乙酸乙酯蒸汽的香味,制备乙酸乙酯溶液时,为什么在在容量瓶中要事先加入适量的重蒸馏水,是为了防止滴落的乙酸乙酯,接触瓶底时飞溅,挥发为蒸汽。
3. 为什么乙酸乙酯和NaOH溶液浓度必须足够稀?
只有对稀溶液,强电解质的电导率?与其浓度成正比,才会推倒得到κt~(κ0-κt)/t作图为一直线,进而求得k值。
4.本实验除用电导法测量外,还可以用适用什么方法测量?
求反应速率的方法很多,归纳起来有化学分析法及物理化学分析法两类。化学分析法是在一定时间取出一部分试样,使用骤冷或取去催化剂等方法使反应停止,然后进行分析,直接求出浓度。这种方法虽设备简单,但是时间长,比较麻烦。物理化学分析法有旋光、折光、电导、分光光度等方法,根据不同情况可用不同仪器。这些方法的优点是实验时间短,速度快,可不中断反应,而且还可采用自动化的装置。但是需一定的仪器设备,并只能得出间接的数据,有时往往会因某些杂质的存在而产生较大的误差。
5.若b>a,公式是否适用?实验操作应有哪些变化?
要按k=2.303/t(a-b)log((a-x)/(b-x))或ln(a*( L0- L∞)-b*( L0- Lt))/a(Lt- L∞)=(a-b)kt计算,式中x=((κ0-κt)/( κ0-κ∞))*a(a是为两溶液中浓度较低的一个溶液浓度) 以κt~t作图,可得到κ0和κ∞的值,解出不同t时的x值,然后,就可求出k。
6.实验误差的来源是什么?
乙酸乙酯称量时会挥发;乙酸乙酯皂化反应系吸热反应,混合后体系温度降低,故在混合后的开始几分钟内所测溶液电导偏低。因此最好在反应4~6分钟后开始测定,否则所得结果呈抛物线形;如NaOH溶液和CH3COOC2H5溶液浓度不等,而所得结果仍用两者浓度相等的公式计算,则作图所得直线也将缺乏线性;温度对速率常数影响较大,需在恒温条件下测定。在水浴温度达到所要的温度后,不急于马上进行测定,须待欲测体系恒温10分钟,否则会因起始时温度的不恒定而使电导偏低或偏高,以致所得直线线性不佳。
实验讨论
1.实验中的注意事项:
本实验需用电导水,并避免接触空气及灰尘杂质落入; 配好的NaOH溶液要防止空气中的CO2气体进入; 乙酸乙酯溶液和NaOH溶液浓度必须相同, 用书中的公式k=(κ0-κt)/(( κ0-κ∞)*t*a) 计算速率常数时,要求所用的NaOH溶液和CH3COOC2H5溶液两者的浓度要相同; 由于CH3COOC2H5在稀溶液中能缓慢水解,会影响CH3COOC2H5的浓度,且水解产物CH3COOH又会消耗NaOH。所以CH3COOC2H5水溶液应在使用时临时配制。,CH3COOC2H5易挥发,故称量时应在称量瓶中准确称取,并需动作迅速; 记录电导率值时,注意单位的换算; 在测定κ0时,所用的蒸馏水最好先煮沸,以除去CO2;测κt时,叉型管中的NaOH溶液和CH3COOC2H5溶液必须在叉型管中的侧、直支管间多次来回反复混合,以确保混合均匀; 注意不可用纸擦电导电极上的铂黑。
2. 乙酸乙酯皂化反应机理
脂碱性水解是通过亲核加成-消除机理完成的,OH-先进攻脂羰基碳发生亲核加成,形成四面体中间体,然后消除C2H5O-,这两不反应均是可逆的。由于反应是在碱性条件下进行的,生成的羧酸可以和碱发生中和反应,从而移动了平衡。
3.根据二级反应动力学特点,半衰期t1/2=1/k/a=9.24min,反应进行30min90%的乙酸乙酯已水解、40min是95%、1h后是99%。
4.实验结果与理论值相差很大,可能的原因是由于时间原因,此次实验的溶液是别人配制的,乙酸乙酯和氢氧化钠的浓度是否严格相等不得而知,实验的偶然误差很大,即使实验数据的线性很好,实验结果也会有很大的偏差。
本文标题:乙酸乙酯皂化反应-什么是皂化反应和酯化反应??61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1