一 : 根据化学式:+4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为[]A.PbB
根据化学式: +4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为 +4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为 |
| [ ] |
A.Pb
B.PbO
C.Pb2O3
D.Pb3O4 |
题型:单选题难度:偏易来源:期中题
考点:
考点名称:质量守恒定律
质量守恒定律的概念及对概念的理解:(1)
概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)
对概念的理解:①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

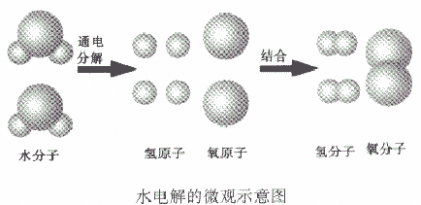
(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
 质量守恒定律的延伸和拓展理解:
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 |
| 元素的质量不变 |
| 微观 | 原子的种类不变 |
| 原子的数目不变 |
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
二 : 铅丹化学式
铅丹是什么样的一种药物?主要功效是什么呢?用药的不良反应有哪些?铅丹与浓硫酸反应生成PbCi2,Ci2和H2O请写出反应的化学方程式,说明如何检验反应中的有Ci生成请医生介绍下,谢谢。
参考建议:为橙红色或橙黄色的粉末,光泽暗淡,不透明,质重,用手指搓揉,先有沙性触及,后觉细腻,能使手指染成橙黄色。有金属性辛味。以色橙红,细腻光滑,无粗粒,见水不成疙瘩者为佳。不溶于水和酒精,能溶于硝酸,溶于盐酸则放出氯气。
参考建议:配龙骨,内服收敛神气,镇惊坠痰,用于癫狂,惊痫,烦躁失眠,心悸怔忡。外用收湿敛疮,治疗溃疡不敛,湿疮流水,金疮出血。炽热之,放出氧气,一部分变为氧化铅。

三 : 铅丹的性质和化学式是什么
铅丹的性质和化学式是什么
铅丹的性质和化学式是什么的参考答案
铅丹为铅的氧化物Pb3O4.生用或炒用.别名:黄丹、广丹、丹粉、真丹、铅华.味辛,微寒.归心、肝经.外用解毒生肌,内服截疟.用于各种疮疔,黄水湿疹,溃疡久不收口,毒蛇咬伤,疟疾,惊痫癫狂.外用适量;内服每次0.3-0.6g.本品有毒不可过量或持续服用,以防蓄积中毒.

本文标题:
铅丹的化学式-根据化学式:+4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为[]A.PbB 本文地址:
http://www.61k.com/1126225.html  +4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为
+4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为


 本文标题:铅丹的化学式-根据化学式:+4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为[]A.PbB
本文标题:铅丹的化学式-根据化学式:+4HNO3=PbO2+2Pb(NO3)2+2H2O,可推出铅丹的化学式为[]A.PbB