一 : 巴金 秋夜 短文分析答案
巴金 秋夜 短文分析答案
要全部,
一、淋漓尽致地表达出对鲁迅的怀念与追思之情.
鲁迅曾十分关心文学青年,为他们改稿、润色、乃至作序、推荐发表、集资出版,化费了大量的心血.对巴金,鲁迅特别关心,并有过很好的评价.鲁迅说,巴金“固然有‘安那其主义者’之称,但他并没有反对我们的运动……”(
二 : 普通化学参考答案(任丽萍)
普通化学习题参考答案
1 物质的状态、溶液和胶体
思考题与习题
1. 在相同温度下,几种压力相同、体积不同的气体混合,混合后保持总压力不变,总体积
与组分体积是什么关系?
2. 什么是临界温度?它与液体的正常沸点有何区别?
3. 最常用的表示浓度的方法有几种?
4. 什么是分散系?分散系是如何分类的?
5. 如何理解溶胶的稳定性?破坏溶胶稳定性的办法有哪些?
6. 试述明矾能净水的原理
7. 什么叫表面活性剂?其分子结构有何特点?
8. 试述乳浊液的形成、性质和应用。
9. 某容器中含有14.0g N2 、16.0g O2、、4.40gCO2, 20 ? 时容器的压力为200kPa,计算各气、
体的分压和该容器得体积。
解:该容器中各气体的物质的量分别为:
14.0gn(N)??0.5mol 2?128.0g?mol
16.0gn(O2)??0.5mol?1 32.0g?mol 4.40g n(CO2)??0.1mol?1 44.0g?mol
各气体的摩尔分数为:
0.5mol ?(N2)??0.455 (0.5?0.5?0.1)mol
0.5mol ?(O2)??0.455(0.5?0.5?0.1)mol
0.1mol?(CO2)??0.090 (0.5?0.5?0.1)mol
各气体的分压为:
P(N2)?0.455?200kPa?91kPa P(O2)?0.455?200kPa?91kPa
P(CO2)?0.90?200kPa?18kPa
根据气体状态方程pV = nRT得:
nRT(0.5?0.5?0.1)?8.31?(273.15?20)V?
1 p?200?13.4L
普通化学习题参考答案
10.人体注射用生理盐水中,含有NaCl 0.900%,密度为1.01g.cm-3,若配置此溶液300×103g,需NaCl多少克?该溶液物质的量浓度是多少?
解:配制该溶液需NaCl的质量为:
m(NaCl)?0.900%?300?103g?2700g
该溶液的物质的量浓度为:
2700g/58.5g?mol?1?1c(NaCl)??0.155mol?L 3?3?3(300?10g/1.01g?cm)?10
11.从某种植物中分离出的一种未知结构的有特殊功能的生物碱,为了测定其相对分子量,将19g该物质溶于100g水中,测得溶液的沸点升高了0.060K ,凝固点降低了0.220K 。计算该生物碱的相对分子质量。
解: 19?1000 ?Tb?kbbB?0.512??0.060 M?100
M?1.62?103g?mol?1
19?1000 ?Tf?kfbB?1.86??0.220 M?100
M?1.61?103g?mol?1
所以,该生物碱的相对分子质量为;
(1.61?1.62)?103g?mol?1
?1.62?103g?mol?1 2
12.溶解0.324g的 于4.00gC6H6中,使C6H6 的沸点上升了0.81K 。问此溶液中的硫分子是由几个原子组成的?
解:设此溶液中的硫分子由 x个硫原子组成,则其摩尔质量为32x g?mol-1 . 0.324
nB2.53?1bB???mol?kg ?3m4?10xA
由于?Tb?kbbB,Kb(C6H6)=2.53 K?kg?mol-1
所以
2
普通化学习题参考答案 ?Tb?0.81?2.53?
x?82.53x
故溶液中的1个硫分子是由8个硫原子组成的。
13. 101 mg胰岛素溶于 10.0ml水,该溶液在25.0? 时的渗透压是 4.34kPa,计算胰岛素的摩尔质量和该溶液的蒸气压下降Δp(已知25.0? 水的饱和蒸气压为3.17kPa)。
解:设胰岛素的摩尔质量为M, 由于渗透压可由下式计算
П=cBRT
所以
101?10?3g4.34kPa??8.314kPa?L?mol?1?K?1?298.15K?3 M?10?10L
M?5.78?103g?mol?1
该溶液的蒸气压下降为:
101?10?3
mol3 ?4?p?p*?B?3.17kPa??1?10kPa?3 101?1010?1.0(?)mol 5.78?10318.0
14.今有两种溶液,其一为1.50g尿素(NH2)2CO 溶于200g 水中;另一为42.8g未知物溶于1000g水中,这两种溶液在同一温度开始沸腾,计算这个未知物的摩尔质量。
解:由于两种溶液的沸点相同,故其沸点升高值相同,则它们的质量摩尔浓度相同。 设未知物的摩尔质量为M,可得如下关系:
1.5?100042.8?60?200M
M?342.4g?mol?1
所以,该未知物的摩尔质量为342.4g?mol-1。
15. 人体血浆的凝固点为272.59K,计算再正常体温(36.5? )下血浆的渗透压。(设血浆密度为1g?ml-1)
Kf=1.86 K?kg?mol-1
bB??Tf
Kf?273.15?272.59?0.30mol?kg?1 1.86
为计算方便,设有血浆1kg.。则其在36.5? 下的渗透压为:
??nBbBRT?RTV1kg/?0.30??8.314?(273.15?36.5) 31/10
?7.72?105Pa
3
普通化学习题参考答案
16.硫化砷溶胶是由H3AsO3和H2S 溶液作用而制得的
2H3AsO3 + 3H2S = As2S3 + 6H2O
试写出硫化砷胶体的胶团结构式(电位离子为HS-)。试比较NaCl、 MgCl2、 AlCl3三种电
解质对该溶胶的聚沉能力,并说明原因。
4
普通化学习题参考答案
2 原子结构
思 考 题
1、玻尔氢原子结构理论的要点及其主要贡献是什么?
答:玻尔氢原子结构理论主要有是(1)原子核外电子只能在符合玻尔量子化条件的、具有确定的半径和能量的稳定轨道上运动,电子在稳定轨道上运动时,既不吸收能量也不放出能量。(2)不同的原子轨道能量不同,轨道离核越远,能量越高;(3)电子在不同的轨道间跃迁时,才能发生能量的辐射或吸收;发射光谱的能量决定于两个轨道间的能量差。
玻尔氢原子结构理论的主要贡献是将量子化概念引入到了原子结构中,提出了电子运动的轨道和能量都是量子化的。该理论较好的解释了氢原子和类氢离子的发射光谱,使人们开始了对原子结构的系统、科学的认识。
2、微观体系中的电子运动与宏观物质比较,有什么不同?现代原子结构理论是如何来描述电子的运动状态的?
答:微观体系中的电子运动与宏观物质比较,最大的特点是其表现出来的波粒二象性,并且电子波是一种不同于机械波和电磁波的一种概率波。
现代原子结构理论是根据量子力学建立薛定谔方程,通过对薛定谔方程求解所得的波函数来描述电子的运动状态的,而波函数又是由量子数决定的,因此,通常可用四个量子数的一组取值来描述电子的一种运动状态。
3、量子力学的原子轨道概念与玻尔理论的原子轨道概念有什么不同?
答:量子力学的原子轨道是具有确定量子数取值的一个波函数,也叫原子轨函,它没有固定轨迹的含义;而玻尔理论的原子轨道则是指一个具有固定轨迹的、绕核的圆形轨道。
4、原子轨道和电子云的角度分布图有哪些异同?
答:两者相同之处在于:首先在于两者在空间出现了极大值的位置和大小是相同的,其次,两者在空间各个方面上的伸展趋势是相似的,即形状上有相似性。两者的不同之处在于:①原子轨道的角度分布图有正负之分,而电子云的角度分布只有正值;②p,d态电子云的角度分布图比原子轨道的角度分布要瘦小些。
5、4个量子数的取值和物理意义分别是什么?
答:主量子数n的取值为正整数,即n=1,2,3,4,5,6,7??,主量子数表明了原子轨道离核的远近,同时说明了原子轨道能量的高低。
角量子数l的取值规定为l=0,1,2,3??(n-1)。角量子数表明了原子轨道角动量的5
普通化学习题参考答案
大小,它体现的是原子轨道在空间各个方向上的伸展,即决定了原子轨道的形状,同时,还要影响多电子原子体系原子轨道的能量。
磁量子数的取值为m=0,±1,±2,??±(l-1)。磁量子数说明的是原子轨道在空间的伸展方向。
自旋磁量子数mS的取值只有+和-两种。它描述的是电子的自旋运动状态。
6、什么是屏蔽效应和钻穿效应?他们对原子轨道能量有何影响?
答:在多电子原子体系中,电子与电子间有相互排斥作用,特别是内层和同层电子对外层电子的排斥力削弱了原子核对外层电子的吸引力,这就叫做屏蔽效应,屏蔽效应使原子轨道的能量升高。主量子数较大而角量子数较小的原子轨道的电子云径向分布图有多个小峰,除其最高峰外,其余小峰伸入到了内层轨道的主峰内,这种现象叫钻穿效应,钻穿效应由于避免了内层电子的屏蔽效应,所以使原子轨道的能量降低。
7、多电子原子体系核外电子的排布遵循哪些规律?
答:多电子原子体系核外电子的排布遵循保利不相容原理、能量最低原理和洪特规则三规律。
8、元素原子第一电离能的周期性变化规律及其原因是什么?原子的各原子参数之间相互有何区别和联系?
答:同一周期的元素,从左到右,第一电离能的总体变化趋势是逐渐减小,到每周期的最后一个元素稀有气体时,第一电离能的数值达到最大。这是由于同一周期元素,从左到右,电子层没有变化,核电荷逐渐增加,原子半径逐渐减小,核对外层电子的吸引力增强的结果。同一族的元素,自上而下,第一电离能的总体变化趋势是逐渐减小的,这是因为从上到下,电子层数增加,原子半径变大,有效核电荷减小,核对外层电子的吸引力减弱的原因。
原子参数常包含原子半径、有效核电荷、电离能、电子亲和能和电负性等,它们分别表示了原子性质的各个方面,但各原子参数在周期表中都呈现出一定的周期性变化规律,并且这些周期性变化规律都是由于原子内电子有规律性排布的结果。
9、什么叫镧系收缩?什么叫镧系收缩效应?
答:对镧系和锕系元素,从左自右,由于增加的电子填充进入了倒数第三层的(n-2)f轨道,其对外层电子的屏蔽作用较大,因此,随着原子序数的增加,镧系元素原子半径缓慢的减小,这种现象叫着镧系收缩。由于屏蔽效应,使镧系元素原子半径减小缓慢,但镧系中14种元素原子半径减小的累计值还是不少的,因此到镧系后的几个第六周期副族元素的原12126
普通化学习题参考答案
子半径与相应的第五周期同族元素的原子半径十分接近,导致其性质也十分相似,这种现象叫做镧系收缩效应。
习 题
1、有无下列各组电子运动状态,为什么?
(1)n=2,l=1,m=0 ; (2)n=2,l=2, m=-1;
(3)n=2,l=0,m=-1; (4)n=2,l=3, m=2;
(5)n=3,l=2,m=-2; (6)n=4,l=-1,m=0;
(7)n=4,l=1,m=-2; (8)n=3,l=3, m=-3。
解:(1)、(5)有;(2)、(3)、(4)、(6)、(7)、(8)无,违背了四个量子数的取值规则。
2、在下列各组量子数中,填充合理的量子数。
(1)n≥?, l=2, m=0, ms=+ ;
(2)n=4, l=2, m=0, ms=?;
(3)n=2, l=0, m=?, ms=+ ;
(4)n=2, l=? m=1, ms=- 。
解:(1)、n≥3、4、5?? (2)、ms= +或- (3)、m=0 (4)、l=1
3、试说明下列符号表示的意义:(1) s (2) 3d (3) 2P。
解:(1)表示角量子数l=0的电子亚层;
(2)表示主量子数为3,角量子数l=2的电子亚层;
(3)表示主量子数为2,角量子数l=2的电子亚层中填有两个电子。
4、按照能量大小顺序排列下列原子轨道,并解释轨道能量的大小顺序。
(1)E1S,E4S,E3S,E2S; (2)E3d,E3S,E3P; (3)E4S,E3d。
解:(1)E1S<E2S<E3S<E4S ,角量子数相同,随着主量子数的增加,电子离核越来越远,故能量越来越大;
(2)E3S<E3P<E3d ,主量子数相同,随着角量子数的增加,电子离核越来越远,故能量越来越大;
(3)对单电子原子体系,原子轨道能量只决定于主量子数,所以E4S>E3d;对多电子原子体系,核电荷Z在15到20之间时,发生了能级交错,E4S<E3d ;核电荷Z在小于15或7 21212121212
普通化学习题参考答案
大于20时,E4S>E3d。
5、下列各原子的电子构型中,何者是基态、激发态或不正确的?
(1)1s2s2d (2)1s2s2p3s
2122262112241 8(3)1s2s2p (4)1s2s2p3s3p
22621 2 (5)1s2s2p3s3p
解:(1)、不正确(2)、激发态(3)、激发态(4)、不正确(5)、基态
6、用四个量子数描述基态N原子中最外电子层上的各电子的运动状态。
解: (1)n=2, l=0, m=0, ms=+ ;
(2)n=2, l=0, m=0, ms=-;
(3)n=2, l=1, m=0, ms=+(或-);
(4)n=2, l=1, m=1, ms=+ (或-);
(5)n=2, l=1, m=-1, ms=+(或-)。
7、写出Cr、Cu、Ag、V等原子和Co、Fe、Sn、I等离子的电子组态。
解:Cr、24 1S2S2P3S3P3d4S Cu、29 1S2S2P3S3P3d4S
Ag、47 1S2S2P3S3P3d4S4P4d5S V、23 1S2S2P3S3P3d4S
Co、27 1S2S2P3S3P3d Fe、26 1S2S2P3S3P3d
Sn、50 1S2S2P3S3P3d4S4P4d5S I、53 1S2S2P3S3P3d4S4P4d5S 5P6 2+226261026102-2262610261022+2262673+22626522626102610122626322262651226261012+3+2+-1212121212121212
8、不查周期表,分别写出下列元素在周期表中的位置(周期、族、区),元素符号及名称。 ⑴ Z=47;
⑵ 基态原子中有3d电子;
⑶ 基态原子中有两个未成对的3d电子;
⑷ 基态原子的电子构型为[Kr]4d5s;
⑸ 基态原子的外层电子组态为3d4s。
解: (1)银,Ag,第五周期,第IB族;
(2)铁,Fe,第四周期,第VIII族;
(3)钛,Ti,第四周期,第IVB族或镍,Ni,第四周期,第VIII族;
(4)铌,Nb,第五周期,第VB族;
8 12416
普通化学习题参考答案
(5)钪,Sc,第四周期,第IIIB族。
9、不用查表确定下列各组元素中电离势最大的一个元素。
⑴ Na,Mg,Al; ⑵ Na,K,Rb;
⑶ Si,P,S; ⑷ K,Ca,Mg。
解:(1)Mg ⑵ Na ⑶ P ⑷ Mg
10、A、B两元素,A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,写出A、B两原子的名称和电子排布式。
解:A,钒,V、23 1S2S2P3S3P3d4S
B,硒,Se、34 1S2S2P3S3P3d4S 4P
11、ⅠA和ⅠB族元素的最外层电子数都是1,但它们的金属性强弱却很不同,试从有效和电荷数和原子半径两方面予以解释。
解:同周期的ⅠA族元素与ⅠB族元素比较,两者电子层数相同,但ⅠB族元素核电荷比ⅠA族元素原子多,虽有屏蔽效应,可ⅠB族元素原子的有效核电荷仍比ⅠA族元素的大,ⅠA族元素原子半径比ⅠB族元素的大,ⅠB族元素原子的核对外层电子的吸引力强,所以ⅠA族元素原子的电离能小,易失去电子,金属性强,ⅠB族元素原子正好相反,不易失去电子,
金属性弱。2262610242262632
9
普通化学习题参考答案
3 化学键与分子结构思考题习题答案
思 考 题
1、共价键和离子键有无本质的区别?两者各有什么特点?
答:两者并无本质的区别,从本质上来讲,两者都是电性作用力,由于离子极化,使离子键逐渐向共价键过渡。共价键既有方向性,也有饱和性;但离子键既无方向性,也无饱和性。
2、共价键的两种类型?键和?键是怎样形成的?各有何持点?
答:原子轨道沿着键轴头碰头的重叠形成的共价键叫?键,?键重叠程度较大,键能高,稳定性好;并且?键针对键轴呈圆柱形的对称,成键的两原子绕着键轴任意相对旋转,?键不会被破坏;沿着键轴,原子轨道“肩并肩”的重叠形成的是?键。由于?键是原子轨道“肩并肩”的重叠形成的,因此,其重叠程度较小,键能低于?键,稳定性较差,含有?键的物质化学性质活泼,容易参加化学反应。另外,由于?键针对键轴反对称,所以以?键结合的两原子就不能相对旋转,否则?键将被破坏。
3、什么叫极性共价键?什么叫做极性分子?键的极性和分子的极性有什么关系? 答:化学键中正负电荷重心不重合的共价键叫做极性共价键,正负电荷重心不重合的分子叫做极性分子。分子的极性是由共价键的极性和分子的空间构型共同决定的。对于双原子分子来说,分子的极性与共价键的极性是一致的,由极性共价键构成的双原子分子,必然是极性分子,由非极性共价键构成的双原子分子必然为非极性分子。对于三个或三个以上的原子构成的多原子分子,一般由非极性共价键构成的多原子分子是非极性分子,如P5、S8等,由极性共价键构成的多原子分子,如果分子的空间构型是完全对称的,共价键的极性被抵消,正负电荷重心正好重合,就是非极性分子,如果分子的空间构型不对称,正负电荷重心不重合,就是极性分子。
4、分子轨道理论对物质的顺磁性是如何解释的?举例说明。
答:根据分子轨道理论,原子轨道线性组合成分子轨道,能量升高的叫反键轨道,能量降低的叫成键轨道。电子在分子轨道中的填充仍然要遵循电子排布三原理,因此,分子轨道中就可能有成单电子,有成单电子的物质就是顺磁性物质。例如O2,起电子组态为:
2?2202:kk?2S?2S?2Px2?12?1???2?2Pz2Pz Py2Py
两个反键?轨道中各有一个成单电子,所以O2是顺磁性物质。
5、价层电子对互斥理论是怎样确定中心原子的价层电子对数的? 价层电子对数?答:中心原子价电子数?配位原子提供的成键电子数?离子电荷数 2
6、试说明乙烯分子中各种共价键的类型及碳原子的杂化轨道类型。
答:碳原子以SP杂化轨道和氢原子的1S轨道重叠成键,4个氢原子与2个碳原子形成2
10
普通化学习题参考答案
4个?键,2个碳原子之间的双键,其中一个是?键,一个是?键。整个乙烯分子的各个原子处于同一平面内。
7、四种晶体的结构和性质有何异同?
答:表3-13 四种晶体的比较
8、什么叫离子极化?离子极化对物质性质有何影响?
答:离子是带电的,任何一个离子对另一个离子来说都相当于一个外加电场。当离子相互靠近时,任何一个离子都有使其它离子变形的能力,每个离子也总是会在其它离子的极化力下发生变形,产生诱导偶极,这就叫做离子的极化。
离子极化使物质化学键由离子键向共价键过渡,使晶体结构向配位数减小的方向、由离子型向分子型过渡。离子极化越强,物质的热稳定性越差,物质的熔点、沸点就越低,水解程度越大,颜色越深。
9、什么是分子间作用力?分子间作用力有何特点?
答:分子与分子之间由偶极矩产生的作用力叫分子间作用力,有取向力、诱导力和色散力三种。
分子间作用力的特点是:既没有方向性也没有饱和性,比化学键能小得多,是近程力,作用范围很小,只有几个pm,三种分子间力的存在范围和在分子中的相对大小都是不同的。
10、氢键是怎样形成的?氢键的怎样形成对物质性质有什么影响?
答:当氢原子与一个电负性大的X原子以共价键结合后,共价键中的共用电子对强烈的偏向X原子,使氢原子带上了部分正电荷,几乎成为裸露的质子,它可以吸引与其靠近的另一个电负性较大的、带有孤对电子的Y原子,H原子与Y原子结合就形成了氢键。
分子间若能生成氢键,物质的熔点、沸点要升高;如果溶质与溶剂分子能够形成分子间氢键,则溶质的溶解度要增大;氢键的形成对物质的粘度、表面张力、比热容等很多性质都有影响。
习 题
1、NaF和MgO中离子的电子构型相同,但MgO的硬度是NaF的两倍,MgO的熔点为2800℃,比NaF的熔点993℃高得多,为什么?
答:NaF和MgO均为离子化合物,其结合力离子键与离子半径、电荷和电子构型有关,NaF和MgO比较,后者离子电荷的乘积比前者大4倍,所以离子间的结合力大,离子键牢固,其硬度和熔点都要大得多。
2、氧化物MgO、CaO、SrO、BaO均是NaCl型离子晶体,据离子键理论定性比较它们的晶格能大小和熔点的高低。
答:阴离子相同,阳离子半径从左到右逐渐增大,离子间作用力逐渐减弱,所以从左到右,各离子化合物的晶格能逐渐减小,熔点逐渐降低。
11
普通化学习题参考答案
3、写出O2,O?分子或分子离子的分子轨道式,并比较它们的稳定性,判断它们的磁,O?22
性。
222?22答: O2:kk?2S?2S?2Px?2Py?2Pz
2?22 O?2:kk?2S?2S?2Px
2?22 O?2:kk?2S?2S?2Px?1?1?2Py?2Pz 键级=2 2?22?1???2?2Pz2Pz 键级=1.5 Py2Py2?12??2?2PzPy2Py 键级=2.5
??? 从键级来看,O?由于轨道中都有成单电2>O2>O2,所以稳定性大小顺序为O2>O2>O2;
子,故三者都是顺磁性的。
4、BF3和NF3的杂化轨道类型和分子几何构型分别是什么?它们是极性还是非极性分子?
答:BF3 SP杂化,平面三角形,非极性分子;
NF3 SP不等性杂化,三角锥形,极性分子。
5、利用价层电子对互斥理论判断下列分子或离子的空间几何构型:
2???3?PO3(1)BeCl2(2)SnCl2(3)PH?(4)SO3(5)AlF(6)PCl5(7)SO2
4(8)SF6(9)4(10)O3 46
2?答:(1)BeCl2 直线形,(2)SnCl2 V形,(3)PH? 正四面体形,(4)SO3 三角锥形, 4
?3?(5)AlF 正八面体形,(6)PCl5 三角双锥形,(7)SO2(8)SF6 正八面体形,4 正四面体形,6
?(9)PO3
4 正四面体形,(10)O3 V形。 23
6、根据离子极化理论解释: AgF、AgCl、AgBr、AgI的熔、沸点,溶解度和颜色的变化顺序。
答:AgF、AgCl、AgBr、AgI各物质从左到右,阳离子相同,阴离子的离子半径逐渐增大,阴离子的离子的变形性增大,离子极化逐渐增强,所以熔、沸点逐渐降低,在水中的溶解度逐渐减小,颜色逐渐加深。
7、将下列分子按化学键的极性大小依次排列,并说明原因:F2、HF、HCl、HBr、HI、NaF。
答:F2为同核双原子分子,F原子间形成的是非极性共价键;NaF为典型的离子型化合物,键的极性是最强的;HF、HCl、HBr、HI各无物质从左到右,形成共价键的两原子的电负性差越来越小,共价键的极性也越来越小;所以其化学键的极性大小依次为F2<HF<HCl<HBr<HI<NaF。
8、下列各对分子间存在的分子间力有哪些,是否存在氢键?
(1)H2~H2, (2)H2O~H2O, (3)NH3~H2O, (4)CCl4~H2O
答:(1)H2~H2,存在色散力,无氢键;(2)H2O~H2O,存在取向力、诱导力和色散力,有分子间氢键;(3)NH3~H2O,存在取向力、诱导力和色散力,有分子间氢键;(4)CCl4~H2O,存在诱导力和色散力,无分子间氢键。
9、下列物质哪些能形成分子间氢键,哪些能形成分子内氢键,哪些不能形成氢键? 12
普通化学习题参考答案
(1)苯,(2)NH3,(3)C2H6,(4)水杨醛,(5)对羟基苯甲醛,(6)H3BO3
答:(1)苯,不能形成氢键;(2)NH3,分子间氢键;(3)C2H6,不能形成氢键;(4)水杨醛,分子内氢键;(5)对羟基苯甲醛,分子间氢键;(6)H3BO3,分子内氢键。
10、判断下列晶体类型,并指出其结合力分别是什么?
(1)NaCl (2)SiC (3)CO2 (4)Pt
答:(1)NaCl,离子晶体,结合力为离子键;(2)SiC ,原子晶体,结合力为共价键;
(3)CO2,分子晶体,结合力为分子间力; (4)Pt,金属晶体,结合力为金属键。 13
普通化学习题参考答案
4 化学热力学基础
1、判断下列说法是否正确,并说明理由。
(1)指定单质的?fGm?、?fHm?、Sm?皆为零。
(2) 热力学标准态下的纯气体的分压为100 kPa,温度为298.15K。
(3) ?rGm? <0的反应必能自发进行。
(4) 298.15K时,反应O2(g)+S(g)=SO2(g)的?rGm?,?rHm?,?rSm?分别等于SO2(g)的
?fGm?,?fHm?,Sm?。
(5)随温度升高,反应C ( s ) + 1
2O2 ( g ) = CO ( g )的?r Gm?降低。
(6)T K时,反应的?r Gm与?r Gm? ( 298 ) 的关系为?r Gm ( T ) = ?r Gm?(298 ) + RT lnQ
答:(1)错。指定单质的?fGm?,?fHm?皆为零,但Sm?不为零。
(2) 错。在化学热力学中选100 kPa为标准压力,用p? 表示。把处于温度T、压力为p?状态下的纯固体、纯液体和纯理想气体分别作为固体、液体、气体的标准状态。此处温度T没有给定,对应每个T都有一个标准状态。298.15K仅仅是经常选用的温度。
(3)错。?rGm?只能判断标准状态下反应是否自发进行。
(4)错。S(g)不是指定单质,而且Sm?有绝对值,不能用类似的办法计算。
(5)对。该反应的?r Hm? ( 298K ) <0, ?r Sm? ( 298K )>0。
(6)错。等温方程式中的?r Gm与?r Gm? 必须在同一温度下。
2、指出下列各关系式成立的条件
(1)?U=Qv (2)?H=Qp (3)?G=?H—T?S
答:(1)等温等容,系统不做非体积功 (W非=0);
(2)等温等压,系统不做非体积功(W非=0);
(3)等温,且系统无非体积功。
3、指出下列过程?G,?H,?S的正、负号,并说明使过程自发进行的温度条件
(1)气体被吸附在固体表面;
+-(2)Ag(aq)+I(aq)=AgI(s);
(3)MgCO3(s)=MgO(s)十CO2(g);
(4)冰在常温下融化。
答: (1)?S <0 ?H<0 ,低温自发(?G<0),高温不自发(?G >0);
(2)?S <0 ?H<0 ,低温自发(?G<0),高温不自发(?G >0);
(3)?S >0 ?H>0 ,高温自发(?G<0),低温不自发(?G >0);
(4)?S >0 ?H>0 ,高温自发(?G<0),低温不自发(?G >0)。
4、一热力学系统在等温定容的条件下发生一变化时,放热15kJ,同时做电功35kJ.假若系统在发生变化时,不做非体积功(其他条件不变),计算系统能放出多少热。
解: 由题意知, Q=-15kJ,W=-35kJ;
故△U=Q+W=-15kJ-35kJ = -50 kJ
等温定容,不做非体积功 QV=△U=-50kJ
5、由下列热力学数据计算NaCl(s)的晶格能U ⑴11Cl 2(g)=Cl(g) ?rHm?= D=119.8kJ·mol-1
22
⑵Na(s)=Na(g) ?rHm?=S=108.4kJ·mol-1
14
普通化学习题参考答案
⑶Na(g)=Na(g)+e ?rHm?=I1=495.8kJ·mol-1
--⑷Cl(g)+e=Cl(g) ?rHm?=E=-348.7kJ·mol-1 +-
⑸Na(s)+1Cl2(g)=NaCl(s) ?rHm?=?fHm?=-411.2 kJ·mol-1 2
解:(5)-(1)-(2)-(3)-(4)得:
+-Na(g)+Cl(g)=NaCl(s) ,?rHm?= - U(以正值表示)
-U = ?rHm?(5)-?rHm?(1)-?rHm?(2)-?rHm?(3)-?rHm?(4)
=?fHm?-1D -S-I1-E 2
= -411.2 kJ·mol-1-119.8kJ·mol-1-108.4kJ·mol-1-495.8kJ·mol-1+348.7kJ·mol-1
= -786.5 kJ·mol-1
U 取正值,故晶格能为786.5 kJ·mol-1
6、生物体内有机物的分解氧化对菌体的生长、营养的消耗十分重要。例如醋酸杆菌可通过乙醇氧化反应而获得生产所需要的能量,其过程分两步完成:
CH3CH2OH? CH3CHO ? CH3COOH
请根据下列反应及其反应热计算生物体内乙醇被氧化成乙醛及乙醛被进一步氧化成乙酸的反应热。
(1)CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ?rHm?=-1371 kJ·mol-1
(2)CH3CHO(l)+5O2(g)=2CO2(g)+2H2O(l) ?rHm?=-1168 kJ·mol-1 2
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ?rHm?=-876 kJ·mol-1
解:由(1)-(2)得:CH3CH2OH(l)+1/2O2(g) = CH3CHO(l)+ H2O(l)
?rHm? = ?rHm?(1)- ?rHm?(2)
= (-1371 kJ·mol-1)-(-1168 kJ·mol-1)= -203 kJ·mol-1
由(2)-(3)得:CH3CHO(l)+1/2O2(g) = CH3COOH(l)
?rHm? = ?rHm?(2)- ?rHm?(3)
= (-1168 kJ·mol-1)-(-876 kJ·mol-1)= -292 kJ·mol-1
7、已知甲醇的标准燃烧热为-726.6 kJ·mol-1,即
[CH3OH(l)+3O2(g)→CO2(g)+2H2O(l)], 2
H2O(l) ?fHm?=-285.8kJ·mol-1,CO2(g) ?fHm?=-393.5 kJ·mol-1,求甲醇的?fHm?。 解:?rHm? = 2?fHm?(H2O(l))+ ?fHm?(CO2(g))-?fHm?(CH3OH(l))- 3?fHm?(O2(g)) 2
-726.6 kJ·mol-1= 2×(-285.8 kJ·mol-1)+(-393.5 kJ·mol-1)-?fHm?(CH3OH(l))-3×0 2 ?fHm?(CH3OH(l))=-238.5 kJ·mol-1
15
普通化学习题参考答案
8、化学反应A(g)+B(g)=2C(g), A、B 、C均为理想气体。在25℃,标准状态下,该过程分别依两个不同途径完成:(1)不作功,放热40 kJ;(2)作最大功,放热2 kJ。则在(1)、(2)两种情况下,计算两个过程的ΔH?、ΔG?、ΔS?。
解:ΔH?、ΔG?、ΔS?均为状态函数,其变量与途径无关,反应在标准状态下进行,故为等压过程,根据(1)Qp =ΔH? = -40 kJ
∵ ΔH?=ΔU?+pΔV=ΔU?+ΔnRT=ΔU?=-40kJ
根据(2)ΔU?=Q+W=-2kJ+W
W=-38kJ
又∵pΔV=ΔnRT=0 ∴此最大功为非体积功。
∴ΔG?=W=-38kJ
??3ΔS?=△H?△G?(?40?38)?10J=-6.7J·K-1
T298K
9、计算下列反应在标准状态下,298.15K时的?rGm?,并判断该条件下反应自发进行的方向。
⑴2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)
⑵SiO2(s)+4HF(g)=SiF4(g)+2H2O(g)
⑶I2(s)=I2(g)
⑷4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
解:(1)?rGm?=2?fGm?(Fe)+?fGm?(Al2O3)- ?fGm?(Fe2O3)-2?fGm?(Al)
= 2×0 +(-1576 kJ·mol-1) - (-741.0kJ·mol-1) -2×0
= -835.0kJ·mol-1<0
标准状态下,反应可自发。
(2)?rGm? = 2×?fGm?(H2O(g))+?fGm?(SiF4(g))- ?fGm?(SiO2(s))-4×?fGm?(HF(g))
=2×(-228.6 kJ·mol-1)+(-1506.2kJ·mol-1)(--805.0 kJ·mol-1)- 4×(-270.7 kJ·mol-1) =-75.6 kJ·mol-1
标准状态下,反应可自发。
(3)?rGm?=?fGm?(I2(g))- ?fGm?(I2(s))
=19.4 kJ·mol-1 - 0kJ·mol-1) =19.4 kJ·mol-1
标准状态下,反应不自发。
(4)?rGm?=4×?fGm?(Fe(OH)3(s))-2×?fGm?(H2O(l))- 4×?fGm?(Fe(OH)2(s))
=4×(-694.5kJ·mol-1)-2×(-237.2 kJ·mol-1) - 4×(-483.6kJ·mol-1)
= -369.2kJ·mol-1
标准状态下,反应可自发。
10、试根据下列数据,推断哪些氮的氧化物能在高温标准态下由N2 (g)和O2 (g)化合而生成(说明推断过程)。已知298 K时有关热力学数据:
?f Hm?? kJ?mol?1
?f Gm?? kJ?mol?1 N2O ( g ) 82 104 NO ( g ) 90 87 N2O3 ( g ) 83 139 NO2 ( g ) 33 51
解: (1) N2 (g) + 1/2 O2 (g) = N2O ( g )
(2) 1/2 N2 (g) + 1/2 O2 (g) = NO ( g )
(3) N2 (g) + 3/2 O2 (g) = N2O3 ( g )
16
普通化学习题参考答案
(4) 1/2 N2 (g) + O2 (g) = NO2 ( g )
根据题意,只有熵增反应才可能高温自发,
由 ?rGm? (T)= ?rHm? -T ?rSm?得:
T ?rSm?=?rHm? - ?rGm? (T)>0
即 ?rHm? > ?rGm? (T)
只有(2)符合条件,可推断NO ( g ),即反应(2)能在高温标准态下由N2 (g)和O2 (g)化合而成。
11、在101.3kPa和80.1℃下,苯的气化热Q=30.5kJ·mol-1,计算该条件下,苯的气化过程的?Um、?Hm、?Gm、?Sm。
解:C6H6(l) = C6H6(g),
?Hm=Qp=30.5kJ·mol-1,
对于等温等压下的相变过程:?Gm=0
?Gm = ?Hm-T?Sm
△Hm30.5?103J?mol?1=86.34J·mol-1·K-1 ?T353.25K
?Hm = ?Um+?nRT ∵?n≈ 1 mol ?Sm=
?Um =?Hm -?nRT=30.5kJ·mol-1-8.314×103kJ·mol-1·K-1×353.25K
= 27.6 kJ·mol-1 -
12、室温下暴露在空气中的金属铜,表面层因生成CuO(黑)而失去光泽,将金属铜加热到一定温度T1时,黑色CuO转化为红色Cu2O,再继续加热至温度升至T2时,金属表面氧化物消失,写出上述后两个反应的方程式,并估计T1,T2的取值范围。
解: 2CuO(s) = Cu2O(s)+1/2O2(g) (1)
Cu2O(s)= 2Cu (s)+1/2O2(g) (2)
设加热到T1时,CuO开始转变为Cu2O,则T1为转变温度。
?rHm?=?fHm?(Cu2O(s))- 2×?fHm?(CuO(s))
= -166.69kJ·mol-1- 2×(-155.23)kJ·mol-1 = 143.77 kJ·mol-1
?rSm?=1Sm?(O2(g))+Sm?(Cu2O(s))- 2×Sm?(CuO(s)) 2
= 1×205.03J·mol-1·K-1 + 100.83J·mol-1·K-1 -2×43.51J·mol-1·K-1 2
= 116.3J·mol-1·K-1
?△rHm143.77?103J?mol?1
T 1= =1236K ???1?1△rSm116.3J?mol?K
同理:?rHm?=1?fHm?(O2(g))+2?fHm?(Cu(s))-?fHm?(Cu2O(s))=166.69 kJ·mol-1 2
?rSm?=1 Sm?(O2(g))+2Sm?(Cu(s))- Sm?(Cu2O(s))=68.29 J·mol-1·K-1 2
?△rHm
?△rSmT2=166.69?103J?mol?1=2441K ??1?168.29J?mol?K
故 1236K < T1 <2441K ,T2 > 2441K
17
普通化学习题参考答案
13、已知298.15K标准态下,Sm?(S,正交)= 31.8J·mol-1·K-1 ,Sm?(S,单斜)= 32.6J·mol-1·K-1 S(单斜)+O2(g)=SO2(g) ?rHm? =-297.2kJ·mol-1
S(正交)+O2(g)=SO2(g) ?rHm?=-296.9kJ·mol-1
计算说明在标准态下,温度分别为25℃和95℃时两种晶型硫的稳定性。
解:(1)-(2)得: S(单斜) = S(正交)
?rHm?= -297.2 kJ·mol-1-+296.9kJ·mol-1 = -0.3 kJ·mol-1<0
?rSm?=31.8 J·mol-1·K-1 –32.6 J·mol-1·K-1= -0.8J·mol-1·K-1<0
低温自发,
?△rHm
?△rSmT=?0.3?103J?mol?1=375K= 102 ℃ ??1?1?0.8J?mol?K
温度低于102 ℃时均正向自发,故25℃,95℃时,正交硫比单斜硫稳定。
14、反应H2 ( g )+F2 (g) = 2HF(g)被建议用于火箭的推进。估算1000 ?C、标准态下,每生成 1g HF,最多能对火箭做多少非体积功?M ( HF ) = 20 g?mol?1。 已知298 K时Sm?(H2,g)=131.0J?mol?1?K-1,Sm?(F2,g)=203.3J?mol?1?K-1,Sm?(HF,g)=175.3J?mol?1?K-1, ?fGm?(HF,g)=-271kJ?mol?1。
解: H2 ( g ) + F2 (g) = 2HF(g)
Sm?(298K)/J?mol?1?K-1 131.0 203.3 175.3 ?fGm?(298K)/kJ?mol?1 0 0 -271
?rGm? (298K)= 2×(-271)kJ?mol?1 = - 542 kJ?mol?1
?rSm? (298K)= 2×Sm?(HF,g)- Sm?(F2,g)- Sm?(H2,g) = (2×175.3-203.3-131.0)J?mol?1?K-1 = 16.3J?mol?1?K-1
?rGm? (298K)= ?rHm? (298K)-T ?rSm? (298K)
?rHm? (298K)=?rGm? (298K)+ T ?rSm? (298K)
= - 542 kJ?mol?1 + 298 ×0.0163 kJ?mol?1 = -537.14 kJ?mol?1
1000 ?C、标准态下,?rGm? (1273.15K)≈ ?rHm? (298K)-T ?rSm? (298K)
≈ -537.14 kJ?mol?1 -(1273.15K)×0.0163kJ?mol?1= -557.89 kJ?mol?1 由于 ?rGm = - W,
557.89kJ?mol?1
-11g HF最多能对火箭做非体积功为:= 13.95 kJ·g ?12?20g?mol
15、生石灰(CaO)是由石灰石(CaCO3)高温分解得到的,请利用有关的热力学数据,估计标准状态下,石灰石的分解温度
解:石灰石(CaCO3)热分解温度可由分解反应在标准压力下(100kPa)达平衡时的温度来估算。
CaCO3(s) = CaO(s) + CO2(g)
?rHm?(298K)= ?fHm?(CaO,s,298K) + ?fHm?(CO2,g,298K) - ?fHm?(CaCO3,s,298K) =-635.55 kJ·mol-1 -393.51 kJ·mol-1 +1206.88 kJ·mol-1 =177.82 kJ·mol-1 ?rSm?= Sm?(CaO,s,298K) +Sm?(CO2,g,298K) - Sm?(CaCO3,s,298K)
18
普通化学习题参考答案
=39.75 J·mol-1·K-1+213.64 J·mol-1·K-1-92.89 J·mol-1·K-1=160.5 J·mol-1·K-1 根据?rGm?(T)≈ ?rHm? (298K)-T ?rSm? (298K)=0 得
T=?△rHm
?△rSm177.82?103J?mol?1 =1108K ?160.5J?mol?1?K?1
石灰石的分解温度约为1108K。
16 、某气体反应, ?r Hm?=10.5 kJ?mol?1,?r Sm?= 41.8 J?mol?1 ? K ?1,一定温度下达平衡时各物质分压均为100 kPa。估计反应温度。
解:定温下达平衡,故?r Gm?= 0;
反应温度T=?△rHm
?△rSm10.5?103J?mol?1= 251.2 K ??1?141.8J?mol?K
4-17 、298K时,反应:
(1) HF ( aq ) + OH? ( aq ) = H2O ( l ) + F? ( aq ) , ?r Gm?= ? 61.86 kJ?mol?1
(2) H2O (l) = H? ( aq ) + OH? ( aq ) , ?r Gm?= 79.89 kJ?mol?1 计算HF在水中离解反应HF(aq)=H?(aq)+F?(aq)的?rGm?。若c (HF) = c (F? )=0.1mol?L?1 时,HF在水中离解反应正向自发,介质pH应在何范围?
解:(1)+(2) 得:HF(aq)=H?(aq)+F?(aq)
?rGm? = ?rGm?(1) + ?rGm? (2)
= ? 61.86 kJ?mol?1 + 79.89 kJ?mol?1 = 18.03 kJ?mol?1
根据题意,HF在水中的离解正向自发,则
?rGm = ?rGm?+RT ln Q < 0 [c(H?)/c?][c(F?)/c?]RTln<-?rGm? ?c(HF)/c
0.1c(H?)/c?
8.314J·mol·K ×298K ×ln < -18030 J·mol-1 0.1-1-1
c (H?) /c<6.9×10-4
pH ? 3.16
?
19
普通化学习题参考答案
5 化学平衡
1、判断下列叙述是否正确:
(1) 化学反应商Q和标准平衡常数K的单位均为1。
?(2) 对ΔrH?
m<0的反应,温度越高,K越小,故ΔrGm越 大。 ??
(3) 一定温度下,1,2两反应的标准摩尔吉布斯自由能之间的关系为
2?ΔrG?(1)=2ΔG(2),则两反应标准平衡常数间关系为:K(2)=[K(1)]。 rmm??
(4) 从化学平衡的角度看,升高温度,有利于吸热反应;降低温度有利于放热反应。
(5) 由于反应前后分子数相等,所以增加系统压力对化学平衡没有影响。
答:(1)正确。
(2)错误。ΔrG?
m的代数值越大。
(3)错误。K(1)=[K(2)]2。
(4)正确。
(5)错误。对于反应前后气体分子数相等的反应,增加系统压力对化学平衡没有影响。
2、673 K时,反应N2(g)+3H2 (g)= 2NH3(g)的K= 6.2×104,计算反应-???
NH3(g)=13?N2(g)+H2(g) 的K。 22
?解:找出两个反应之间的关系,再根据K的表达式推导得到:
[ K]2=
K= 40
3、已知下列反应在指定温度的ΔrG?
m和K:
(1) N2(g)+???1 6.2×104 -1?O2(g)=N2O(g), ΔrG?
m(1), K(1); 2
? (2) N2O4(g)=2NO2(g), ΔrG?
m(2), K(2);
(3) 1?N2(g)+O2(g)=NO2(g), ΔrG?
m(3), K(3); 2
?计算反应 (4) 2N2O(g)+3O2(g)=2N2O4(g)的ΔrG?
m和K。
解:(4)=4×(3)- 2×(1)-2×(2)
???根据热化学定律:ΔrG?
m= 4×ΔrGm(3)-2×ΔrGm(1)-2×ΔrGm(2)
20
普通化学习题参考答案
4[K(?3)] 根据多重平衡规则: K??[K]?[K]?2
(1)?2(2)
4、(1) 写出反应O2(g)=O2(aq)的标准平衡常数表达式,已知20℃、p(O2)=101 kPa时,氧气在水中溶解度为1.38×10-3 mol·L-1,计算以上反应在20℃时的K,并计算20℃时与 101 kPa大气平衡的水中氧的浓度c(O2),大气中p(O2)=21.0 kPa。
(2) 已知血红蛋白(Hb)氧化反应Hb(aq)+O2(g)=HbO2(aq)在20℃时K= 85.5,计算反应Hb(aq)+O2(aq)=HbO2(aq)的K(293 K)。
解:(1) O2(g)=O2(aq) ①
?c(O)/c?2 K(293K)? ?p(O2)/p
根据题意,O2在水中达到溶解平衡时,c(O2)=1.38×10-3 mol·L-1,p(O2)=101kPa
?3?1?11.38?10mol?L/1.0mol?L K(293K)?= 1.37×10-3 101kPa/100kPa
大气中p(O2)=21.0kPa 时: ????
c(O2)/c?
?1.37?10?3 21kPa/100kPa
c(O2,aq) = 2.88×10-4 mol·L-1 K?(293K)?
(2) Hb(aq)+O2(g)=HbO2(aq) ②
Hb(aq)+O2(aq)=HbO2(aq) ③
③=②-① 根据多重平衡规则:K?(293K)?85.5?6.24?104 ?31.37?10
5、在一密闭容器中进行如下反应:
2SO2(g) + O2(g) = 2SO3(g)
SO2的起始浓度是0.4mol·L-1,O2的起始浓度是1mol·L-1,当80%的SO2转化为SO3时,反应即达到平衡,求平衡时三种气体的浓度和平衡常数。
解: 2SO2(g) + O2(g) = 2SO3(g)
起始浓度/ mol·L-1 0.4 1 0
平衡浓度/ mol·L-1 0.08 0.84 0.32
K
6、55℃、100kPa时N2O4部分分解成NO2,系统平衡混合物的平均摩尔质量为61.2g·moL-1,求:(1)N2O4的解离度?和标准平衡常数K?(328K);(2)计算55℃系统总
-压力为10kPa时N2O4的离解度?。(已知M(NO2)=46g·mol1)。
解:(1)设平衡时系统中N2O4的摩尔分数为x,则NO2的摩尔分数为1-x
由题意得:92 x +(1-x)46 = 61.2
解得: x=0.33
21 ?0.322???19.04 ?2?2[c(SO2)/c]?[c(O2)/c]0.08?0.84[c(SO3)/c?]2
普通化学习题参考答案
故 p(N2O4)= 33kPa;p(NO2)= 67 kPa
N2O4(g) ==== 2NO2(g)
?22 K?(328K)?[p(NO2)/p]?(67kPa/100kPa)?1.36 33kPa/100kPap(N2O4)/p?
根据化学反应计量数,达到平衡时消耗N2O4为 ? =1×67kPa=34kPa, 234kPa?0.51 34kPa?33kPa
(2)设 55℃时,系统中 p(N2O4)= x kPa;则 p(NO2)=(10-x)kPa
?22 K?(328K)?[p(NO2)/p]?[(10?x)kPa/100kPa]?1.36 xkPa/100kPap(N2O4)/p?
x= 0.64 kPa
p(N2O4)= 0.64kPa, p(NO2)=9.36kPa
消耗N2O4为1×9.36kPa=4.68kPa 2
4.68kPa? = ?0.88 4.68kPa?0.64kPa
?7、已知反应CaCO3(s)= CaO(s)+ CO2(g)在973K时的标准平衡常数K(973K)=3.00
×10-2,在1173K时K(1173K)=1.00,问:
(1)上述反应是吸热反应还是放热反应?
(2)计算反应的ΔrHm? 。
??解:ΔrG?
m(T)= ΔrHm - TΔrSm = -RTln K
??-2根据题意:(1)ΔrG?
m(973K)= ΔrHm – 973K ΔrSm = -RTln(3.00×10)
??(2)ΔrG?
m(1173K)= ΔrHm – 1173KΔrSm = -RTln(1.00)
-1联立(1)、(2) 式,解得ΔrH?=166 kJ·mol m??
为吸热反应
8、一定温度下,在煤气发生炉中同时发生下列二个反应:
(1)2C(s) + O2(g)= 2CO(g) K(1)=1.6×1048
(2)C(s) + O2(g)= CO2(g) K(2)=1.4×1069 当两个反应均达到化学平衡时,炉内CO2的分压为2.0×10-3kPa,计算炉内CO的分压。
解: K?
(1)??[p(CO)/p?]2 ?p(O2)/p?
22
普通化学习题参考答案
? K??p(CO2)/p (2)p(O2)/p?
p(O2)同时满足两个平衡, K(?1)
K(?2)[p(CO)/p?]2?p(CO2)/p?
? p(CO)/p?K(?1)
K?
(2)?p(CO2)/p??1.5?10?13
p(CO)= 1.5×10-13×100kPa=1.5×10-11kPa
9、383 K时,反应Ag2CO3(s)=Ag2O(s)+CO2(g)的ΔrG?mol-1,求此反应的K(383 m =14.8 kJ·K);在383 K烘干Ag2CO3(s)时,为防止其受热分解,空气中p(CO2)最低应为多少kPa?
-1解:Ag2CO3(s) = Ag2O(s)+CO2(g) ΔrG?
m(383K)=14.8 kJ·mol
?△rGm77.7kJ?mol?1ln K(383K)= -????31.36= - 4.65 ?3?1?1RT8.314?10kJ?mol?K?298K?? K(383K)=9.65×10-3
K= p(CO2)/ p
为防止反应正向自发,应保证反应商Q > K
故:p(CO2) > 9.65×10-1kPa
10 、根据有关热力学数据,近似计算CCl4(l)在101.3 kPa压力下和20 kPa压力下的沸腾温度。已知ΔfH?g,298 K) = -102.93 kJ·mol-1,S?g,298 K) = 309.74 J·K1·mol-1,m(CCl4,m(CCl4,-????其他数据见书后附录。
解:查表得:
CCl4(l) CCl4(g)
-1 ΔfH? -135.4 -102.93 m / kJ·mol
S?K1·mol-1, 216.4 309.74 m / J·-
CCl4(l) = CCl4(g)
-1ΔrH?
m = 32.47 kJ·mol
-1 ΔrS? m =0.09334 kJ·mol
?所以,的正常沸点为 T1= ΔrH?
m /ΔrSm = 348 K
根据克拉贝龙-克劳休斯方程
23
普通化学习题参考答案
lnp2
p1??vapHmR?(T2?T1) T1T2
?1T2?348K2032.47kJ?mol ln?() ?3?1?11018.314?10kJ?mol?K348K?T2
T2=304K
11、用减压蒸馏的方法精制苯酚。已知苯酚的正常沸点为455.15K,如外压减至p=1.333×104Pa,苯酚的沸点为多少?已知苯酚在标准状态下的蒸发热为48.14kJ·mol-1
解: 苯酚(l)=== 苯酚(g) K= p(苯酚)/ p 正常沸点: p(苯酚)1= 1.013×105 Pa , T1= 455.15K
减压: p(苯酚)2 = 1.333×104 Pa , T2= ?
-1ΔrH?
m = 48.14 kJ·mol ??
由 lnp2
p1??vapHmR?(T2?T1)得: T1T2
T2?455.15K1.333?104Pa48.14kJ?mol?1
ln?() 1.013?105Pa8.314?10?3kJ?mol?1?K?1455.15K?T2
T2= 392 K
在减压条件下,苯酚在392K即可沸腾
24
普通化学习题参考答案
6 化学动力学习题答案
选择题:
1.D 2.D 3.B 4.D 5.C 6.D 7.B 8.A 填空题:
1. 1, 0.5
2. v=kCA , 0.5 , 0.25
3. 0.5 mol-1.L.S-1 , 0.05
4. 3 , v= k[NO]2[Cl2]
计算题:
1.
解:
2. 1dc(N2O5)1dc(NO2)dc(O2)(1) v??????2dt4dtdtdc(O2)1dc(Br2)1dc(HBr)(2) v???????4dtdt2dt
1.25?3.52??4?1?1解: (1) v??1??c(N2O5)??1?????7.57?10(mol?L?s)2?t2?2000?500?
(2) 作c ~ t图(图略),由图求得1500 s 时切线的斜率,取斜率的负值即为此时的瞬时速率。
3.
解: (1 ) 零级反应速率方程式为:v = k0 ,故 v = 0.014 (mol·L-1·s –1 ) ;
(2 ) 一级反应速率方程式为:v = k1c ,
∵ v1 = k1c1 , k1 = v1 / c1 = 0.014 / 0.50 = 0.028 (s –1 )
∴ v = k1c = 0.028 ×1.0 = 0.028 (mol·L-1·s –1 )
(3 ) 二级反应速率方程式为:v = k2 c 2 ,
∵ v1 = k2 c12 , k2 = v1 / c12 = 0.014 / 0.50 2 = 0.056 (L·mol -1·s –1 ) ∴ v = k2 c2 = 0.056 × 1.0 2 = 0.056 (mol·L-1·s –1 )
4.
解: (1 ) 设反应速率方程式为:v = k1 c x (NO) c y (O2)
则 :
25 v1?c1(NO)?????v2?c(NO)?2?x?c1(O2)???c(O)???22?y
普通化学习题参考答案
代入 c (NO) = 0.010的两组数据,可得 y = 1 ; 代入 c (O2) = 0.020的两组数据,可得 x = 2 ; 故反应速率方程式为 v = k c 2 (NO) c (O2) ,反应级数为 2 +1 = 3 。
(2) k = v / [c 2 (NO) c (O2) ] = 2.5 ×10 -3 / ( 0.010 2 × 0.010) = 2.5 × 10 3
(L2·mol -2·s-1)
(3 ) v = k c 2 (NO) c (O2) = 2.5 × 10 3 × 0.015 2 × 0.025 = 0.014 (mol·L-1·s-1) 5.
解: 依题意,该反应的速率方程式为:v = k1 c 2 (A) c (B) = a c 2 (A) c (B)
(1) v1 = a × 12 × 0.5 = 0.5 a (mol·L-1·s-1)
(2) v2 = a × [(1/3) × 2]2 × [ (1/3) × 1] = 0.15 a (mol·L-1·s-1) 6.
解:(1) 一级反应:ln c = - k1 t + ln c0
∵ ln 0.0300 = - k1 × 200 + ln c0
ln 0.0200 = - k1 × 400 + ln c0
∴ k1 = 2 .03 × 10-3 (min-1 )
(2)ln c0 = k1 t + ln c0 = 2 .03 × 10-3 ×200 + ln 0.0300
c0 = 0.045 ( mol · L-1)
7.
解:一级反应:k1 t = ln ( c0 / c )
1c15k1?ln0?ln?1.45?10?2 (月 -1 )tc124.2
半衰期:
t1/2?0.693?47.8 (月)k1
有效期:
8. t?1c011ln?ln?24.6 (月)k1c1.45?10?20.70
解法一(作图法):
(1) 以lg c~ t作图,由直线斜率可得k1 ,进而求得t1/2 ;
(2) 据图,由直线截距可求得c0 ,继而求得t 。 解法二(代数法):
26
普通化学习题参考答案
(1) 将各相邻两组数据代入公式k1?ln1
tc0 ,可得ki 分别等于c
0.0967、 0.0961和0.0963 ,取平均值 k1 = 9.64 ×10–2 ,
∴ t1/2 = 0.693 / k1 = 0.693 /(9.64 × 10-2 )= 7.2 ( h )
(2) 据 ln c0 = ln c + k1 t
分别代入 t = 4,8,12,16(h)时数据,
分别得到c0 = 7.06 , 7.05 , 7.06 , 7.06 ;取平均值 c0 = 7.06
( mg · L-1 )
又:
t?1c017.06ln?ln?6.7(h)k1c3.79.64?10?2
故第二针应在下午二点半左右注射。
9.
解: 已知:T1= 651 K , T2 = 723 K , t1/2 = 365 min , Ea = 219.2 kJ﹒mol-1 10.
解: (1) 设NaOH浓度为a(mol·L-1),α-溴代丙酸溶液体积为V(ml),
则α-溴代丙酸溶液的起始浓度: c0 = 10.00 a / V (mol·L-1)
由反应式可知: HBr所消耗NaOH体积 = t 分钟后所消耗NaOH体积 - 反应前(t=0) 所消耗NaOH体积
t1 = 100 min 时::
c ( HBr) = ( 10.25 – 10.00 )× a / V = 0.25 a / V (mol · L-1)
c (α-溴代丙酸 ) = ( 10.00 – 0.25 )× a / V = 9.75 a / V (mol · L-1)
c 据 ln0?k1t 有:k1'= c1c0110.00ln?ln?2.53?10?4(min?1) tc1009.75
110.00ln?2.56?10?4(min?1) 2009.50同理,由 t2 = 200 min 可得:k1"=
∴ k1 = ( k1'+ k1") / 2 = 2.54 ×10 - 4
(2) 半衰期 t1/2?0.6930.693??2728(min) ?4k12.54?10
c01?1596(min) (3) t?kln21c03
27
普通化学习题参考答案
11.
解:已知:T1 = 278 K , t1 = 48 h ,T2 = 301 K , t2 = 4 h ;
依题意:v ∝ 1 / t
设反应速率方程为:v = k·cn
则有: k 2
12.
解:已知: Ea = 50.0 kJ·mol-1 , T1 = 310 K , T2 = 313 K ,
∵ v ∝ k
∴
13.
解: 已知: Ea1 = 120 kJ·mol-1 ,Ea2 = 46 kJ·mol-1 ,T = 298 K
(1)设反应速率方程为:v = k·cn , 则 v2 / v1 = k2 / k1 据
有
28 k1?v2/cnv1/cn?v2t1?v1t2?Ea???2.303RT1T2k2lg(T2?T1)k12.303RT1T2tlg1(T2?T1)t22.303?8.314?278?30148lg?75.2(kJ?mol?1)(301?278)4lnE(T?T)v2k?ln2?a?21v1k1RT1T250.0?103?(313?310)??0.18592.303?8.31?310?313v2?1.20 (倍) v1lnk??Ea?lnARTlnk2??lnk1??Ea2RT2Ea1RT1?lgA?lgA 依题意: T2?T1 ? 298 K : k2Ea1?Ea2ln?k1RT120?103?46?103??29.8688.314?298k2·/k1?9.4?1012
?v2/v1?9.4?1012
普通化学习题参考答案
(2 )
?ln
8.31412 .07?10?3?lg9.4?10?2120?103 ?T2?777.3(K) k2Ea?T2?T1?????k1R?T1T2??T2?298Rk?ln2298?T2Eak1
29
普通化学习题参考答案
7 酸碱与酸碱平衡
9.计算298K下,c(H3BO3)=0.050 mol·L-1的H3BO3溶液的pH值及H3BO3的离解度。
解: H3BO3是一元酸 c/c?
??= 0.05/5.8 ?10-10 >500 Ka
根据式(7—7b)
c(H+)=
mol·L-1
pH =5.27
c(H?)5.4?10?6mol?L?
= ?100=0.011% ? =c0.050mol?L??Ka?c/c?·c?=1.0 mol·L-1=5.4?10-6 5.8?10?10?0.050×
10.已知某氨水溶液的pH值为11.30,求该氨溶液的浓度。 解: pOH=2.70
c(OH-)/ c?=2.0×10-3
(c(OH?)/c?)2
c(NH3)=×c?=0.22 mol·L-1 ?Kb
11.计算在室温下饱和CO2水溶液[即c(H2CO3)=0.040 mol·L-1]中c(H+)、?2?c(HCO3)及c(CO3)。
?解: ? K?
a1>> Ka2
c/c?-7= 0.040/4.2 10 >500 ??Ka1
??-1??7?c/cc(H+)=Ka·c=×1.0 mol·L 4.2?10?0.0401
=1.3?10-4 mol·L-1
? c(HCO3)=1.3?10-4 mol·L-1
-11-1?2? c(CO3)= K?·c=5.6×10 mol·L a2
30
普通化学习题参考答案
12.奴弗卡因是一种一元弱碱,测得c=0.020 mol·L-1奴弗卡因水溶液的
?pH=10.57,计算奴弗卡因的离解常数Kb。
解: pOH=3.43
c(OH-)/ c?=3.7×10-4
(c(OH?)/c?)2
K==6.8×10-6
?c/c?
b13.计算说明c(NaAc)=0.10 mol·L-1的NaAc水溶液与c(Na2CO3)=0.10mol·L-1的Na2CO3水溶液的碱性强弱。
解: NaAc水溶液
c/c?
??= 0.10/5.7 ?10-10 >500 Kb
c(OH-)/ c?=Kb??c/c?=5.7?10?10?0.10=7.5?10-6
pOH =5.12
pH=8.88
Na2CO3水溶液 c/c?
??= 0.10/1.8 ?10-4 >500 Kb1
?c(OH-)/ c?=Kb?=.8?10?4?0.10=4.2?10-3 1?c/c
pH =14-pOH =11.62
14.某一酸雨样品的pH=4.07,假设该样品的成分为HNO2,计算HNO2的浓度。
解: c(H+)/ c?=8.5×10-5
(8.5?10?5)2(c(H?)/c?)2-1? c(HNO2)=×c=×1.0 mol·L ?4?5.1?10Ka
=1.4×10-5mol·L-1
解: c(H+)/ c?=8.5×10-5
31
普通化学习题参考答案
(8.5?10?5)2(c(H?)/c?)2
-5 +-1? c(HNO2)=×c+c(H)=×1.0 mol·L+8.5×10?4.6?10?4Ka
=1.0×10-4mol·L-1
15.求c(KHC2O4)=0.050 mol·L-1的KHC2O4溶液的pH值,如果加入等体积的c(K2C2O4)=0.10 mol·L-1的K2C2O4溶液后,则溶液的pH值又为多少? 解:
-5??(1) K?
a2·c/ c=6.4×10×0.050>20 Kw
而c/ c?<20K?
a1
∴c(H)/ c = +????Ka5.9?10?2?6.4?10?5?0.0501Ka2?c/c= ???2Ka?c/c5.9?10?0.0501
=1.3×10-3
pH=2.89
?c(HC2O4)0.025 (2) pH=pK-lg=4.19-lg=4.49 2?0.050c(C2O4)?
a2
16.将浓度为0.020 mol·L-1苯胺(C6H5NH2)和浓度为0.020 mol·L-1硝酸水溶液等
?体积混合,计算所得溶液的pH值。 [Kb(C6H5NH2)=4.6×10-10]
解:等体积混合后
c(C6H5NH2)=0.010 mol·L-1
c(HNO3)=0.010 mol·L-1
??C6H5NH2 + HNO3 ==== C6H5NH3 + NO3
反应完成之后
?c(C6H5NH3)=0.010 mol·L-1
?Kw1.0?10?14
K= ?==2.2×10-5 ?10Kb4.6?10?a??c/c?=2.2?10?5?0.010=4.7×10-4 c(H+)/c?=Ka
pH=3.33
32
普通化学习题参考答案
17.40ml c(Na2HPO4)=0.10 mol·L-1Na2HPO4水溶液与20ml c(H3PO4)=0.10 mol·L-1H3PO4水溶液混合,混合液的pH是多少?
解:反应完成后,各组分物质的量为
?? HPO2
4 + H3PO4 ====== 2H2PO4
n/mmol 40×0.10-20×0.10=2 2×20×0.10=4
?n(H2PO4)4pH=pK-lg=7.20-lg=6.90 2?2n(HPO4)?
a2
18.某混合溶液中含有c(HCl)=0.10 mol·L-1的HCl和c(HAc)=0.10 mol·L-1的HAc水溶液,计算混合液的pH及Ac-的浓度。
解: c(H+)/ c?=c(HCl)/ c?=0.10
pH=1.00
HAc + H2O = H3O+ + Ac-
起始浓度/ mol·L-1 c(HAc) c(HCl) 0
平衡浓度/mol·L-1 c(HAc)-c(Ac) c(HCl)+c(Ac) c(Ac)
≈c(HAc) ≈c(HCl) ---
[c(HCl)/c?][c(Ac?)/c?] K= ?c(HAc)/c?
a?Ka?c(HAc)/c?1.8?10?5?0.10-1??5c(Ac)= mol·L ?c??1.8?100.10c(HCl)/c?-
19. 欲配制pH=5.00 c(HAc)=0.10mol·L-1的缓冲溶液500ml,需要2.0 mol·L-1HAc多少毫升?固体NaAc多少克?
解:根据题意
?c(HAc)/c pH=pK—lg ??c(Ac)/c?
a
5.00=4.74-lg0.10 ??c(Ac)/c
c(Ac-)/ c?=0.18
c(Ac-)=0.18 mol·L-1
33
普通化学习题参考答案
m(NaAc)=c(Ac-)·V·M(NaAc)
=0.18 mol·L-1×0.50L×82g·mol-1=7.4g 0.10mol?L?1?500mL?25mL V(HAc)=?12.0mol?L
20.计算298K时,c(Na2S)=0.10 mol·L-1的Na2S水溶液的pH值及c(HS-)和c(H2S)。
解: S2- + H2O ==== OH- + HS-
?KwK = ?=1.4 Ka2?b1
?Kw K== ?=7.7×10-8 Ka1?b2
??Kb1>> Kb2
c/c?
??=0.10/1.4<500 Kb1
∴c(OH)/c = -???2??Kb?(Kb)?4Kb?c/c?
2
?1.4?.42?4?0.10?1.4 =0.10 2
c(OH-)=0.10 mol·L-
c(HS-)=0.10 mol·L-
-8-??c(H2S)= Kb2· c=7.7×10 mol·L
21.20mL c(HCl)=0.20mol·L-1的HCl溶液与20mL c(NaAc)=0.50mol·L-1的NaAc溶液混合,计算
(1)溶液的pH值;
(2)在混合溶液中加入lmL c(NaOH)=0.50mo1·L-1的NaOH,溶液的pH值变为多少;
(3)在混合溶液中加入lmL c(HCl)=0.50m01·L-1的HCl,溶液的pH值变为多少。 解:反应完成之后,各剩余组分物质的量为
H+ + Ac- ==== HAc
34
普通化学习题参考答案
n/mmol 20×0.20=4 20×0.50-4=6 4
n(HAc)=4.74-lg4 = 4.92 (1) pH= pK?—lga6n(Ac?)
(2) 加入的NaOH与HAc反应后
OH- + HAc ===== Ac- + H2O
n/mmol 1×0.50 4-0.50 6+0.50 pH= pK?n(HAc)
a—lgn(Ac?)=4.74-lg3.5
6.5 =5.01
(3) 加入的HCl与NaAc反应后
H+ + Ac- ====
n/mmol 1×0.50 6-0.50 4+0.50 pH= pK?n(HAc)
a—lgn(Ac?)=4.74-lg4.5
5.5 = 4.83
35 HAc
普通化学习题参考答案
8 沉淀溶解平衡
1、 写出下列难溶电解质:PbCl2、AgBr、Ba3(PO4)2、Ag2S、的溶度积常数表示式。
解:PbCl2: Ksp? =C(Pb2+)(C(Cl-))2/(C?)3
AgBr: Ksp?=C(Ag+)C(Br-) /(C?)2
Ba3(PO4)2: Ksp?= (C(Ba2+))3(C(PO43-))2 /(C?)5 Ag2S: Ksp?= (C(Ag+))2C(S2-) /(C?)3
2、试计算下列化合物的溶解度(以mol·L-1表示)。
(1)碘化亚铜(I) Ksp? [CuI]= 1.1×10-12
(2)氟化镁 Ksp? [MgF2]= 6.3×10-9
(3)草酸银 Ksp? [Ag2C2O4]= 5.0×10-12
解释(1)和(3)的Ksp?相近而溶解度不同。
解:(1)CuI. S=( Ksp? [CuI])1/2=1.0×10-6(mol·L-1)
(2)MgF2 S=( Ksp? [MgF2]/4)1/3=1.2×10-3(mol·L-1)
(3)Ag2C2O4 S=( Ksp? [Ag2C2O4] /4)1/3=1.1×10-4(mol·L-1) 因为(1)和(3)是不同类型难溶电解质,所以溶解度不同。
3、做两个实验,一是用100毫升蒸馏水洗BaSO4沉淀,二是用100毫升0.010 mol·L-1H2SO4溶液洗BaSO4沉淀。如果洗液对BaSO4是饱和的。计算在每一个实验中,BaSO4溶解的物质的量。根据计算结果,用水还是用稀硫酸作洗液比较合适?Ksp? [BaSO4]= 1.1×10-10 解:(1)在纯水中BaSO4的溶解度S=(1.1×10-10)1/2=1.0×10-5(mol·L-1)
100ml纯水溶解1.0×10-5×0.1=1.0×10-6mol
(2)在0.010 mol·L-1H2SO4溶液中S=1.1×10-10/0.010=1.1×10-8(mol·L-1) 100ml此溶液溶解1.1×10-8×0.1=1.1×10-9mol
根据计算结果,用稀硫酸作洗液比较合适。
4、10ml 0.1 mol·L-1MgCl2和10ml 0.01 mol·L-1氨水相混合时,是否有Mg(OH)2沉淀?
解:等体积混合后C(Mg2+)=0.05 mol·L-1 C(NH3H2O)=0.005 mol·L-1 C(OH-)= (CKb?)1/2=(0.005×1.8×10-5)1/2=3×10-4(mol·L-1)
36
普通化学习题参考答案
Q=(3×10-4)2×0.05= 4.5×10-9> Ksp? [Mg(OH)2]=1.8×10-11
所以有Mg(OH)2沉淀生成。
5、已知CaF2的溶度积为4.0×10-11,求CaF2在下列情况时的溶解度(以mol·L-1表示)。
(1)在纯水中;
(2)在1.0×10-2mol·L-1NaF溶液中;
(3)在1.0×10-2mol·L-1CaCl2溶液中。
解:(1)在纯水中,设其溶解度(S)为x mol·L-1
x=(Ksp?/4)1/3=(4.0×10-11/4)1/3=2.2×10-4(mol·L-1)
S=2.2×10-4mol·L-1
在纯水中,其溶解度为2.2×10-4mol·L-1
(2)在1.0×10-2 mol·L-1NaF溶液中,设溶解度(S)为y mol·L-1
CCa2+=y CF-=2y+1.0×10-2=1.0×10-2( mol·L-1)(同离子效应)
y×(1.0×10-2)2=4.0×10-11
y=4.0×10-7(mol·L-1)
在1.0×10-2mol·L-1NaF溶液中的溶解度为4.0×10-7mol·L-1
(1) 在1.0×10-2mol·L-1CaCl2溶液中,设溶解度(S)为z mol·L-1
CCa2+=1.0×10-2+z=1.0×10-2(mol·L-1)(同离子效应)
CF-=2z
1.0×10-2 × (2z)2=4.0×10-11
z=3.2×10-5mol·L-1
在1.0×10-2mol·L-1CaCl2溶液中,溶解度为3.2×10-5mol·L-1。
6、某溶液中含有0.10 mol·L-1Ba2+和0.10 mol·L-1Ag+ ,在滴加Na2SO4溶液时(忽略体积的变化),哪种离子首先沉淀出来?当第二种离子沉淀析出时,第一种被沉淀离子是否沉淀完全?两种离子有无可能用沉淀法分离?
解:根据溶度积规则,要BaSO4沉淀 C(SO42-) >1.1×10-10 /0.10=1.1×10-9(mol·L-1) 要Ag2SO4沉淀 C(SO42-) > 6.3×10-5/(0.10)2=6.3×10-3(mol·L-1)
所以BaSO4先沉淀。
37
普通化学习题参考答案
当Ag2SO4沉淀时,C(Ba2+)=1.1×10-10 / 6.3×10-3 = 1.7×10-8(mol·L-1) < 10-5(mol·L-1) 此时Ba2+已沉淀完全。可用此法分离这两种离子。
7、现有一瓶含有Fe3+杂质的0.10 mol·L-1MgCl2溶液,欲使Fe3+以Fe(OH)3沉淀形式除去,溶液的pH应控制在什么范围?
解:设Fe3+沉淀完全时CFe3+=1.0×10-5mol·L-1
则C(OH-)=(4×10-38 /1.0×10-5)1/3=3.4×10-12(mol·L-1) pH=14.00-11.47=2.53
若使0.10mol·L-1MgCl2溶液不生成Mg(OH)2沉淀,
则C(OH-)=(1.8×10-11 /0.10)1/2=1.3×10-5mol·L-1
pH=14.00-4.87=9.13
溶液pH值应控制在2.53<pH<9.13
8、试计算下列沉淀转化反应的K?值:
(1)PbCrO4 (s) + S2- ====PbS (s) + CrO42-
(2) Ag2CrO4 (s) + 2Cl- ====2AgCl (s) + CrO42-
解:(1)K?= Ksp?(PbCrO4)/ Ksp?(PbS) = 2.8×10-13 /1×10-28=2.8×1015
(2)K?= Ksp?(Ag2CrO4)/ (Ksp?(AgCl) )2=2.0×10-12 /(1.8×10-10)2=6.2×107
9、将H2S气体通入0.10 mol·L-1ZnCl2溶液中达到饱和状态。H+离子浓度必须控制在什么数值才能阻止ZnS沉淀。Ksp? [ZnS]= 2.2×10-22
解:通入H2S气,C(Zn2+)=0.10 mol·L-1 ,若阻止沉淀生成 C(S2- )<2.2×10-22/0.10=2.2×10-23(mol·L-1)
H2S = 2H+ + S2-
[(C(H+))2C(S2- )] / [ C(H2S)(C?)2] = Ka1? Ka2? =1.3×10-7×7.1×10-15=9.2×10-22 C(H+ )>( Ka1? Ka2? C(H2S)(C?)2 / C(S2-))1/2 =(9.2×10-22×0.1×12/2.2×10-23) 1/2=2.0(mol·L-1) 所以C(H+)必须控制在2.0mol·L-1以上才能阻止ZnS沉淀生成。
38
普通化学习题参考答案
9配位化合物与配位平衡
1解答
(1)六氯合铂(Ⅳ)酸钾
(2)六氰合铁(Ⅱ)酸钾
(3)三氯化六氨合钴(Ⅲ)
(4)氯化二氯·四水合铬(Ⅲ)
(5)三硝酸根·三氨合钴(Ⅲ)
(6)二溴·氯·二氨·水合钴(Ⅲ)
(7)五羰基合铁
(8)二乙二胺合铜(Ⅱ)。
2解答:
(1)错。有些配合物无外界,如[CrCl2(NH3)4]。
(2)错。中性金属原子或某些高氧化数的非金属离子也可作为配合物的形成体。如Ni(CO)4,[SiF6]2-。
(3)错。含多齿配体的螯合物中,配位体的数目不等于形成体的配位数,如
[Ca(EDTA)]2-。
(4)错。配离子的电荷数是形成体的电荷数与所有配体电荷数的代数和,如[FeF6]3-。
(5)正确。
(6)正确。
(7)错。配离子的Kd?越大,该配离子的解离越容易,稳定性越小。
(8)错。对于不同类型的配离子,不能单从Kf?大小来判断配离子的稳定性。
(9)错。每种金属离子都有一个最高配位数。当中心离子已经达到最高配位数后,即便是增加配位剂的浓度,配位数也不会增加。
(10)错。螯合物的稳定性比具有相同配位原子的简单配合物要高,是因为其中所含的 多齿配体中有多个配位原子与中心离子结合。
(11)错。[Co(CN)6]4-是内轨型配合物,但极不稳定。相反,外轨型的[Co(NH3)6]2+比较稳定。
3 完成下表

39
普通化学习题参考答案
4 解答:(3),(5)。
5 解答:(1),(2),(3)
6 解答:(2),(3)。
7 解答:
(1)外轨型sp3d2,顺磁性。(2)内轨型d2sp3,顺磁性。
(3)外轨型sp3d2,顺磁性。(4)内轨型d2sp3,反磁性。
(5)外轨型sp3d2,顺磁性。
8 解答:
(1)直线型。 (2)正八面体型。
(3)平面正方形。 (3)正四面体。
(5)正八面体。
9 解答:
(1)配位个体中与中心原子或离子结合的分子或离子叫配位体,简称配体;配体中直
接键合于中心原子的原子叫配位原子,即上述的给予体原子。
(2)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨
道杂化而成的杂化轨道上,形成的配位化合物即为外轨型配合物。反之,填在由内层轨道参与的杂化轨道上,即为内轨型配合物。
(3)仅从形成配合物后中心离子的电子结构来考虑,中心离子仍保持原有的电子构型,未成对的单电子数不变,总的自旋平行单电子数较多,称该配合物为高自旋配合物;中心离子的电子构型发生改变,未成对的单电子数减少,其中总的自旋平行电子数较少,称该配合物为低自旋配合物。
(4)几何异构体,指化学式相同,内、外界相同,但配合物中配位键的排列顺序不同的一些配合物。旋光异构体指化学式相同,内、外界相同,但彼此之间互成镜象关系,类似于一个人的左手和右手。
10解答:
(1)氨水中NH3作为配体,AgCl+2NH3 =[Ag(NH3)2]++Cl-。
(2)实质上是H+与配体NH3反应生成了弱酸NH4+,从而使配位平衡向解离方向移动。
[Cu(NH3)4]2+(深蓝色)+4H2O +4H+=[Cu(H2O)4]2+(浅蓝色)+4NH4+。
(3)Fe3+将I-氧化为I2: 2Fe3++ I2=2Fe2++2I-;
再加入KCN后紫色CCl4层褪色: 2[Fe(CN)6]4-+2I-=2[Fe(CN)6]3-+ I2。
(4)通常Kf?([MY])> Kf?([CaY])
故,CaY+M=MY+Ca(方程式中省去了离子的电荷)。
(5)因为Co3+的配离子[Co(NH3)6]3+的Kf?比较大,导致[Co(NH3)6]3+的氧化能力比Co3+弱,但[Co(NH3)6]2+还原能力比Co2+强,使得空气中的氧可将[Co(NH3)6]2+氧化为[Co(NH3)6]3+。
(6)由于[Ag(S2O3)2]3-(Kf?=2.9×1013)非常稳定,用沉淀能力很强的沉淀剂才能将Ag置换出来。
2[Ag(S2O3)2]3-+ S2-=Ag2S+4S2O32-。
40

普通化学习题参考答案
12 解答:
根据题意可得:
Cu2+ + 4NH3 = [Cu(NH3)4]2+
平衡时/mol·L-1 x 1+4x≈1 0.1-x≈0.1
由于Kf?很大,[Cu(NH3)4]2+解离极小,x极小,故1+4x≈1,0.1-x≈0.1 K?
?fcCu/cc?NH2??c?Cu?NH3?4??2??/c??4?/c3?2.1?1013 0.1?2.1?1013x = 4.8×10-15mol·L-1 x
答:Cu2+的浓度为4.8×10-15mol·L-1。
13 解答:
根据题意可得:
(1),?Ag?CN?2??Ag??2CN?,K1??1/K?f ??(2),CN??H??HCN,K??1/K2a (1)+(2)×2得 ?Ag?CN?2???2H??Ag??2HCN K? 平衡常数比较小,反应不是很彻底。因此,在强酸性条件下,[Ag(CN)2] –才能被破坏。 14 解答:
欲使AgI完全溶解,则其中Ag+基本完全转化为[Ag(NH3)2]+,c([Ag(NH3)2]+)=c(I-)=0.10 mol·L-1。
设开始时c(NH3)=x mol·L-1
(1) AgI + 2 NH3 = [Ag(NH3)2]+ + I-
开始时/mol·L-1 0.10 x 0 0
平衡时/mol·L-1 x-0.2 0.10 0.10
K??c?Ag?NH??/c??c?I?/c??K?c?NH?32???
?2?/c3
2
2?f??Ksp 0.10x?0.2?1.1?1078.9?10?17?9.79?10?10????
x = 3.2×103mol·L-1计算得到:最少需要1.0mL氨水的浓度是3.2×103mol·L-1, 氨水的浓度不可能达到这一浓度,故AgI不溶于氨水。
(2)对于反应:AgI+2CN- =[Ag(CN)2]-+I- 同理可得:
41
普通化学习题参考答案
K
?c?Ag?CN??/c?c?I???2??2
21?0.102
x?0.22cCN/c ??1.3?10??8.9?10??11.57?10?174?/c??K??f??Ksp
x ≈0.2mol·L-1
答:最少需要1.0mLKCN的浓度大约0.2mol·L-1。
15解答:
(1) A [Ag(CN)2]-= Ag++2CN- K1=1/K?([Ag(CN)2]-)=1/(1.3×1021)
B 2Ag++ S2-= Ag2S K2=1/Ksp? (Ag2S)=1/(2×10-49) A×2+B得到:2[Ag(CN)2]-+S2-=Ag2S+4CN- K
故,K=(K1)2 K 2={1/Kf?([Ag(CN)2]-)}2{1/Ksp?(Ag2S)}
=1/(1.3×1021)2/(2×10-49)=2.96×106
(2) A AgCl=Ag++Cl- K1=Ksp?(AgCl )=1.8×10-10
B Ag++2S2O32-=[Ag(S2O3)2]3- K2=Kf?([Ag(S2O3)2]3-)=2.9×1013 A+B得到: AgCl+2S2O32-=[Ag(S2O3)2]3-+Cl- K
故,K=K1K2= Ksp?(AgCl )Kf?([Ag(S2O3)2]3-)
=(1.8×10-10)(2.9×1013)= 5.2×103
(3) A [FeF6]3-= Fe3++6F- K1=1/Kf?([FeF6]3-)=1/(2.04×1014)
B Fe3++6CN-=[Fe(CN)6]3- K2=Kf?([Fe(CN)6]3-)=1.0×1042 A+B得到: [FeF6]3-+6CN-=[Fe(CN)6]3-+ 6F- K
故,K=K1K2=Kf?([Fe(CN)6]3-)/Kf?([FeF6]3-)
=(1.0×1042)/(2.04×1014)= 4.9×1027
(4) A [Cu(NH3)4]2+=Cu2++4NH3 K1=1/Kf?([Cu(NH3)4]2+)=1/(2.1×1013)
B NH3+H2O=NH4++ OH- K2=Kb?(NH3)=1.8×10-5
C H++OH-= H2O K3=1/Kw?
A+4B+4C得到:[Cu(NH3)4]2++4H+=Cu2++4NH4+ K
16 解答:
设平衡时c([Ag(NH3)2]+)=xmol·L-1
[Ag(NH3)2]+ + 2S2O32- = [Ag(S2O3)2]3- + 2NH3 开始时/mol·L-1 0.10 1.0 0 1.0
平衡时/mol·L-1 x 1.0-2(0.10-x)=0.80+2x 0.10-x 1.0+2(0.10-x)=1.2-2x ≈0.80 ≈0.10 ≈1.2 由于K?一般很大,Ag+几乎全部反应,x极小,
故0.80+2x≈0.80,0.10-x≈0.10,1.2-2x≈1.2
K?????2.9?10??KAg?NH?1.1?10K?fAg?S2O3?2
?
f3??32137?2.6?106
42
普通化学习题参考答案 0.10?1.22
6?2.6?10 20.80x
x = 8.7×10-8mol·L-1 答:c([Ag(NH3)2]+)= 8.7×10-8mol·L-1,c(NH3)=1.2mol·L-1。
43
普通化学习题参考答案
10 原电池和氧化还原反应
选择题:
1.D 2.A 3.D 4.D 5.B 6.B
填空题:
1. -2, -1, +3, +4
2. 阴, 阳, 氧化, 金属镀层离子
3. +2, +2.5
4.KMnO4 , H2O2 , 10
5. Cu极, Zn极, 变深, 减小, 增大
6.阳(或正), 氧化, 阴(或负), 还原
问答题:
1.
解:(1)Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
(2)2Mn2+ + 5BiO3- + 14H+ = 2MnO4- + 5Bi3+ + 7H2O
(3)5H2O2 + 2MnO4- + 6H+ = 5O2 + 2Mn2+ + 8H2O 2.
解:氧化剂由强到弱:H2O2> Cr2O72-> Hg2+
还原剂由强到弱:Zn > Sn > H2O2> Br-
3.
解: (1)MnO4-是最强的氧化剂,MnO42-是最强的还原剂。
(2)Cr2O72-是最强的氧化剂,Cr是最强的还原剂。 4.
解: (1)(-)Fe | Fe2+ (1 mol·L1) || Cu2+ (1mol·L1) | Cu(+) --
E = ? (+) -? (-)
0.0592[Cu2?]= ?(Cu/Cu) - ?(Fe/Fe) + lg 2[Fe2?]#2+#2+(2)(-)Ni | Ni2+ (1mol·L-1) || Cu2+ (1mol·L-1) | Cu(+)
E = ? (+) -? (-)
44
普通化学习题参考答案
0.0592[Cu2?]= ?(Cu/Cu) - ?(Ni/Ni) + lg 2?2[Ni]#2+#2+5.
解:(1)Pt | Fe2+(1mol·L-1) , Fe3+(0.0001mol·L-1) || I-(0.0001 mol·L-1),I2(s) | Pt
设右边为正极,左边为负极
E = ? (+) -? (-)
1[Fe3?]#3+2+ = φ(I2/I) + 0.0592lg?-?(Fe/Fe)-0.0592 lg 2?[I][Fe]#- = 0.535-0.771+0.0592lg
=0.238V > 0 1 0.0001?0.0001
∴假设正确,电池反应式为 I2 + 2Fe2+ = 2I- + 2Fe3+
(2) Pt | Fe3+(0.5 mol·L-1),Fe2+(0.05 mol·L-1) || Mn2+(0.01 mol·L-1),H+(0.1
mol·L-1),MnO2(固)| Pt
设右边为正极,左边为负极
E = ? (+) -? (-)
10.0592[Fe3?]#3+2+=φ(MnO2/Mn)+lg-?(Fe/Fe)-0.0592 lg 2?2[Mn2?][Fe]#2+=0.3406V > 0
∴假设正确,电池反应式为 MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O 6.
解: (1)(-)Cu | Cu 2+ (0.5 mol·L-1) || Ag + (0.5 mol·L-1) | Ag(+)
(2) 正极反应 Ag+ + e-
负极反应 Cu 2+ +2e-Ag Cu
①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+
(3)E =?? (Ag +/Ag) -? (Cu 2+ /Cu)
=??#(Ag +/Ag)+0.0592lg[Ag +]-?#(Cu 2+ /Cu)-
=0.7996+0.0592lg0.5-0.3402-
=0.4505(V)
45 0.0592lg[Cu 2+] 20.0592lg0.5 2
普通化学习题参考答案
7.
解:??#(I2/I-) = 0.535V,?#(Br2/Br-) = 1.08V 在酸性条件下:MnO4- + 8H+ + 5e → Mn2+ + 4H2O
[MnO4-]=[ Mn2+]=1 mol·L-1
0.0592lg[H+]8 5? (MnO4-/Mn2+)=??#(MnO4-/Mn2+)+
pH=3时
? (MnO4-/Mn2+)=1.51+0.0592lg(10-3)8 5
=1.226(V)
既大于?#(I2/I-),也大于?#(Br2/Br-),所以既能够氧化I-,也能够氧化Br-。 PH=6时? (MnO4-/Mn2+)=0.942V
此时,? (MnO4-/Mn2+)>??#(I2/I-),
但? (MnO4-/Mn2+)<??#(Br2/Br-)
∴KMnO4能氧化I-,却不能氧化Br-。 8.
解:只能选择Fe2(SO4)3。
9.
解:(1)E# =φ# (I2/I-) -φ#(Fe3+/Fe2+) = 0.535-0.771 = -0.236V < 0 反应逆向进行:2Fe3+ + 2I- == 2Fe 2++I2
(2)E# =φ# (Cl2/Cl-) -φ#(Sn4+/Sn2+) = 1.358-0.154 = 1.204V > 0 反应正向进行:Cl2 + Sn2+ == Sn4+ + 2Cl-
(3)E# =φ# (Fe3+/Fe2+) -φ#(MnO2/Mn2+) = -0.437V < 0 反应逆向进行: MnO2 + 4H+ + 2Fe2+ == 2Fe3+ + Mn2+ + 2H2O
(4)E# =φ# (Hg2+/ Hg22+) -φ#( Hg22+ /Hg) = 0.106V > 0 反应正向进行:Hg2+ + Hg == Hg22+
计算题:
1.
46
普通化学习题参考答案
nE#n(?#(?)??#(?))解:lgK = = 0.05920.0592
=2?(0.535?0.559)= -0.81 0.0592
∴K = 0.15
由于E#<0
∴此时反应逆向进行
当pH=7时,[H+]=10-7,其它浓度均为1 mol·L-1
E =?? (+) -? (-)
=??#(I2/I-) -?#(H3AsO4/ H3AsO3) -
=0.535-0.559-
=0.39V>0
∴反应正向进行。
2.
解:E# =??#(+)-?#(-) = -0.44-0.771 = -1.211V < 0 △rGm#=-nFE# =-2×96485× (-1.211) = 233.69(kJ) > 0 ∴反应不能自发进行。
3.
解:(1)(-)Ag | Ag+(0.1mol·L-1) || Cu2+(0.01mol·L-1) | Cu(+) E = ? (+)-? (-)
0.0592[Cu2?] =0.34-0.7996+lg ?22[Ag]0.0592lg(10-7)2 20.0592lg[H+]2 2
=-0.46+0.05920.01lg2 20.1
=-0.46(V) < 0
故反应逆向自发进行。
(2)(-)Pt | Br2(l),Br-(0.1mol·L-1) || Cr3+(0.01mol·L-1),Cr2+(1mol·L-1) | Pt(+) E = ? (+)-? (-)
0.0592[Cr3?]2[Br?]2
=-0.41-1.087+lg ?22[Ag]
47
普通化学习题参考答案
=-1.68(V) < 0
故反应逆向自发进行。
4.
解: (1)E =?? (+)-? (-)
0.0592[Pb2?] =??(Pb/Pb)-?(Sn/Sn)+lg 2[Sn2?]#2+#2+
=-0.126-(-0.136) +
=0.010V > 0
故反应正向进行。 0.05920.100lg 20.100
2?0.010n[?#(?)??#(?)] (2)lgK = = = 0.34 0.05920.0592
∴K = 2.18
5.
解: (1)?#(IO3-,H+/I2) >??#(Br2/Br-)
故电池反应为:2IO3- + 10Br- + 12H+ == I2 + 5Br2 + 6H2O
(2)E =??(IO3,H+/I2) -?(Br2/Br) + (0.0592/10)lg[Br]10 #-#-- =1.20 -1.065 + 0.0592lg0.0001
=-0.101(V) < 0
故反应逆向进行。
(3)E =??#(IO3-,H+/I2) -?#(Br2/Br-) + (0.0592/10)lg[H+]12 =1.20 -1.065 + (0.0592×12/10)lg10-4
=-0.15(V) < 0
故反应逆向进行。
6.
解: (1)?#(MnO4-/Mn2+) = (0.564 +2×2.26 + 0.95 + 1.51)/5 = 1.51(V)
3- (2)MnO2-4 MnO2 Mn
3+E# =??#(右)-?#(左) < 0,MnO2不能歧化成MnO2-4和Mn 1.23
MnO4- MnO2 Mn 2+
48
普通化学习题参考答案
E# =??#(右)-?#(左) < 0,MnO2不能歧化成MnO4-和Mn2+ ∴MnO2不能发生歧化反应
3+ (3)同理,MnO2-4 和Mn能发生歧化反应。
7.
解: Cu2+ + H2 == Cu + 2H+
0.0592[H?]2E = E - lg2? [Cu]p2H2#
0.48 =??#(Cu2+/Cu) -?#(H+/H2) - =0.34 -
-lg[H+]2 = 2.36
∴pH = 2.0 0.0592lg[H+]2 20.0592lg[H+]2 2
8.
?解:(1)??(左)<??(右),所以ClO3的歧化反应能自发进行。
?(2)?G298??nFE???6?96485?(1.45?1.23)??127.36(kJ)
lgKc?nE?
0.0592?6?(1.45?1.23)?22.3 0.0592
∴Kc=1.995×1022
9.
解:能。
2?NO??2H??NO??Fe3??H2O 2?Fe
2??2NO?O3?2H??2NO??SO2
2?S4?H2O
??NO?
2?2I?4H?NO??I2?H2O 49
普通化学习题参考答案
???2?5NO??3H2O 2?2MnO4?6H?5NO3?2Mn
2??3??3NO??CrO?8H?2Cr?3NO2273?4H2O
10.
3+ 2+# [Co(NH3)6]3)6] φ = 0.1v 解: 查表得
3+2+
Co φ#
= 1.84v
Cl2- φ# = 1.36v
由上面列出的半反应的φ#值可以看出,[Co(NH3)6]3+不能氧化Cl-, Co3+能将Cl- 氧化为Cl2故前者共存于同一溶液中,后者不能。
11.
解:先将有关电极电势列出
Cu2+ φ# = 0.34v ①
Fe2+ φ# = -0.4025v ②
Fe3+ 2+ φ# = 0.77v ③
当Fe使Cu2+还原时,发生下列反应, Fe + Cu2+=Cu+ Fe2+ ,从上述有关
电极电势可以看出,Fe是较强的还原剂,Cu2+是较强的氧化剂,因此反应可正向进行。同样,Cu使Fe3+还原,其反应式为2Fe3++Cu=2Fe2+ + Cu2+,反应正向进行时为Fe3+较强的氧化剂,Cu为较强的还原剂,从上面的有关电极电势也可证明这一点。
由于②式电势小于①式,故处于还原态的Fe和Cu相比,Fe的还原性较Cu强,即Fe比Cu活泼。
12.
解:在碱性介质中,被Zn氧化为,Zn2+与过量的OH-又生成,从而使Zn2+浓度
下降,于是的电极电势变得比酸性介质中更小,故还原性更强。
φ#Zn
2+/Zn = -0.76v φ#[Zn(OH)]/Zn = -1.22v 42-
50
普通化学习题参考答案
11 重要元素及其化合物
11-1、银组离子未知液中加入冷稀HCl所得到的白色沉淀完全不溶于热水和氨水。判断有何种离子存在?
?解:银组离子中加入冷稀HCl所得到的白色沉淀完全不溶于热水和氨水是Hg2
2。
11-2、一中性阴离子未知液,加稀硫酸有气泡产生;用银盐和钡盐试验时,得负结果;但用KMnO4和KI-淀粉检查时,都得正结果。试问何种离子可能存在?何种离子无法确定?
?解:根据题意可推断出NO?
2可能存在;NO3、Ac无法确定。 -
11-3、怎样选择溶解试样的溶剂?
解:常用的溶剂有水、盐酸、硝酸和王水。
选择原则:先稀后浓,先冷后热,先单一酸再混合酸,先非氧化性酸再氧化性酸。
11-4、下列氢氧化物:Fe(OH)3、Al(OH)3、Ni(OH)2和Zn(OH)2中,哪一种既溶于过量NaOH溶液又能溶于氨水?
解:在上述四种氢氧化物中,只有Zn(OH)2既溶于过量NaOH溶液又能溶于氨水。 11-5、请选用一种试剂区别下列五种离子:Cu2+、Zn2+、Hg2+、Fe3+、Co2+。 解:用NaOH一种试剂可将Cu2+、Zn2+、Hg2+、Fe3+、Co2+五种离子区别开来. 11-6、如何用一种试剂把下列每一组中的物质分开?
(1)As2S3、HgS;(2)CuS、HgS;(3)Sb2S3、As2S3;(4)PbSO4、BaSO4;(5)Cd(OH)2、Bi(OH)3;
(6) Pb(OH)2、Cu(OH)2;(7)SnS2、PbS;(8)SnS、SnS2;(9)ZnS、CuS;(10) Ag2S、MnS。
解:(1)加NaOH,As2S3溶解而HgS不溶。
(2)加稀HNO3,CuS溶解而HgS不溶。
(3)加浓HCl,Sb2S3溶解而As2S3不溶。
(4)加NH4Ac,PbSO4溶解而BaSO4不溶。
(5)加氨水,Cd(OH)2溶解而Bi(OH)3不溶。
(6)加氨水,Cu(OH)2溶解而Pb(OH)2不溶。
(7)加Na2S,SnS2溶解而PbS不溶。
(8)加Na2S,SnS2溶解而SnS不溶。
(9)加稀HCl,ZnS溶解而CuS不溶。
(10)加稀HCl,MnS溶解而Ag2S不溶。
11-7、某一化合物A溶于水得一浅蓝色溶液,在A溶液中加入NaOH溶液可得浅蓝色沉淀B,B 能溶于HCl溶液,也能溶于氨水;A溶液中通人H2S,有黑色沉淀C生成,C难溶于HCl溶液而易溶于热浓HNO3中;在A溶液中加入Ba(NO3)2溶液,无沉淀产生,而加入AgNO3溶液时有白色沉淀D生成,D溶于氨水。试判断A、B、C、D为何物,并写出有关反应式。
解:化合物A为CuCl2,浅蓝色沉淀B为Cu(OH)2,黑色沉淀C为CuS,白色沉淀D
为AgCl。
Cu2+ +2OH- = Cu(OH)2
Cu(OH)2+2H+=Cu2++2H2O
51
普通化学习题参考答案
Cu(OH)2+4NH3·H2O=[Cu(NH3)4] + 2OH + 4 H2O
Cu2+ + H2S = CuS + 2H+
3CuS + 8HNO3=3Cu(NO3)2 + 3S + 2NO + 4H2O
Cl- + Ag+ =AgCl
+- AgCl+2NH3·H2O=[Ag(NH3)2] + Cl + 2 H2O
11-8、已知一溶液只有第二组阳离子,将此溶液分成3份,分别得到下述实验结果,试判断哪些离子可能存在?
(1)用水稀释,得到白色沉淀,加HCl溶液则溶解;
(2)加入SnCl2无沉淀发生;与组试剂作用,生成黄色沉淀,此沉淀一部分溶于Na2S,另一部分不溶,仍为黄色。
解:(1)容易水解的离子如: Bi3+﹑Sb(Ⅲ)﹑Sn(Ⅱ)﹑Sn(Ⅳ)存在。
(2)可知Hg2+、Pb2+不存在。
+ (3)生成的硫化物为黄色,则Bi3+﹑Cu2+、Sn2不存在。
+ 根据以上判断,可能有:Cd2﹑Sn(Ⅳ)﹑As(Ⅲ)﹑As(Ⅴ)﹑Sb(Ⅲ)﹑Sb(Ⅴ)
2+-
52
三 : 普通化学参考答案(任丽萍)
普通化学习题参考答案
1 物质的状态、溶液和胶体
思考题与习题
1. 在相同温度下,几种压力相同、体积不同的气体混合,混合后保持总压力不变,总体积
与组分体积是什么关系?
2. 什么是临界温度?它与液体的正常沸点有何区别?
3. 最常用的表示浓度的方法有几种?
4. 什么是分散系?分散系是如何分类的?
5. 如何理解溶胶的稳定性?破坏溶胶稳定性的办法有哪些?
6. 试述明矾能净水的原理
7. 什么叫表面活性剂?其分子结构有何特点?
8. 试述乳浊液的形成、性质和应用。[www.61k.com]
9. 某容器中含有14.0g N2 、16.0g O2、、4.40gCO2, 20 ? 时容器的压力为200kPa,计算各气、
体的分压和该容器得体积。
解:该容器中各气体的物质的量分别为:
14.0gn(N)??0.5mol 2?128.0g?mol
16.0gn(O2)??0.5mol?1 32.0g?mol 4.40g n(CO2)??0.1mol?1 44.0g?mol
各气体的摩尔分数为:
0.5mol ?(N2)??0.455 (0.5?0.5?0.1)mol
0.5mol ?(O2)??0.455(0.5?0.5?0.1)mol
0.1mol?(CO2)??0.090 (0.5?0.5?0.1)mol
各气体的分压为:
P(N2)?0.455?200kPa?91kPa P(O2)?0.455?200kPa?91kPa
P(CO2)?0.90?200kPa?18kPa
根据气体状态方程pV = nRT得:
nRT(0.5?0.5?0.1)?8.31?(273.15?20)V?
1 p?200?13.4L
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
10.人体注射用生理盐水中,含有NaCl 0.900%,密度为1.01g.cm-3,若配置此溶液300×103g,需NaCl多少克?该溶液物质的量浓度是多少?
解:配制该溶液需NaCl的质量为:
m(NaCl)?0.900%?300?103g?2700g
该溶液的物质的量浓度为:
2700g/58.5g?mol?1?1c(NaCl)??0.155mol?L 3?3?3(300?10g/1.01g?cm)?10
11.从某种植物中分离出的一种未知结构的有特殊功能的生物碱,为了测定其相对分子量,将19g该物质溶于100g水中,测得溶液的沸点升高了0.060K ,凝固点降低了0.220K 。(www.61k.com)计算该生物碱的相对分子质量。
解: 19?1000 ?Tb?kbbB?0.512??0.060 M?100
M?1.62?103g?mol?1
19?1000 ?Tf?kfbB?1.86??0.220 M?100
M?1.61?103g?mol?1
所以,该生物碱的相对分子质量为;
(1.61?1.62)?103g?mol?1
?1.62?103g?mol?1 2
12.溶解0.324g的 于4.00gC6H6中,使C6H6 的沸点上升了0.81K 。问此溶液中的硫分子是由几个原子组成的?
解:设此溶液中的硫分子由 x个硫原子组成,则其摩尔质量为32x g?mol-1 . 0.324
nB2.53?1bB???mol?kg ?3m4?10xA
由于?Tb?kbbB,Kb(C6H6)=2.53 K?kg?mol-1
所以
2
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案 ?Tb?0.81?2.53?
x?82.53x
故溶液中的1个硫分子是由8个硫原子组成的。[www.61k.com)
13. 101 mg胰岛素溶于 10.0ml水,该溶液在25.0? 时的渗透压是 4.34kPa,计算胰岛素的摩尔质量和该溶液的蒸气压下降Δp(已知25.0? 水的饱和蒸气压为3.17kPa)。
解:设胰岛素的摩尔质量为M, 由于渗透压可由下式计算
П=cBRT
所以
101?10?3g4.34kPa??8.314kPa?L?mol?1?K?1?298.15K?3 M?10?10L
M?5.78?103g?mol?1
该溶液的蒸气压下降为:
101?10?3
mol3 ?4?p?p*?B?3.17kPa??1?10kPa?3 101?1010?1.0(?)mol 5.78?10318.0
14.今有两种溶液,其一为1.50g尿素(NH2)2CO 溶于200g 水中;另一为42.8g未知物溶于1000g水中,这两种溶液在同一温度开始沸腾,计算这个未知物的摩尔质量。
解:由于两种溶液的沸点相同,故其沸点升高值相同,则它们的质量摩尔浓度相同。 设未知物的摩尔质量为M,可得如下关系:
1.5?100042.8?60?200M
M?342.4g?mol?1
所以,该未知物的摩尔质量为342.4g?mol-1。
15. 人体血浆的凝固点为272.59K,计算再正常体温(36.5? )下血浆的渗透压。(设血浆密度为1g?ml-1)
Kf=1.86 K?kg?mol-1
bB??Tf
Kf?273.15?272.59?0.30mol?kg?1 1.86
为计算方便,设有血浆1kg.。则其在36.5? 下的渗透压为:
??nBbBRT?RTV1kg/?0.30??8.314?(273.15?36.5) 31/10
?7.72?105Pa
3
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
16.硫化砷溶胶是由H3AsO3和H2S 溶液作用而制得的
2H3AsO3 + 3H2S = As2S3 + 6H2O
试写出硫化砷胶体的胶团结构式(电位离子为HS-)。(www.61k.com)试比较NaCl、 MgCl2、 AlCl3三种电
解质对该溶胶的聚沉能力,并说明原因。
4
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
2 原子结构
思 考 题
1、玻尔氢原子结构理论的要点及其主要贡献是什么?
答:玻尔氢原子结构理论主要有是(1)原子核外电子只能在符合玻尔量子化条件的、具有确定的半径和能量的稳定轨道上运动,电子在稳定轨道上运动时,既不吸收能量也不放出能量。(www.61k.com](2)不同的原子轨道能量不同,轨道离核越远,能量越高;(3)电子在不同的轨道间跃迁时,才能发生能量的辐射或吸收;发射光谱的能量决定于两个轨道间的能量差。
玻尔氢原子结构理论的主要贡献是将量子化概念引入到了原子结构中,提出了电子运动的轨道和能量都是量子化的。该理论较好的解释了氢原子和类氢离子的发射光谱,使人们开始了对原子结构的系统、科学的认识。
2、微观体系中的电子运动与宏观物质比较,有什么不同?现代原子结构理论是如何来描述电子的运动状态的?
答:微观体系中的电子运动与宏观物质比较,最大的特点是其表现出来的波粒二象性,并且电子波是一种不同于机械波和电磁波的一种概率波。
现代原子结构理论是根据量子力学建立薛定谔方程,通过对薛定谔方程求解所得的波函数来描述电子的运动状态的,而波函数又是由量子数决定的,因此,通常可用四个量子数的一组取值来描述电子的一种运动状态。
3、量子力学的原子轨道概念与玻尔理论的原子轨道概念有什么不同?
答:量子力学的原子轨道是具有确定量子数取值的一个波函数,也叫原子轨函,它没有固定轨迹的含义;而玻尔理论的原子轨道则是指一个具有固定轨迹的、绕核的圆形轨道。
4、原子轨道和电子云的角度分布图有哪些异同?
答:两者相同之处在于:首先在于两者在空间出现了极大值的位置和大小是相同的,其次,两者在空间各个方面上的伸展趋势是相似的,即形状上有相似性。两者的不同之处在于:①原子轨道的角度分布图有正负之分,而电子云的角度分布只有正值;②p,d态电子云的角度分布图比原子轨道的角度分布要瘦小些。
5、4个量子数的取值和物理意义分别是什么?
答:主量子数n的取值为正整数,即n=1,2,3,4,5,6,7??,主量子数表明了原子轨道离核的远近,同时说明了原子轨道能量的高低。
角量子数l的取值规定为l=0,1,2,3??(n-1)。角量子数表明了原子轨道角动量的5
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
大小,它体现的是原子轨道在空间各个方向上的伸展,即决定了原子轨道的形状,同时,还要影响多电子原子体系原子轨道的能量。(www.61k.com]
磁量子数的取值为m=0,±1,±2,??±(l-1)。磁量子数说明的是原子轨道在空间的伸展方向。
自旋磁量子数mS的取值只有+和-两种。它描述的是电子的自旋运动状态。
6、什么是屏蔽效应和钻穿效应?他们对原子轨道能量有何影响?
答:在多电子原子体系中,电子与电子间有相互排斥作用,特别是内层和同层电子对外层电子的排斥力削弱了原子核对外层电子的吸引力,这就叫做屏蔽效应,屏蔽效应使原子轨道的能量升高。主量子数较大而角量子数较小的原子轨道的电子云径向分布图有多个小峰,除其最高峰外,其余小峰伸入到了内层轨道的主峰内,这种现象叫钻穿效应,钻穿效应由于避免了内层电子的屏蔽效应,所以使原子轨道的能量降低。
7、多电子原子体系核外电子的排布遵循哪些规律?
答:多电子原子体系核外电子的排布遵循保利不相容原理、能量最低原理和洪特规则三规律。
8、元素原子第一电离能的周期性变化规律及其原因是什么?原子的各原子参数之间相互有何区别和联系?
答:同一周期的元素,从左到右,第一电离能的总体变化趋势是逐渐减小,到每周期的最后一个元素稀有气体时,第一电离能的数值达到最大。这是由于同一周期元素,从左到右,电子层没有变化,核电荷逐渐增加,原子半径逐渐减小,核对外层电子的吸引力增强的结果。同一族的元素,自上而下,第一电离能的总体变化趋势是逐渐减小的,这是因为从上到下,电子层数增加,原子半径变大,有效核电荷减小,核对外层电子的吸引力减弱的原因。
原子参数常包含原子半径、有效核电荷、电离能、电子亲和能和电负性等,它们分别表示了原子性质的各个方面,但各原子参数在周期表中都呈现出一定的周期性变化规律,并且这些周期性变化规律都是由于原子内电子有规律性排布的结果。
9、什么叫镧系收缩?什么叫镧系收缩效应?
答:对镧系和锕系元素,从左自右,由于增加的电子填充进入了倒数第三层的(n-2)f轨道,其对外层电子的屏蔽作用较大,因此,随着原子序数的增加,镧系元素原子半径缓慢的减小,这种现象叫着镧系收缩。由于屏蔽效应,使镧系元素原子半径减小缓慢,但镧系中14种元素原子半径减小的累计值还是不少的,因此到镧系后的几个第六周期副族元素的原12126
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
子半径与相应的第五周期同族元素的原子半径十分接近,导致其性质也十分相似,这种现象叫做镧系收缩效应。(www.61k.com)
习 题
1、有无下列各组电子运动状态,为什么?
(1)n=2,l=1,m=0 ; (2)n=2,l=2, m=-1;
(3)n=2,l=0,m=-1; (4)n=2,l=3, m=2;
(5)n=3,l=2,m=-2; (6)n=4,l=-1,m=0;
(7)n=4,l=1,m=-2; (8)n=3,l=3, m=-3。
解:(1)、(5)有;(2)、(3)、(4)、(6)、(7)、(8)无,违背了四个量子数的取值规则。
2、在下列各组量子数中,填充合理的量子数。
(1)n≥?, l=2, m=0, ms=+ ;
(2)n=4, l=2, m=0, ms=?;
(3)n=2, l=0, m=?, ms=+ ;
(4)n=2, l=? m=1, ms=- 。
解:(1)、n≥3、4、5?? (2)、ms= +或- (3)、m=0 (4)、l=1
3、试说明下列符号表示的意义:(1) s (2) 3d (3) 2P。
解:(1)表示角量子数l=0的电子亚层;
(2)表示主量子数为3,角量子数l=2的电子亚层;
(3)表示主量子数为2,角量子数l=2的电子亚层中填有两个电子。
4、按照能量大小顺序排列下列原子轨道,并解释轨道能量的大小顺序。
(1)E1S,E4S,E3S,E2S; (2)E3d,E3S,E3P; (3)E4S,E3d。
解:(1)E1S<E2S<E3S<E4S ,角量子数相同,随着主量子数的增加,电子离核越来越远,故能量越来越大;
(2)E3S<E3P<E3d ,主量子数相同,随着角量子数的增加,电子离核越来越远,故能量越来越大;
(3)对单电子原子体系,原子轨道能量只决定于主量子数,所以E4S>E3d;对多电子原子体系,核电荷Z在15到20之间时,发生了能级交错,E4S<E3d ;核电荷Z在小于15或7 21212121212
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
大于20时,E4S>E3d。(www.61k.com)
5、下列各原子的电子构型中,何者是基态、激发态或不正确的?
(1)1s2s2d (2)1s2s2p3s
2122262112241 8(3)1s2s2p (4)1s2s2p3s3p
22621 2 (5)1s2s2p3s3p
解:(1)、不正确(2)、激发态(3)、激发态(4)、不正确(5)、基态
6、用四个量子数描述基态N原子中最外电子层上的各电子的运动状态。
解: (1)n=2, l=0, m=0, ms=+ ;
(2)n=2, l=0, m=0, ms=-;
(3)n=2, l=1, m=0, ms=+(或-);
(4)n=2, l=1, m=1, ms=+ (或-);
(5)n=2, l=1, m=-1, ms=+(或-)。
7、写出Cr、Cu、Ag、V等原子和Co、Fe、Sn、I等离子的电子组态。
解:Cr、24 1S2S2P3S3P3d4S Cu、29 1S2S2P3S3P3d4S
Ag、47 1S2S2P3S3P3d4S4P4d5S V、23 1S2S2P3S3P3d4S
Co、27 1S2S2P3S3P3d Fe、26 1S2S2P3S3P3d
Sn、50 1S2S2P3S3P3d4S4P4d5S I、53 1S2S2P3S3P3d4S4P4d5S 5P6 2+226261026102-2262610261022+2262673+22626522626102610122626322262651226261012+3+2+-1212121212121212
8、不查周期表,分别写出下列元素在周期表中的位置(周期、族、区),元素符号及名称。 ⑴ Z=47;
⑵ 基态原子中有3d电子;
⑶ 基态原子中有两个未成对的3d电子;
⑷ 基态原子的电子构型为[Kr]4d5s;
⑸ 基态原子的外层电子组态为3d4s。
解: (1)银,Ag,第五周期,第IB族;
(2)铁,Fe,第四周期,第VIII族;
(3)钛,Ti,第四周期,第IVB族或镍,Ni,第四周期,第VIII族;
(4)铌,Nb,第五周期,第VB族;
8 12416
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(5)钪,Sc,第四周期,第IIIB族。[www.61k.com)
9、不用查表确定下列各组元素中电离势最大的一个元素。
⑴ Na,Mg,Al; ⑵ Na,K,Rb;
⑶ Si,P,S; ⑷ K,Ca,Mg。
解:(1)Mg ⑵ Na ⑶ P ⑷ Mg
10、A、B两元素,A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,写出A、B两原子的名称和电子排布式。
解:A,钒,V、23 1S2S2P3S3P3d4S
B,硒,Se、34 1S2S2P3S3P3d4S 4P
11、ⅠA和ⅠB族元素的最外层电子数都是1,但它们的金属性强弱却很不同,试从有效和电荷数和原子半径两方面予以解释。
解:同周期的ⅠA族元素与ⅠB族元素比较,两者电子层数相同,但ⅠB族元素核电荷比ⅠA族元素原子多,虽有屏蔽效应,可ⅠB族元素原子的有效核电荷仍比ⅠA族元素的大,ⅠA族元素原子半径比ⅠB族元素的大,ⅠB族元素原子的核对外层电子的吸引力强,所以ⅠA族元素原子的电离能小,易失去电子,金属性强,ⅠB族元素原子正好相反,不易失去电子,
金属性弱。2262610242262632
9
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
3 化学键与分子结构思考题习题答案
思 考 题
1、共价键和离子键有无本质的区别?两者各有什么特点?
答:两者并无本质的区别,从本质上来讲,两者都是电性作用力,由于离子极化,使离子键逐渐向共价键过渡。(www.61k.com)共价键既有方向性,也有饱和性;但离子键既无方向性,也无饱和性。
2、共价键的两种类型?键和?键是怎样形成的?各有何持点?
答:原子轨道沿着键轴头碰头的重叠形成的共价键叫?键,?键重叠程度较大,键能高,稳定性好;并且?键针对键轴呈圆柱形的对称,成键的两原子绕着键轴任意相对旋转,?键不会被破坏;沿着键轴,原子轨道“肩并肩”的重叠形成的是?键。由于?键是原子轨道“肩并肩”的重叠形成的,因此,其重叠程度较小,键能低于?键,稳定性较差,含有?键的物质化学性质活泼,容易参加化学反应。另外,由于?键针对键轴反对称,所以以?键结合的两原子就不能相对旋转,否则?键将被破坏。
3、什么叫极性共价键?什么叫做极性分子?键的极性和分子的极性有什么关系? 答:化学键中正负电荷重心不重合的共价键叫做极性共价键,正负电荷重心不重合的分子叫做极性分子。分子的极性是由共价键的极性和分子的空间构型共同决定的。对于双原子分子来说,分子的极性与共价键的极性是一致的,由极性共价键构成的双原子分子,必然是极性分子,由非极性共价键构成的双原子分子必然为非极性分子。对于三个或三个以上的原子构成的多原子分子,一般由非极性共价键构成的多原子分子是非极性分子,如P5、S8等,由极性共价键构成的多原子分子,如果分子的空间构型是完全对称的,共价键的极性被抵消,正负电荷重心正好重合,就是非极性分子,如果分子的空间构型不对称,正负电荷重心不重合,就是极性分子。
4、分子轨道理论对物质的顺磁性是如何解释的?举例说明。
答:根据分子轨道理论,原子轨道线性组合成分子轨道,能量升高的叫反键轨道,能量降低的叫成键轨道。电子在分子轨道中的填充仍然要遵循电子排布三原理,因此,分子轨道中就可能有成单电子,有成单电子的物质就是顺磁性物质。例如O2,起电子组态为:
2?2202:kk?2S?2S?2Px2?12?1???2?2Pz2Pz Py2Py
两个反键?轨道中各有一个成单电子,所以O2是顺磁性物质。
5、价层电子对互斥理论是怎样确定中心原子的价层电子对数的? 价层电子对数?答:中心原子价电子数?配位原子提供的成键电子数?离子电荷数 2
6、试说明乙烯分子中各种共价键的类型及碳原子的杂化轨道类型。
答:碳原子以SP杂化轨道和氢原子的1S轨道重叠成键,4个氢原子与2个碳原子形成2
10
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
4个?键,2个碳原子之间的双键,其中一个是?键,一个是?键。[www.61k.com)整个乙烯分子的各个原子处于同一平面内。
7、四种晶体的结构和性质有何异同?
答:表3-13 四种晶体的比较
8、什么叫离子极化?离子极化对物质性质有何影响?
答:离子是带电的,任何一个离子对另一个离子来说都相当于一个外加电场。当离子相互靠近时,任何一个离子都有使其它离子变形的能力,每个离子也总是会在其它离子的极化力下发生变形,产生诱导偶极,这就叫做离子的极化。
离子极化使物质化学键由离子键向共价键过渡,使晶体结构向配位数减小的方向、由离子型向分子型过渡。离子极化越强,物质的热稳定性越差,物质的熔点、沸点就越低,水解程度越大,颜色越深。
9、什么是分子间作用力?分子间作用力有何特点?
答:分子与分子之间由偶极矩产生的作用力叫分子间作用力,有取向力、诱导力和色散力三种。
分子间作用力的特点是:既没有方向性也没有饱和性,比化学键能小得多,是近程力,作用范围很小,只有几个pm,三种分子间力的存在范围和在分子中的相对大小都是不同的。
10、氢键是怎样形成的?氢键的怎样形成对物质性质有什么影响?
答:当氢原子与一个电负性大的X原子以共价键结合后,共价键中的共用电子对强烈的偏向X原子,使氢原子带上了部分正电荷,几乎成为裸露的质子,它可以吸引与其靠近的另一个电负性较大的、带有孤对电子的Y原子,H原子与Y原子结合就形成了氢键。
分子间若能生成氢键,物质的熔点、沸点要升高;如果溶质与溶剂分子能够形成分子间氢键,则溶质的溶解度要增大;氢键的形成对物质的粘度、表面张力、比热容等很多性质都有影响。
习 题
1、NaF和MgO中离子的电子构型相同,但MgO的硬度是NaF的两倍,MgO的熔点为2800℃,比NaF的熔点993℃高得多,为什么?
答:NaF和MgO均为离子化合物,其结合力离子键与离子半径、电荷和电子构型有关,NaF和MgO比较,后者离子电荷的乘积比前者大4倍,所以离子间的结合力大,离子键牢固,其硬度和熔点都要大得多。
2、氧化物MgO、CaO、SrO、BaO均是NaCl型离子晶体,据离子键理论定性比较它们的晶格能大小和熔点的高低。
答:阴离子相同,阳离子半径从左到右逐渐增大,离子间作用力逐渐减弱,所以从左到右,各离子化合物的晶格能逐渐减小,熔点逐渐降低。
11
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
3、写出O2,O?分子或分子离子的分子轨道式,并比较它们的稳定性,判断它们的磁,O?22
性。(www.61k.com)
222?22答: O2:kk?2S?2S?2Px?2Py?2Pz
2?22 O?2:kk?2S?2S?2Px
2?22 O?2:kk?2S?2S?2Px?1?1?2Py?2Pz 键级=2 2?22?1???2?2Pz2Pz 键级=1.5 Py2Py2?12??2?2PzPy2Py 键级=2.5
??? 从键级来看,O?由于轨道中都有成单电2>O2>O2,所以稳定性大小顺序为O2>O2>O2;
子,故三者都是顺磁性的。
4、BF3和NF3的杂化轨道类型和分子几何构型分别是什么?它们是极性还是非极性分子?
答:BF3 SP杂化,平面三角形,非极性分子;
NF3 SP不等性杂化,三角锥形,极性分子。
5、利用价层电子对互斥理论判断下列分子或离子的空间几何构型:
2???3?PO3(1)BeCl2(2)SnCl2(3)PH?(4)SO3(5)AlF(6)PCl5(7)SO2
4(8)SF6(9)4(10)O3 46
2?答:(1)BeCl2 直线形,(2)SnCl2 V形,(3)PH? 正四面体形,(4)SO3 三角锥形, 4
?3?(5)AlF 正八面体形,(6)PCl5 三角双锥形,(7)SO2(8)SF6 正八面体形,4 正四面体形,6
?(9)PO3
4 正四面体形,(10)O3 V形。 23
6、根据离子极化理论解释: AgF、AgCl、AgBr、AgI的熔、沸点,溶解度和颜色的变化顺序。
答:AgF、AgCl、AgBr、AgI各物质从左到右,阳离子相同,阴离子的离子半径逐渐增大,阴离子的离子的变形性增大,离子极化逐渐增强,所以熔、沸点逐渐降低,在水中的溶解度逐渐减小,颜色逐渐加深。
7、将下列分子按化学键的极性大小依次排列,并说明原因:F2、HF、HCl、HBr、HI、NaF。
答:F2为同核双原子分子,F原子间形成的是非极性共价键;NaF为典型的离子型化合物,键的极性是最强的;HF、HCl、HBr、HI各无物质从左到右,形成共价键的两原子的电负性差越来越小,共价键的极性也越来越小;所以其化学键的极性大小依次为F2<HF<HCl<HBr<HI<NaF。
8、下列各对分子间存在的分子间力有哪些,是否存在氢键?
(1)H2~H2, (2)H2O~H2O, (3)NH3~H2O, (4)CCl4~H2O
答:(1)H2~H2,存在色散力,无氢键;(2)H2O~H2O,存在取向力、诱导力和色散力,有分子间氢键;(3)NH3~H2O,存在取向力、诱导力和色散力,有分子间氢键;(4)CCl4~H2O,存在诱导力和色散力,无分子间氢键。
9、下列物质哪些能形成分子间氢键,哪些能形成分子内氢键,哪些不能形成氢键? 12
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(1)苯,(2)NH3,(3)C2H6,(4)水杨醛,(5)对羟基苯甲醛,(6)H3BO3
答:(1)苯,不能形成氢键;(2)NH3,分子间氢键;(3)C2H6,不能形成氢键;(4)水杨醛,分子内氢键;(5)对羟基苯甲醛,分子间氢键;(6)H3BO3,分子内氢键。[www.61k.com)
10、判断下列晶体类型,并指出其结合力分别是什么?
(1)NaCl (2)SiC (3)CO2 (4)Pt
答:(1)NaCl,离子晶体,结合力为离子键;(2)SiC ,原子晶体,结合力为共价键;
(3)CO2,分子晶体,结合力为分子间力; (4)Pt,金属晶体,结合力为金属键。 13
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
4 化学热力学基础
1、判断下列说法是否正确,并说明理由。[www.61k.com)
(1)指定单质的?fGm?、?fHm?、Sm?皆为零。
(2) 热力学标准态下的纯气体的分压为100 kPa,温度为298.15K。
(3) ?rGm? <0的反应必能自发进行。
(4) 298.15K时,反应O2(g)+S(g)=SO2(g)的?rGm?,?rHm?,?rSm?分别等于SO2(g)的
?fGm?,?fHm?,Sm?。
(5)随温度升高,反应C ( s ) + 1
2O2 ( g ) = CO ( g )的?r Gm?降低。
(6)T K时,反应的?r Gm与?r Gm? ( 298 ) 的关系为?r Gm ( T ) = ?r Gm?(298 ) + RT lnQ
答:(1)错。指定单质的?fGm?,?fHm?皆为零,但Sm?不为零。
(2) 错。在化学热力学中选100 kPa为标准压力,用p? 表示。把处于温度T、压力为p?状态下的纯固体、纯液体和纯理想气体分别作为固体、液体、气体的标准状态。此处温度T没有给定,对应每个T都有一个标准状态。298.15K仅仅是经常选用的温度。
(3)错。?rGm?只能判断标准状态下反应是否自发进行。
(4)错。S(g)不是指定单质,而且Sm?有绝对值,不能用类似的办法计算。
(5)对。该反应的?r Hm? ( 298K ) <0, ?r Sm? ( 298K )>0。
(6)错。等温方程式中的?r Gm与?r Gm? 必须在同一温度下。
2、指出下列各关系式成立的条件
(1)?U=Qv (2)?H=Qp (3)?G=?H—T?S
答:(1)等温等容,系统不做非体积功 (W非=0);
(2)等温等压,系统不做非体积功(W非=0);
(3)等温,且系统无非体积功。
3、指出下列过程?G,?H,?S的正、负号,并说明使过程自发进行的温度条件
(1)气体被吸附在固体表面;
+-(2)Ag(aq)+I(aq)=AgI(s);
(3)MgCO3(s)=MgO(s)十CO2(g);
(4)冰在常温下融化。
答: (1)?S <0 ?H<0 ,低温自发(?G<0),高温不自发(?G >0);
(2)?S <0 ?H<0 ,低温自发(?G<0),高温不自发(?G >0);
(3)?S >0 ?H>0 ,高温自发(?G<0),低温不自发(?G >0);
(4)?S >0 ?H>0 ,高温自发(?G<0),低温不自发(?G >0)。
4、一热力学系统在等温定容的条件下发生一变化时,放热15kJ,同时做电功35kJ.假若系统在发生变化时,不做非体积功(其他条件不变),计算系统能放出多少热。
解: 由题意知, Q=-15kJ,W=-35kJ;
故△U=Q+W=-15kJ-35kJ = -50 kJ
等温定容,不做非体积功 QV=△U=-50kJ
5、由下列热力学数据计算NaCl(s)的晶格能U ⑴11Cl 2(g)=Cl(g) ?rHm?= D=119.8kJ·mol-1
22
⑵Na(s)=Na(g) ?rHm?=S=108.4kJ·mol-1
14
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
⑶Na(g)=Na(g)+e ?rHm?=I1=495.8kJ·mol-1
--⑷Cl(g)+e=Cl(g) ?rHm?=E=-348.7kJ·mol-1 +-
⑸Na(s)+1Cl2(g)=NaCl(s) ?rHm?=?fHm?=-411.2 kJ·mol-1 2
解:(5)-(1)-(2)-(3)-(4)得:
+-Na(g)+Cl(g)=NaCl(s) ,?rHm?= - U(以正值表示)
-U = ?rHm?(5)-?rHm?(1)-?rHm?(2)-?rHm?(3)-?rHm?(4)
=?fHm?-1D -S-I1-E 2
= -411.2 kJ·mol-1-119.8kJ·mol-1-108.4kJ·mol-1-495.8kJ·mol-1+348.7kJ·mol-1
= -786.5 kJ·mol-1
U 取正值,故晶格能为786.5 kJ·mol-1
6、生物体内有机物的分解氧化对菌体的生长、营养的消耗十分重要。(www.61k.com)例如醋酸杆菌可通过乙醇氧化反应而获得生产所需要的能量,其过程分两步完成:
CH3CH2OH? CH3CHO ? CH3COOH
请根据下列反应及其反应热计算生物体内乙醇被氧化成乙醛及乙醛被进一步氧化成乙酸的反应热。
(1)CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ?rHm?=-1371 kJ·mol-1
(2)CH3CHO(l)+5O2(g)=2CO2(g)+2H2O(l) ?rHm?=-1168 kJ·mol-1 2
(3)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ?rHm?=-876 kJ·mol-1
解:由(1)-(2)得:CH3CH2OH(l)+1/2O2(g) = CH3CHO(l)+ H2O(l)
?rHm? = ?rHm?(1)- ?rHm?(2)
= (-1371 kJ·mol-1)-(-1168 kJ·mol-1)= -203 kJ·mol-1
由(2)-(3)得:CH3CHO(l)+1/2O2(g) = CH3COOH(l)
?rHm? = ?rHm?(2)- ?rHm?(3)
= (-1168 kJ·mol-1)-(-876 kJ·mol-1)= -292 kJ·mol-1
7、已知甲醇的标准燃烧热为-726.6 kJ·mol-1,即
[CH3OH(l)+3O2(g)→CO2(g)+2H2O(l)], 2
H2O(l) ?fHm?=-285.8kJ·mol-1,CO2(g) ?fHm?=-393.5 kJ·mol-1,求甲醇的?fHm?。 解:?rHm? = 2?fHm?(H2O(l))+ ?fHm?(CO2(g))-?fHm?(CH3OH(l))- 3?fHm?(O2(g)) 2
-726.6 kJ·mol-1= 2×(-285.8 kJ·mol-1)+(-393.5 kJ·mol-1)-?fHm?(CH3OH(l))-3×0 2 ?fHm?(CH3OH(l))=-238.5 kJ·mol-1
15
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
8、化学反应A(g)+B(g)=2C(g), A、B 、C均为理想气体。[www.61k.com)在25℃,标准状态下,该过程分别依两个不同途径完成:(1)不作功,放热40 kJ;(2)作最大功,放热2 kJ。则在(1)、(2)两种情况下,计算两个过程的ΔH?、ΔG?、ΔS?。
解:ΔH?、ΔG?、ΔS?均为状态函数,其变量与途径无关,反应在标准状态下进行,故为等压过程,根据(1)Qp =ΔH? = -40 kJ
∵ ΔH?=ΔU?+pΔV=ΔU?+ΔnRT=ΔU?=-40kJ
根据(2)ΔU?=Q+W=-2kJ+W
W=-38kJ
又∵pΔV=ΔnRT=0 ∴此最大功为非体积功。
∴ΔG?=W=-38kJ
??3ΔS?=△H?△G?(?40?38)?10J=-6.7J·K-1
T298K
9、计算下列反应在标准状态下,298.15K时的?rGm?,并判断该条件下反应自发进行的方向。
⑴2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)
⑵SiO2(s)+4HF(g)=SiF4(g)+2H2O(g)
⑶I2(s)=I2(g)
⑷4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
解:(1)?rGm?=2?fGm?(Fe)+?fGm?(Al2O3)- ?fGm?(Fe2O3)-2?fGm?(Al)
= 2×0 +(-1576 kJ·mol-1) - (-741.0kJ·mol-1) -2×0
= -835.0kJ·mol-1<0
标准状态下,反应可自发。
(2)?rGm? = 2×?fGm?(H2O(g))+?fGm?(SiF4(g))- ?fGm?(SiO2(s))-4×?fGm?(HF(g))
=2×(-228.6 kJ·mol-1)+(-1506.2kJ·mol-1)(--805.0 kJ·mol-1)- 4×(-270.7 kJ·mol-1) =-75.6 kJ·mol-1
标准状态下,反应可自发。
(3)?rGm?=?fGm?(I2(g))- ?fGm?(I2(s))
=19.4 kJ·mol-1 - 0kJ·mol-1) =19.4 kJ·mol-1
标准状态下,反应不自发。
(4)?rGm?=4×?fGm?(Fe(OH)3(s))-2×?fGm?(H2O(l))- 4×?fGm?(Fe(OH)2(s))
=4×(-694.5kJ·mol-1)-2×(-237.2 kJ·mol-1) - 4×(-483.6kJ·mol-1)
= -369.2kJ·mol-1
标准状态下,反应可自发。
10、试根据下列数据,推断哪些氮的氧化物能在高温标准态下由N2 (g)和O2 (g)化合而生成(说明推断过程)。已知298 K时有关热力学数据:
?f Hm?? kJ?mol?1
?f Gm?? kJ?mol?1 N2O ( g ) 82 104 NO ( g ) 90 87 N2O3 ( g ) 83 139 NO2 ( g ) 33 51
解: (1) N2 (g) + 1/2 O2 (g) = N2O ( g )
(2) 1/2 N2 (g) + 1/2 O2 (g) = NO ( g )
(3) N2 (g) + 3/2 O2 (g) = N2O3 ( g )
16
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(4) 1/2 N2 (g) + O2 (g) = NO2 ( g )
根据题意,只有熵增反应才可能高温自发,
由 ?rGm? (T)= ?rHm? -T ?rSm?得:
T ?rSm?=?rHm? - ?rGm? (T)>0
即 ?rHm? > ?rGm? (T)
只有(2)符合条件,可推断NO ( g ),即反应(2)能在高温标准态下由N2 (g)和O2 (g)化合而成。[www.61k.com]
11、在101.3kPa和80.1℃下,苯的气化热Q=30.5kJ·mol-1,计算该条件下,苯的气化过程的?Um、?Hm、?Gm、?Sm。
解:C6H6(l) = C6H6(g),
?Hm=Qp=30.5kJ·mol-1,
对于等温等压下的相变过程:?Gm=0
?Gm = ?Hm-T?Sm
△Hm30.5?103J?mol?1=86.34J·mol-1·K-1 ?T353.25K
?Hm = ?Um+?nRT ∵?n≈ 1 mol ?Sm=
?Um =?Hm -?nRT=30.5kJ·mol-1-8.314×103kJ·mol-1·K-1×353.25K
= 27.6 kJ·mol-1 -
12、室温下暴露在空气中的金属铜,表面层因生成CuO(黑)而失去光泽,将金属铜加热到一定温度T1时,黑色CuO转化为红色Cu2O,再继续加热至温度升至T2时,金属表面氧化物消失,写出上述后两个反应的方程式,并估计T1,T2的取值范围。
解: 2CuO(s) = Cu2O(s)+1/2O2(g) (1)
Cu2O(s)= 2Cu (s)+1/2O2(g) (2)
设加热到T1时,CuO开始转变为Cu2O,则T1为转变温度。
?rHm?=?fHm?(Cu2O(s))- 2×?fHm?(CuO(s))
= -166.69kJ·mol-1- 2×(-155.23)kJ·mol-1 = 143.77 kJ·mol-1
?rSm?=1Sm?(O2(g))+Sm?(Cu2O(s))- 2×Sm?(CuO(s)) 2
= 1×205.03J·mol-1·K-1 + 100.83J·mol-1·K-1 -2×43.51J·mol-1·K-1 2
= 116.3J·mol-1·K-1
?△rHm143.77?103J?mol?1
T 1= =1236K ???1?1△rSm116.3J?mol?K
同理:?rHm?=1?fHm?(O2(g))+2?fHm?(Cu(s))-?fHm?(Cu2O(s))=166.69 kJ·mol-1 2
?rSm?=1 Sm?(O2(g))+2Sm?(Cu(s))- Sm?(Cu2O(s))=68.29 J·mol-1·K-1 2
?△rHm
?△rSmT2=166.69?103J?mol?1=2441K ??1?168.29J?mol?K
故 1236K < T1 <2441K ,T2 > 2441K
17
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
13、已知298.15K标准态下,Sm?(S,正交)= 31.8J·mol-1·K-1 ,Sm?(S,单斜)= 32.6J·mol-1·K-1 S(单斜)+O2(g)=SO2(g) ?rHm? =-297.2kJ·mol-1
S(正交)+O2(g)=SO2(g) ?rHm?=-296.9kJ·mol-1
计算说明在标准态下,温度分别为25℃和95℃时两种晶型硫的稳定性。[www.61k.com]
解:(1)-(2)得: S(单斜) = S(正交)
?rHm?= -297.2 kJ·mol-1-+296.9kJ·mol-1 = -0.3 kJ·mol-1<0
?rSm?=31.8 J·mol-1·K-1 –32.6 J·mol-1·K-1= -0.8J·mol-1·K-1<0
低温自发,
?△rHm
?△rSmT=?0.3?103J?mol?1=375K= 102 ℃ ??1?1?0.8J?mol?K
温度低于102 ℃时均正向自发,故25℃,95℃时,正交硫比单斜硫稳定。
14、反应H2 ( g )+F2 (g) = 2HF(g)被建议用于火箭的推进。估算1000 ?C、标准态下,每生成 1g HF,最多能对火箭做多少非体积功?M ( HF ) = 20 g?mol?1。 已知298 K时Sm?(H2,g)=131.0J?mol?1?K-1,Sm?(F2,g)=203.3J?mol?1?K-1,Sm?(HF,g)=175.3J?mol?1?K-1, ?fGm?(HF,g)=-271kJ?mol?1。
解: H2 ( g ) + F2 (g) = 2HF(g)
Sm?(298K)/J?mol?1?K-1 131.0 203.3 175.3 ?fGm?(298K)/kJ?mol?1 0 0 -271
?rGm? (298K)= 2×(-271)kJ?mol?1 = - 542 kJ?mol?1
?rSm? (298K)= 2×Sm?(HF,g)- Sm?(F2,g)- Sm?(H2,g) = (2×175.3-203.3-131.0)J?mol?1?K-1 = 16.3J?mol?1?K-1
?rGm? (298K)= ?rHm? (298K)-T ?rSm? (298K)
?rHm? (298K)=?rGm? (298K)+ T ?rSm? (298K)
= - 542 kJ?mol?1 + 298 ×0.0163 kJ?mol?1 = -537.14 kJ?mol?1
1000 ?C、标准态下,?rGm? (1273.15K)≈ ?rHm? (298K)-T ?rSm? (298K)
≈ -537.14 kJ?mol?1 -(1273.15K)×0.0163kJ?mol?1= -557.89 kJ?mol?1 由于 ?rGm = - W,
557.89kJ?mol?1
-11g HF最多能对火箭做非体积功为:= 13.95 kJ·g ?12?20g?mol
15、生石灰(CaO)是由石灰石(CaCO3)高温分解得到的,请利用有关的热力学数据,估计标准状态下,石灰石的分解温度
解:石灰石(CaCO3)热分解温度可由分解反应在标准压力下(100kPa)达平衡时的温度来估算。
CaCO3(s) = CaO(s) + CO2(g)
?rHm?(298K)= ?fHm?(CaO,s,298K) + ?fHm?(CO2,g,298K) - ?fHm?(CaCO3,s,298K) =-635.55 kJ·mol-1 -393.51 kJ·mol-1 +1206.88 kJ·mol-1 =177.82 kJ·mol-1 ?rSm?= Sm?(CaO,s,298K) +Sm?(CO2,g,298K) - Sm?(CaCO3,s,298K)
18
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
=39.75 J·mol-1·K-1+213.64 J·mol-1·K-1-92.89 J·mol-1·K-1=160.5 J·mol-1·K-1 根据?rGm?(T)≈ ?rHm? (298K)-T ?rSm? (298K)=0 得
T=?△rHm
?△rSm177.82?103J?mol?1 =1108K ?160.5J?mol?1?K?1
石灰石的分解温度约为1108K。(www.61k.com]
16 、某气体反应, ?r Hm?=10.5 kJ?mol?1,?r Sm?= 41.8 J?mol?1 ? K ?1,一定温度下达平衡时各物质分压均为100 kPa。估计反应温度。
解:定温下达平衡,故?r Gm?= 0;
反应温度T=?△rHm
?△rSm10.5?103J?mol?1= 251.2 K ??1?141.8J?mol?K
4-17 、298K时,反应:
(1) HF ( aq ) + OH? ( aq ) = H2O ( l ) + F? ( aq ) , ?r Gm?= ? 61.86 kJ?mol?1
(2) H2O (l) = H? ( aq ) + OH? ( aq ) , ?r Gm?= 79.89 kJ?mol?1 计算HF在水中离解反应HF(aq)=H?(aq)+F?(aq)的?rGm?。若c (HF) = c (F? )=0.1mol?L?1 时,HF在水中离解反应正向自发,介质pH应在何范围?
解:(1)+(2) 得:HF(aq)=H?(aq)+F?(aq)
?rGm? = ?rGm?(1) + ?rGm? (2)
= ? 61.86 kJ?mol?1 + 79.89 kJ?mol?1 = 18.03 kJ?mol?1
根据题意,HF在水中的离解正向自发,则
?rGm = ?rGm?+RT ln Q < 0 [c(H?)/c?][c(F?)/c?]RTln<-?rGm? ?c(HF)/c
0.1c(H?)/c?
8.314J·mol·K ×298K ×ln < -18030 J·mol-1 0.1-1-1
c (H?) /c<6.9×10-4
pH ? 3.16
?
19
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
5 化学平衡
1、判断下列叙述是否正确:
(1) 化学反应商Q和标准平衡常数K的单位均为1。[www.61k.com)
?(2) 对ΔrH?
m<0的反应,温度越高,K越小,故ΔrGm越 大。 ??
(3) 一定温度下,1,2两反应的标准摩尔吉布斯自由能之间的关系为
2?ΔrG?(1)=2ΔG(2),则两反应标准平衡常数间关系为:K(2)=[K(1)]。 rmm??
(4) 从化学平衡的角度看,升高温度,有利于吸热反应;降低温度有利于放热反应。
(5) 由于反应前后分子数相等,所以增加系统压力对化学平衡没有影响。
答:(1)正确。
(2)错误。ΔrG?
m的代数值越大。
(3)错误。K(1)=[K(2)]2。
(4)正确。
(5)错误。对于反应前后气体分子数相等的反应,增加系统压力对化学平衡没有影响。
2、673 K时,反应N2(g)+3H2 (g)= 2NH3(g)的K= 6.2×104,计算反应-???
NH3(g)=13?N2(g)+H2(g) 的K。 22
?解:找出两个反应之间的关系,再根据K的表达式推导得到:
[ K]2=
K= 40
3、已知下列反应在指定温度的ΔrG?
m和K:
(1) N2(g)+???1 6.2×104 -1?O2(g)=N2O(g), ΔrG?
m(1), K(1); 2
? (2) N2O4(g)=2NO2(g), ΔrG?
m(2), K(2);
(3) 1?N2(g)+O2(g)=NO2(g), ΔrG?
m(3), K(3); 2
?计算反应 (4) 2N2O(g)+3O2(g)=2N2O4(g)的ΔrG?
m和K。
解:(4)=4×(3)- 2×(1)-2×(2)
???根据热化学定律:ΔrG?
m= 4×ΔrGm(3)-2×ΔrGm(1)-2×ΔrGm(2)
20
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
4[K(?3)] 根据多重平衡规则: K??[K]?[K]?2
(1)?2(2)
4、(1) 写出反应O2(g)=O2(aq)的标准平衡常数表达式,已知20℃、p(O2)=101 kPa时,氧气在水中溶解度为1.38×10-3 mol·L-1,计算以上反应在20℃时的K,并计算20℃时与 101 kPa大气平衡的水中氧的浓度c(O2),大气中p(O2)=21.0 kPa。[www.61k.com]
(2) 已知血红蛋白(Hb)氧化反应Hb(aq)+O2(g)=HbO2(aq)在20℃时K= 85.5,计算反应Hb(aq)+O2(aq)=HbO2(aq)的K(293 K)。
解:(1) O2(g)=O2(aq) ①
?c(O)/c?2 K(293K)? ?p(O2)/p
根据题意,O2在水中达到溶解平衡时,c(O2)=1.38×10-3 mol·L-1,p(O2)=101kPa
?3?1?11.38?10mol?L/1.0mol?L K(293K)?= 1.37×10-3 101kPa/100kPa
大气中p(O2)=21.0kPa 时: ????
c(O2)/c?
?1.37?10?3 21kPa/100kPa
c(O2,aq) = 2.88×10-4 mol·L-1 K?(293K)?
(2) Hb(aq)+O2(g)=HbO2(aq) ②
Hb(aq)+O2(aq)=HbO2(aq) ③
③=②-① 根据多重平衡规则:K?(293K)?85.5?6.24?104 ?31.37?10
5、在一密闭容器中进行如下反应:
2SO2(g) + O2(g) = 2SO3(g)
SO2的起始浓度是0.4mol·L-1,O2的起始浓度是1mol·L-1,当80%的SO2转化为SO3时,反应即达到平衡,求平衡时三种气体的浓度和平衡常数。
解: 2SO2(g) + O2(g) = 2SO3(g)
起始浓度/ mol·L-1 0.4 1 0
平衡浓度/ mol·L-1 0.08 0.84 0.32
K
6、55℃、100kPa时N2O4部分分解成NO2,系统平衡混合物的平均摩尔质量为61.2g·moL-1,求:(1)N2O4的解离度?和标准平衡常数K?(328K);(2)计算55℃系统总
-压力为10kPa时N2O4的离解度?。(已知M(NO2)=46g·mol1)。
解:(1)设平衡时系统中N2O4的摩尔分数为x,则NO2的摩尔分数为1-x
由题意得:92 x +(1-x)46 = 61.2
解得: x=0.33
21 ?0.322???19.04 ?2?2[c(SO2)/c]?[c(O2)/c]0.08?0.84[c(SO3)/c?]2
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
故 p(N2O4)= 33kPa;p(NO2)= 67 kPa
N2O4(g) ==== 2NO2(g)
?22 K?(328K)?[p(NO2)/p]?(67kPa/100kPa)?1.36 33kPa/100kPap(N2O4)/p?
根据化学反应计量数,达到平衡时消耗N2O4为 ? =1×67kPa=34kPa, 234kPa?0.51 34kPa?33kPa
(2)设 55℃时,系统中 p(N2O4)= x kPa;则 p(NO2)=(10-x)kPa
?22 K?(328K)?[p(NO2)/p]?[(10?x)kPa/100kPa]?1.36 xkPa/100kPap(N2O4)/p?
x= 0.64 kPa
p(N2O4)= 0.64kPa, p(NO2)=9.36kPa
消耗N2O4为1×9.36kPa=4.68kPa 2
4.68kPa? = ?0.88 4.68kPa?0.64kPa
?7、已知反应CaCO3(s)= CaO(s)+ CO2(g)在973K时的标准平衡常数K(973K)=3.00
×10-2,在1173K时K(1173K)=1.00,问:
(1)上述反应是吸热反应还是放热反应?
(2)计算反应的ΔrHm? 。[www.61k.com]
??解:ΔrG?
m(T)= ΔrHm - TΔrSm = -RTln K
??-2根据题意:(1)ΔrG?
m(973K)= ΔrHm – 973K ΔrSm = -RTln(3.00×10)
??(2)ΔrG?
m(1173K)= ΔrHm – 1173KΔrSm = -RTln(1.00)
-1联立(1)、(2) 式,解得ΔrH?=166 kJ·mol m??
为吸热反应
8、一定温度下,在煤气发生炉中同时发生下列二个反应:
(1)2C(s) + O2(g)= 2CO(g) K(1)=1.6×1048
(2)C(s) + O2(g)= CO2(g) K(2)=1.4×1069 当两个反应均达到化学平衡时,炉内CO2的分压为2.0×10-3kPa,计算炉内CO的分压。
解: K?
(1)??[p(CO)/p?]2 ?p(O2)/p?
22
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
? K??p(CO2)/p (2)p(O2)/p?
p(O2)同时满足两个平衡, K(?1)
K(?2)[p(CO)/p?]2?p(CO2)/p?
? p(CO)/p?K(?1)
K?
(2)?p(CO2)/p??1.5?10?13
p(CO)= 1.5×10-13×100kPa=1.5×10-11kPa
9、383 K时,反应Ag2CO3(s)=Ag2O(s)+CO2(g)的ΔrG?mol-1,求此反应的K(383 m =14.8 kJ·K);在383 K烘干Ag2CO3(s)时,为防止其受热分解,空气中p(CO2)最低应为多少kPa?
-1解:Ag2CO3(s) = Ag2O(s)+CO2(g) ΔrG?
m(383K)=14.8 kJ·mol
?△rGm77.7kJ?mol?1ln K(383K)= -????31.36= - 4.65 ?3?1?1RT8.314?10kJ?mol?K?298K?? K(383K)=9.65×10-3
K= p(CO2)/ p
为防止反应正向自发,应保证反应商Q > K
故:p(CO2) > 9.65×10-1kPa
10 、根据有关热力学数据,近似计算CCl4(l)在101.3 kPa压力下和20 kPa压力下的沸腾温度。[www.61k.com]已知ΔfH?g,298 K) = -102.93 kJ·mol-1,S?g,298 K) = 309.74 J·K1·mol-1,m(CCl4,m(CCl4,-????其他数据见书后附录。
解:查表得:
CCl4(l) CCl4(g)
-1 ΔfH? -135.4 -102.93 m / kJ·mol
S?K1·mol-1, 216.4 309.74 m / J·-
CCl4(l) = CCl4(g)
-1ΔrH?
m = 32.47 kJ·mol
-1 ΔrS? m =0.09334 kJ·mol
?所以,的正常沸点为 T1= ΔrH?
m /ΔrSm = 348 K
根据克拉贝龙-克劳休斯方程
23
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
lnp2
p1??vapHmR?(T2?T1) T1T2
?1T2?348K2032.47kJ?mol ln?() ?3?1?11018.314?10kJ?mol?K348K?T2
T2=304K
11、用减压蒸馏的方法精制苯酚。[www.61k.com)已知苯酚的正常沸点为455.15K,如外压减至p=1.333×104Pa,苯酚的沸点为多少?已知苯酚在标准状态下的蒸发热为48.14kJ·mol-1
解: 苯酚(l)=== 苯酚(g) K= p(苯酚)/ p 正常沸点: p(苯酚)1= 1.013×105 Pa , T1= 455.15K
减压: p(苯酚)2 = 1.333×104 Pa , T2= ?
-1ΔrH?
m = 48.14 kJ·mol ??
由 lnp2
p1??vapHmR?(T2?T1)得: T1T2
T2?455.15K1.333?104Pa48.14kJ?mol?1
ln?() 1.013?105Pa8.314?10?3kJ?mol?1?K?1455.15K?T2
T2= 392 K
在减压条件下,苯酚在392K即可沸腾
24
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
6 化学动力学习题答案
选择题:
1.D 2.D 3.B 4.D 5.C 6.D 7.B 8.A 填空题:
1. 1, 0.5
2. v=kCA , 0.5 , 0.25
3. 0.5 mol-1.L.S-1 , 0.05
4. 3 , v= k[NO]2[Cl2]
计算题:
1.
解:
2. 1dc(N2O5)1dc(NO2)dc(O2)(1) v??????2dt4dtdtdc(O2)1dc(Br2)1dc(HBr)(2) v???????4dtdt2dt
1.25?3.52??4?1?1解: (1) v??1??c(N2O5)??1?????7.57?10(mol?L?s)2?t2?2000?500?
(2) 作c ~ t图(图略),由图求得1500 s 时切线的斜率,取斜率的负值即为此时的瞬时速率。[www.61k.com)
3.
解: (1 ) 零级反应速率方程式为:v = k0 ,故 v = 0.014 (mol·L-1·s –1 ) ;
(2 ) 一级反应速率方程式为:v = k1c ,
∵ v1 = k1c1 , k1 = v1 / c1 = 0.014 / 0.50 = 0.028 (s –1 )
∴ v = k1c = 0.028 ×1.0 = 0.028 (mol·L-1·s –1 )
(3 ) 二级反应速率方程式为:v = k2 c 2 ,
∵ v1 = k2 c12 , k2 = v1 / c12 = 0.014 / 0.50 2 = 0.056 (L·mol -1·s –1 ) ∴ v = k2 c2 = 0.056 × 1.0 2 = 0.056 (mol·L-1·s –1 )
4.
解: (1 ) 设反应速率方程式为:v = k1 c x (NO) c y (O2)
则 :
25 v1?c1(NO)?????v2?c(NO)?2?x?c1(O2)???c(O)???22?y
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
代入 c (NO) = 0.010的两组数据,可得 y = 1 ; 代入 c (O2) = 0.020的两组数据,可得 x = 2 ; 故反应速率方程式为 v = k c 2 (NO) c (O2) ,反应级数为 2 +1 = 3 。[www.61k.com]
(2) k = v / [c 2 (NO) c (O2) ] = 2.5 ×10 -3 / ( 0.010 2 × 0.010) = 2.5 × 10 3
(L2·mol -2·s-1)
(3 ) v = k c 2 (NO) c (O2) = 2.5 × 10 3 × 0.015 2 × 0.025 = 0.014 (mol·L-1·s-1) 5.
解: 依题意,该反应的速率方程式为:v = k1 c 2 (A) c (B) = a c 2 (A) c (B)
(1) v1 = a × 12 × 0.5 = 0.5 a (mol·L-1·s-1)
(2) v2 = a × [(1/3) × 2]2 × [ (1/3) × 1] = 0.15 a (mol·L-1·s-1) 6.
解:(1) 一级反应:ln c = - k1 t + ln c0
∵ ln 0.0300 = - k1 × 200 + ln c0
ln 0.0200 = - k1 × 400 + ln c0
∴ k1 = 2 .03 × 10-3 (min-1 )
(2)ln c0 = k1 t + ln c0 = 2 .03 × 10-3 ×200 + ln 0.0300
c0 = 0.045 ( mol · L-1)
7.
解:一级反应:k1 t = ln ( c0 / c )
1c15k1?ln0?ln?1.45?10?2 (月 -1 )tc124.2
半衰期:
t1/2?0.693?47.8 (月)k1
有效期:
8. t?1c011ln?ln?24.6 (月)k1c1.45?10?20.70
解法一(作图法):
(1) 以lg c~ t作图,由直线斜率可得k1 ,进而求得t1/2 ;
(2) 据图,由直线截距可求得c0 ,继而求得t 。 解法二(代数法):
26
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(1) 将各相邻两组数据代入公式k1?ln1
tc0 ,可得ki 分别等于c
0.0967、 0.0961和0.0963 ,取平均值 k1 = 9.64 ×10–2 ,
∴ t1/2 = 0.693 / k1 = 0.693 /(9.64 × 10-2 )= 7.2 ( h )
(2) 据 ln c0 = ln c + k1 t
分别代入 t = 4,8,12,16(h)时数据,
分别得到c0 = 7.06 , 7.05 , 7.06 , 7.06 ;取平均值 c0 = 7.06
( mg · L-1 )
又:
t?1c017.06ln?ln?6.7(h)k1c3.79.64?10?2
故第二针应在下午二点半左右注射。[www.61k.com)
9.
解: 已知:T1= 651 K , T2 = 723 K , t1/2 = 365 min , Ea = 219.2 kJ﹒mol-1 10.
解: (1) 设NaOH浓度为a(mol·L-1),α-溴代丙酸溶液体积为V(ml),
则α-溴代丙酸溶液的起始浓度: c0 = 10.00 a / V (mol·L-1)
由反应式可知: HBr所消耗NaOH体积 = t 分钟后所消耗NaOH体积 - 反应前(t=0) 所消耗NaOH体积
t1 = 100 min 时::
c ( HBr) = ( 10.25 – 10.00 )× a / V = 0.25 a / V (mol · L-1)
c (α-溴代丙酸 ) = ( 10.00 – 0.25 )× a / V = 9.75 a / V (mol · L-1)
c 据 ln0?k1t 有:k1'= c1c0110.00ln?ln?2.53?10?4(min?1) tc1009.75
110.00ln?2.56?10?4(min?1) 2009.50同理,由 t2 = 200 min 可得:k1"=
∴ k1 = ( k1'+ k1") / 2 = 2.54 ×10 - 4
(2) 半衰期 t1/2?0.6930.693??2728(min) ?4k12.54?10
c01?1596(min) (3) t?kln21c03
27
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
11.
解:已知:T1 = 278 K , t1 = 48 h ,T2 = 301 K , t2 = 4 h ;
依题意:v ∝ 1 / t
设反应速率方程为:v = k·cn
则有: k 2
12.
解:已知: Ea = 50.0 kJ·mol-1 , T1 = 310 K , T2 = 313 K ,
∵ v ∝ k
∴
13.
解: 已知: Ea1 = 120 kJ·mol-1 ,Ea2 = 46 kJ·mol-1 ,T = 298 K
(1)设反应速率方程为:v = k·cn , 则 v2 / v1 = k2 / k1 据
有
28 k1?v2/cnv1/cn?v2t1?v1t2?Ea???2.303RT1T2k2lg(T2?T1)k12.303RT1T2tlg1(T2?T1)t22.303?8.314?278?30148lg?75.2(kJ?mol?1)(301?278)4lnE(T?T)v2k?ln2?a?21v1k1RT1T250.0?103?(313?310)??0.18592.303?8.31?310?313v2?1.20 (倍) v1lnk??Ea?lnARTlnk2??lnk1??Ea2RT2Ea1RT1?lgA?lgA 依题意: T2?T1 ? 298 K : k2Ea1?Ea2ln?k1RT120?103?46?103??29.8688.314?298k2·/k1?9.4?1012
?v2/v1?9.4?1012
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(2 )
?ln
8.31412 .07?10?3?lg9.4?10?2120?103 ?T2?777.3(K) k2Ea?T2?T1?????k1R?T1T2??T2?298Rk?ln2298?T2Eak1
29
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
7 酸碱与酸碱平衡
9.计算298K下,c(H3BO3)=0.050 mol·L-1的H3BO3溶液的pH值及H3BO3的离解度。[www.61k.com)
解: H3BO3是一元酸 c/c?
??= 0.05/5.8 ?10-10 >500 Ka
根据式(7—7b)
c(H+)=
mol·L-1
pH =5.27
c(H?)5.4?10?6mol?L?
= ?100=0.011% ? =c0.050mol?L??Ka?c/c?·c?=1.0 mol·L-1=5.4?10-6 5.8?10?10?0.050×
10.已知某氨水溶液的pH值为11.30,求该氨溶液的浓度。 解: pOH=2.70
c(OH-)/ c?=2.0×10-3
(c(OH?)/c?)2
c(NH3)=×c?=0.22 mol·L-1 ?Kb
11.计算在室温下饱和CO2水溶液[即c(H2CO3)=0.040 mol·L-1]中c(H+)、?2?c(HCO3)及c(CO3)。
?解: ? K?
a1>> Ka2
c/c?-7= 0.040/4.2 10 >500 ??Ka1
??-1??7?c/cc(H+)=Ka·c=×1.0 mol·L 4.2?10?0.0401
=1.3?10-4 mol·L-1
? c(HCO3)=1.3?10-4 mol·L-1
-11-1?2? c(CO3)= K?·c=5.6×10 mol·L a2
30
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
12.奴弗卡因是一种一元弱碱,测得c=0.020 mol·L-1奴弗卡因水溶液的
?pH=10.57,计算奴弗卡因的离解常数Kb。(www.61k.com]
解: pOH=3.43
c(OH-)/ c?=3.7×10-4
(c(OH?)/c?)2
K==6.8×10-6
?c/c?
b13.计算说明c(NaAc)=0.10 mol·L-1的NaAc水溶液与c(Na2CO3)=0.10mol·L-1的Na2CO3水溶液的碱性强弱。
解: NaAc水溶液
c/c?
??= 0.10/5.7 ?10-10 >500 Kb
c(OH-)/ c?=Kb??c/c?=5.7?10?10?0.10=7.5?10-6
pOH =5.12
pH=8.88
Na2CO3水溶液 c/c?
??= 0.10/1.8 ?10-4 >500 Kb1
?c(OH-)/ c?=Kb?=.8?10?4?0.10=4.2?10-3 1?c/c
pH =14-pOH =11.62
14.某一酸雨样品的pH=4.07,假设该样品的成分为HNO2,计算HNO2的浓度。
解: c(H+)/ c?=8.5×10-5
(8.5?10?5)2(c(H?)/c?)2-1? c(HNO2)=×c=×1.0 mol·L ?4?5.1?10Ka
=1.4×10-5mol·L-1
解: c(H+)/ c?=8.5×10-5
31
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
(8.5?10?5)2(c(H?)/c?)2
-5 +-1? c(HNO2)=×c+c(H)=×1.0 mol·L+8.5×10?4.6?10?4Ka
=1.0×10-4mol·L-1
15.求c(KHC2O4)=0.050 mol·L-1的KHC2O4溶液的pH值,如果加入等体积的c(K2C2O4)=0.10 mol·L-1的K2C2O4溶液后,则溶液的pH值又为多少? 解:
-5??(1) K?

a2·c/ c=6.4×10×0.050>20 Kw
而c/ c?<20K?
a1
∴c(H)/ c = +????Ka5.9?10?2?6.4?10?5?0.0501Ka2?c/c= ???2Ka?c/c5.9?10?0.0501
=1.3×10-3
pH=2.89
?c(HC2O4)0.025 (2) pH=pK-lg=4.19-lg=4.49 2?0.050c(C2O4)?
a2
16.将浓度为0.020 mol·L-1苯胺(C6H5NH2)和浓度为0.020 mol·L-1硝酸水溶液等
?体积混合,计算所得溶液的pH值。[www.61k.com) [Kb(C6H5NH2)=4.6×10-10]
解:等体积混合后
c(C6H5NH2)=0.010 mol·L-1
c(HNO3)=0.010 mol·L-1
??C6H5NH2 + HNO3 ==== C6H5NH3 + NO3
反应完成之后
?c(C6H5NH3)=0.010 mol·L-1
?Kw1.0?10?14
K= ?==2.2×10-5 ?10Kb4.6?10?a??c/c?=2.2?10?5?0.010=4.7×10-4 c(H+)/c?=Ka
pH=3.33
32
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
17.40ml c(Na2HPO4)=0.10 mol·L-1Na2HPO4水溶液与20ml c(H3PO4)=0.10 mol·L-1H3PO4水溶液混合,混合液的pH是多少?
解:反应完成后,各组分物质的量为
?? HPO2
4 + H3PO4 ====== 2H2PO4
n/mmol 40×0.10-20×0.10=2 2×20×0.10=4
?n(H2PO4)4pH=pK-lg=7.20-lg=6.90 2?2n(HPO4)?
a2
18.某混合溶液中含有c(HCl)=0.10 mol·L-1的HCl和c(HAc)=0.10 mol·L-1的HAc水溶液,计算混合液的pH及Ac-的浓度。(www.61k.com]
解: c(H+)/ c?=c(HCl)/ c?=0.10
pH=1.00
HAc + H2O = H3O+ + Ac-
起始浓度/ mol·L-1 c(HAc) c(HCl) 0
平衡浓度/mol·L-1 c(HAc)-c(Ac) c(HCl)+c(Ac) c(Ac)
≈c(HAc) ≈c(HCl) ---
[c(HCl)/c?][c(Ac?)/c?] K= ?c(HAc)/c?
a?Ka?c(HAc)/c?1.8?10?5?0.10-1??5c(Ac)= mol·L ?c??1.8?100.10c(HCl)/c?-
19. 欲配制pH=5.00 c(HAc)=0.10mol·L-1的缓冲溶液500ml,需要2.0 mol·L-1HAc多少毫升?固体NaAc多少克?
解:根据题意
?c(HAc)/c pH=pK—lg ??c(Ac)/c?
a
5.00=4.74-lg0.10 ??c(Ac)/c
c(Ac-)/ c?=0.18
c(Ac-)=0.18 mol·L-1
33
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
m(NaAc)=c(Ac-)·V·M(NaAc)
=0.18 mol·L-1×0.50L×82g·mol-1=7.4g 0.10mol?L?1?500mL?25mL V(HAc)=?12.0mol?L
20.计算298K时,c(Na2S)=0.10 mol·L-1的Na2S水溶液的pH值及c(HS-)和c(H2S)。[www.61k.com)
解: S2- + H2O ==== OH- + HS-
?KwK = ?=1.4 Ka2?b1
?Kw K== ?=7.7×10-8 Ka1?b2
??Kb1>> Kb2
c/c?
??=0.10/1.4<500 Kb1
∴c(OH)/c = -???2??Kb?(Kb)?4Kb?c/c?
2
?1.4?.42?4?0.10?1.4 =0.10 2
c(OH-)=0.10 mol·L-
c(HS-)=0.10 mol·L-
-8-??c(H2S)= Kb2· c=7.7×10 mol·L
21.20mL c(HCl)=0.20mol·L-1的HCl溶液与20mL c(NaAc)=0.50mol·L-1的NaAc溶液混合,计算
(1)溶液的pH值;
(2)在混合溶液中加入lmL c(NaOH)=0.50mo1·L-1的NaOH,溶液的pH值变为多少;
(3)在混合溶液中加入lmL c(HCl)=0.50m01·L-1的HCl,溶液的pH值变为多少。 解:反应完成之后,各剩余组分物质的量为
H+ + Ac- ==== HAc
34
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
n/mmol 20×0.20=4 20×0.50-4=6 4
n(HAc)=4.74-lg4 = 4.92 (1) pH= pK?—lga6n(Ac?)
(2) 加入的NaOH与HAc反应后
OH- + HAc ===== Ac- + H2O
n/mmol 1×0.50 4-0.50 6+0.50 pH= pK?n(HAc)
a—lgn(Ac?)=4.74-lg3.5
6.5 =5.01
(3) 加入的HCl与NaAc反应后
H+ + Ac- ====
n/mmol 1×0.50 6-0.50 4+0.50 pH= pK?n(HAc)
a—lgn(Ac?)=4.74-lg4.5
5.5 = 4.83
35 HAc
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
8 沉淀溶解平衡
1、 写出下列难溶电解质:PbCl2、AgBr、Ba3(PO4)2、Ag2S、的溶度积常数表示式。[www.61k.com]
解:PbCl2: Ksp? =C(Pb2+)(C(Cl-))2/(C?)3
AgBr: Ksp?=C(Ag+)C(Br-) /(C?)2
Ba3(PO4)2: Ksp?= (C(Ba2+))3(C(PO43-))2 /(C?)5 Ag2S: Ksp?= (C(Ag+))2C(S2-) /(C?)3
2、试计算下列化合物的溶解度(以mol·L-1表示)。
(1)碘化亚铜(I) Ksp? [CuI]= 1.1×10-12
(2)氟化镁 Ksp? [MgF2]= 6.3×10-9
(3)草酸银 Ksp? [Ag2C2O4]= 5.0×10-12
解释(1)和(3)的Ksp?相近而溶解度不同。
解:(1)CuI. S=( Ksp? [CuI])1/2=1.0×10-6(mol·L-1)
(2)MgF2 S=( Ksp? [MgF2]/4)1/3=1.2×10-3(mol·L-1)
(3)Ag2C2O4 S=( Ksp? [Ag2C2O4] /4)1/3=1.1×10-4(mol·L-1) 因为(1)和(3)是不同类型难溶电解质,所以溶解度不同。
3、做两个实验,一是用100毫升蒸馏水洗BaSO4沉淀,二是用100毫升0.010 mol·L-1H2SO4溶液洗BaSO4沉淀。如果洗液对BaSO4是饱和的。计算在每一个实验中,BaSO4溶解的物质的量。根据计算结果,用水还是用稀硫酸作洗液比较合适?Ksp? [BaSO4]= 1.1×10-10 解:(1)在纯水中BaSO4的溶解度S=(1.1×10-10)1/2=1.0×10-5(mol·L-1)
100ml纯水溶解1.0×10-5×0.1=1.0×10-6mol
(2)在0.010 mol·L-1H2SO4溶液中S=1.1×10-10/0.010=1.1×10-8(mol·L-1) 100ml此溶液溶解1.1×10-8×0.1=1.1×10-9mol
根据计算结果,用稀硫酸作洗液比较合适。
4、10ml 0.1 mol·L-1MgCl2和10ml 0.01 mol·L-1氨水相混合时,是否有Mg(OH)2沉淀?
解:等体积混合后C(Mg2+)=0.05 mol·L-1 C(NH3H2O)=0.005 mol·L-1 C(OH-)= (CKb?)1/2=(0.005×1.8×10-5)1/2=3×10-4(mol·L-1)
36
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
Q=(3×10-4)2×0.05= 4.5×10-9> Ksp? [Mg(OH)2]=1.8×10-11
所以有Mg(OH)2沉淀生成。[www.61k.com)
5、已知CaF2的溶度积为4.0×10-11,求CaF2在下列情况时的溶解度(以mol·L-1表示)。
(1)在纯水中;
(2)在1.0×10-2mol·L-1NaF溶液中;
(3)在1.0×10-2mol·L-1CaCl2溶液中。
解:(1)在纯水中,设其溶解度(S)为x mol·L-1
x=(Ksp?/4)1/3=(4.0×10-11/4)1/3=2.2×10-4(mol·L-1)
S=2.2×10-4mol·L-1
在纯水中,其溶解度为2.2×10-4mol·L-1
(2)在1.0×10-2 mol·L-1NaF溶液中,设溶解度(S)为y mol·L-1
CCa2+=y CF-=2y+1.0×10-2=1.0×10-2( mol·L-1)(同离子效应)
y×(1.0×10-2)2=4.0×10-11
y=4.0×10-7(mol·L-1)
在1.0×10-2mol·L-1NaF溶液中的溶解度为4.0×10-7mol·L-1
(1) 在1.0×10-2mol·L-1CaCl2溶液中,设溶解度(S)为z mol·L-1
CCa2+=1.0×10-2+z=1.0×10-2(mol·L-1)(同离子效应)
CF-=2z
1.0×10-2 × (2z)2=4.0×10-11
z=3.2×10-5mol·L-1
在1.0×10-2mol·L-1CaCl2溶液中,溶解度为3.2×10-5mol·L-1。
6、某溶液中含有0.10 mol·L-1Ba2+和0.10 mol·L-1Ag+ ,在滴加Na2SO4溶液时(忽略体积的变化),哪种离子首先沉淀出来?当第二种离子沉淀析出时,第一种被沉淀离子是否沉淀完全?两种离子有无可能用沉淀法分离?
解:根据溶度积规则,要BaSO4沉淀 C(SO42-) >1.1×10-10 /0.10=1.1×10-9(mol·L-1) 要Ag2SO4沉淀 C(SO42-) > 6.3×10-5/(0.10)2=6.3×10-3(mol·L-1)
所以BaSO4先沉淀。
37
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
当Ag2SO4沉淀时,C(Ba2+)=1.1×10-10 / 6.3×10-3 = 1.7×10-8(mol·L-1) < 10-5(mol·L-1) 此时Ba2+已沉淀完全。[www.61k.com)可用此法分离这两种离子。
7、现有一瓶含有Fe3+杂质的0.10 mol·L-1MgCl2溶液,欲使Fe3+以Fe(OH)3沉淀形式除去,溶液的pH应控制在什么范围?
解:设Fe3+沉淀完全时CFe3+=1.0×10-5mol·L-1
则C(OH-)=(4×10-38 /1.0×10-5)1/3=3.4×10-12(mol·L-1) pH=14.00-11.47=2.53
若使0.10mol·L-1MgCl2溶液不生成Mg(OH)2沉淀,
则C(OH-)=(1.8×10-11 /0.10)1/2=1.3×10-5mol·L-1
pH=14.00-4.87=9.13
溶液pH值应控制在2.53<pH<9.13
8、试计算下列沉淀转化反应的K?值:
(1)PbCrO4 (s) + S2- ====PbS (s) + CrO42-
(2) Ag2CrO4 (s) + 2Cl- ====2AgCl (s) + CrO42-
解:(1)K?= Ksp?(PbCrO4)/ Ksp?(PbS) = 2.8×10-13 /1×10-28=2.8×1015
(2)K?= Ksp?(Ag2CrO4)/ (Ksp?(AgCl) )2=2.0×10-12 /(1.8×10-10)2=6.2×107
9、将H2S气体通入0.10 mol·L-1ZnCl2溶液中达到饱和状态。H+离子浓度必须控制在什么数值才能阻止ZnS沉淀。Ksp? [ZnS]= 2.2×10-22
解:通入H2S气,C(Zn2+)=0.10 mol·L-1 ,若阻止沉淀生成 C(S2- )<2.2×10-22/0.10=2.2×10-23(mol·L-1)
H2S = 2H+ + S2-
[(C(H+))2C(S2- )] / [ C(H2S)(C?)2] = Ka1? Ka2? =1.3×10-7×7.1×10-15=9.2×10-22 C(H+ )>( Ka1? Ka2? C(H2S)(C?)2 / C(S2-))1/2 =(9.2×10-22×0.1×12/2.2×10-23) 1/2=2.0(mol·L-1) 所以C(H+)必须控制在2.0mol·L-1以上才能阻止ZnS沉淀生成。
38
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
9配位化合物与配位平衡
1解答
(1)六氯合铂(Ⅳ)酸钾
(2)六氰合铁(Ⅱ)酸钾
(3)三氯化六氨合钴(Ⅲ)
(4)氯化二氯·四水合铬(Ⅲ)
(5)三硝酸根·三氨合钴(Ⅲ)
(6)二溴·氯·二氨·水合钴(Ⅲ)
(7)五羰基合铁
(8)二乙二胺合铜(Ⅱ)。[www.61k.com)
2解答:
(1)错。有些配合物无外界,如[CrCl2(NH3)4]。
(2)错。中性金属原子或某些高氧化数的非金属离子也可作为配合物的形成体。如Ni(CO)4,[SiF6]2-。
(3)错。含多齿配体的螯合物中,配位体的数目不等于形成体的配位数,如
[Ca(EDTA)]2-。
(4)错。配离子的电荷数是形成体的电荷数与所有配体电荷数的代数和,如[FeF6]3-。
(5)正确。
(6)正确。
(7)错。配离子的Kd?越大,该配离子的解离越容易,稳定性越小。
(8)错。对于不同类型的配离子,不能单从Kf?大小来判断配离子的稳定性。
(9)错。每种金属离子都有一个最高配位数。当中心离子已经达到最高配位数后,即便是增加配位剂的浓度,配位数也不会增加。
(10)错。螯合物的稳定性比具有相同配位原子的简单配合物要高,是因为其中所含的 多齿配体中有多个配位原子与中心离子结合。
(11)错。[Co(CN)6]4-是内轨型配合物,但极不稳定。相反,外轨型的[Co(NH3)6]2+比较稳定。
3 完成下表
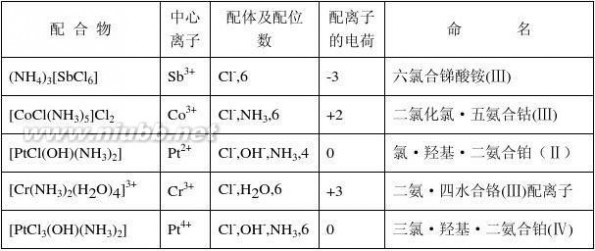
39
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
4 解答:(3),(5)。[www.61k.com]
5 解答:(1),(2),(3)
6 解答:(2),(3)。
7 解答:
(1)外轨型sp3d2,顺磁性。(2)内轨型d2sp3,顺磁性。
(3)外轨型sp3d2,顺磁性。(4)内轨型d2sp3,反磁性。
(5)外轨型sp3d2,顺磁性。
8 解答:
(1)直线型。 (2)正八面体型。
(3)平面正方形。 (3)正四面体。
(5)正八面体。
9 解答:
(1)配位个体中与中心原子或离子结合的分子或离子叫配位体,简称配体;配体中直
接键合于中心原子的原子叫配位原子,即上述的给予体原子。
(2)从配合物的价键理论出发,凡配位原子的孤对电子填在中心原子或离子由外层轨
道杂化而成的杂化轨道上,形成的配位化合物即为外轨型配合物。反之,填在由内层轨道参与的杂化轨道上,即为内轨型配合物。
(3)仅从形成配合物后中心离子的电子结构来考虑,中心离子仍保持原有的电子构型,未成对的单电子数不变,总的自旋平行单电子数较多,称该配合物为高自旋配合物;中心离子的电子构型发生改变,未成对的单电子数减少,其中总的自旋平行电子数较少,称该配合物为低自旋配合物。
(4)几何异构体,指化学式相同,内、外界相同,但配合物中配位键的排列顺序不同的一些配合物。旋光异构体指化学式相同,内、外界相同,但彼此之间互成镜象关系,类似于一个人的左手和右手。
10解答:
(1)氨水中NH3作为配体,AgCl+2NH3 =[Ag(NH3)2]++Cl-。
(2)实质上是H+与配体NH3反应生成了弱酸NH4+,从而使配位平衡向解离方向移动。
[Cu(NH3)4]2+(深蓝色)+4H2O +4H+=[Cu(H2O)4]2+(浅蓝色)+4NH4+。
(3)Fe3+将I-氧化为I2: 2Fe3++ I2=2Fe2++2I-;
再加入KCN后紫色CCl4层褪色: 2[Fe(CN)6]4-+2I-=2[Fe(CN)6]3-+ I2。
(4)通常Kf?([MY])> Kf?([CaY])
故,CaY+M=MY+Ca(方程式中省去了离子的电荷)。
(5)因为Co3+的配离子[Co(NH3)6]3+的Kf?比较大,导致[Co(NH3)6]3+的氧化能力比Co3+弱,但[Co(NH3)6]2+还原能力比Co2+强,使得空气中的氧可将[Co(NH3)6]2+氧化为[Co(NH3)6]3+。
(6)由于[Ag(S2O3)2]3-(Kf?=2.9×1013)非常稳定,用沉淀能力很强的沉淀剂才能将Ag置换出来。
2[Ag(S2O3)2]3-+ S2-=Ag2S+4S2O32-。
40
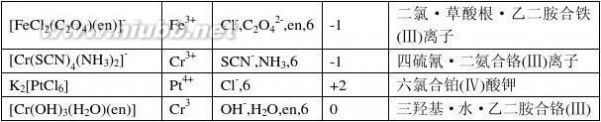
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
12 解答:
根据题意可得:
Cu2+ + 4NH3 = [Cu(NH3)4]2+
平衡时/mol·L-1 x 1+4x≈1 0.1-x≈0.1
由于Kf?很大,[Cu(NH3)4]2+解离极小,x极小,故1+4x≈1,0.1-x≈0.1 K?
?fcCu/cc?NH2??c?Cu?NH3?4??2??/c??4?/c3?2.1?1013 0.1?2.1?1013x = 4.8×10-15mol·L-1 x
答:Cu2+的浓度为4.8×10-15mol·L-1。[www.61k.com)
13 解答:
根据题意可得:
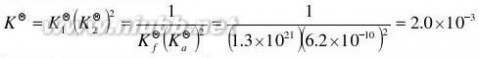
(1),?Ag?CN?2??Ag??2CN?,K1??1/K?f ??(2),CN??H??HCN,K??1/K2a (1)+(2)×2得 ?Ag?CN?2???2H??Ag??2HCN K? 平衡常数比较小,反应不是很彻底。因此,在强酸性条件下,[Ag(CN)2] –才能被破坏。 14 解答:
欲使AgI完全溶解,则其中Ag+基本完全转化为[Ag(NH3)2]+,c([Ag(NH3)2]+)=c(I-)=0.10 mol·L-1。
设开始时c(NH3)=x mol·L-1
(1) AgI + 2 NH3 = [Ag(NH3)2]+ + I-
开始时/mol·L-1 0.10 x 0 0
平衡时/mol·L-1 x-0.2 0.10 0.10
K??c?Ag?NH??/c??c?I?/c??K?c?NH?32???
?2?/c3
2
2?f??Ksp 0.10x?0.2?1.1?1078.9?10?17?9.79?10?10????
x = 3.2×103mol·L-1计算得到:最少需要1.0mL氨水的浓度是3.2×103mol·L-1, 氨水的浓度不可能达到这一浓度,故AgI不溶于氨水。
(2)对于反应:AgI+2CN- =[Ag(CN)2]-+I- 同理可得:
41
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
K
?c?Ag?CN??/c?c?I???2??2
21?0.102
x?0.22cCN/c ??1.3?10??8.9?10??11.57?10?174?/c??K??f??Ksp
x ≈0.2mol·L-1
答:最少需要1.0mLKCN的浓度大约0.2mol·L-1。[www.61k.com]
15解答:
(1) A [Ag(CN)2]-= Ag++2CN- K1=1/K?([Ag(CN)2]-)=1/(1.3×1021)
B 2Ag++ S2-= Ag2S K2=1/Ksp? (Ag2S)=1/(2×10-49) A×2+B得到:2[Ag(CN)2]-+S2-=Ag2S+4CN- K
故,K=(K1)2 K 2={1/Kf?([Ag(CN)2]-)}2{1/Ksp?(Ag2S)}
=1/(1.3×1021)2/(2×10-49)=2.96×106
(2) A AgCl=Ag++Cl- K1=Ksp?(AgCl )=1.8×10-10
B Ag++2S2O32-=[Ag(S2O3)2]3- K2=Kf?([Ag(S2O3)2]3-)=2.9×1013 A+B得到: AgCl+2S2O32-=[Ag(S2O3)2]3-+Cl- K
故,K=K1K2= Ksp?(AgCl )Kf?([Ag(S2O3)2]3-)
=(1.8×10-10)(2.9×1013)= 5.2×103
(3) A [FeF6]3-= Fe3++6F- K1=1/Kf?([FeF6]3-)=1/(2.04×1014)
B Fe3++6CN-=[Fe(CN)6]3- K2=Kf?([Fe(CN)6]3-)=1.0×1042 A+B得到: [FeF6]3-+6CN-=[Fe(CN)6]3-+ 6F- K
故,K=K1K2=Kf?([Fe(CN)6]3-)/Kf?([FeF6]3-)
=(1.0×1042)/(2.04×1014)= 4.9×1027
(4) A [Cu(NH3)4]2+=Cu2++4NH3 K1=1/Kf?([Cu(NH3)4]2+)=1/(2.1×1013)
B NH3+H2O=NH4++ OH- K2=Kb?(NH3)=1.8×10-5
C H++OH-= H2O K3=1/Kw?
A+4B+4C得到:[Cu(NH3)4]2++4H+=Cu2++4NH4+ K
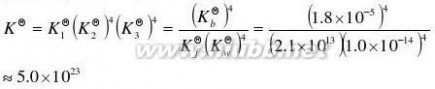
16 解答:
设平衡时c([Ag(NH3)2]+)=xmol·L-1
[Ag(NH3)2]+ + 2S2O32- = [Ag(S2O3)2]3- + 2NH3 开始时/mol·L-1 0.10 1.0 0 1.0
平衡时/mol·L-1 x 1.0-2(0.10-x)=0.80+2x 0.10-x 1.0+2(0.10-x)=1.2-2x ≈0.80 ≈0.10 ≈1.2 由于K?一般很大,Ag+几乎全部反应,x极小,
故0.80+2x≈0.80,0.10-x≈0.10,1.2-2x≈1.2
K?????2.9?10??KAg?NH?1.1?10K?fAg?S2O3?2
?
f3??32137?2.6?106
42
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案 0.10?1.22
6?2.6?10 20.80x
x = 8.7×10-8mol·L-1 答:c([Ag(NH3)2]+)= 8.7×10-8mol·L-1,c(NH3)=1.2mol·L-1。(www.61k.com]
43
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
10 原电池和氧化还原反应
选择题:
1.D 2.A 3.D 4.D 5.B 6.B
填空题:
1. -2, -1, +3, +4
2. 阴, 阳, 氧化, 金属镀层离子
3. +2, +2.5
4.KMnO4 , H2O2 , 10
5. Cu极, Zn极, 变深, 减小, 增大
6.阳(或正), 氧化, 阴(或负), 还原
问答题:
1.
解:(1)Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
(2)2Mn2+ + 5BiO3- + 14H+ = 2MnO4- + 5Bi3+ + 7H2O
(3)5H2O2 + 2MnO4- + 6H+ = 5O2 + 2Mn2+ + 8H2O 2.
解:氧化剂由强到弱:H2O2> Cr2O72-> Hg2+
还原剂由强到弱:Zn > Sn > H2O2> Br-
3.
解: (1)MnO4-是最强的氧化剂,MnO42-是最强的还原剂。(www.61k.com)
(2)Cr2O72-是最强的氧化剂,Cr是最强的还原剂。 4.
解: (1)(-)Fe | Fe2+ (1 mol·L1) || Cu2+ (1mol·L1) | Cu(+) --
E = ? (+) -? (-)
0.0592[Cu2?]= ?(Cu/Cu) - ?(Fe/Fe) + lg 2[Fe2?]#2+#2+(2)(-)Ni | Ni2+ (1mol·L-1) || Cu2+ (1mol·L-1) | Cu(+)
E = ? (+) -? (-)
44
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
0.0592[Cu2?]= ?(Cu/Cu) - ?(Ni/Ni) + lg 2?2[Ni]#2+#2+5.
解:(1)Pt | Fe2+(1mol·L-1) , Fe3+(0.0001mol·L-1) || I-(0.0001 mol·L-1),I2(s) | Pt
设右边为正极,左边为负极
E = ? (+) -? (-)
1[Fe3?]#3+2+ = φ(I2/I) + 0.0592lg?-?(Fe/Fe)-0.0592 lg 2?[I][Fe]#- = 0.535-0.771+0.0592lg
=0.238V > 0 1 0.0001?0.0001
∴假设正确,电池反应式为 I2 + 2Fe2+ = 2I- + 2Fe3+
(2) Pt | Fe3+(0.5 mol·L-1),Fe2+(0.05 mol·L-1) || Mn2+(0.01 mol·L-1),H+(0.1
mol·L-1),MnO2(固)| Pt
设右边为正极,左边为负极
E = ? (+) -? (-)
10.0592[Fe3?]#3+2+=φ(MnO2/Mn)+lg-?(Fe/Fe)-0.0592 lg 2?2[Mn2?][Fe]#2+=0.3406V > 0
∴假设正确,电池反应式为 MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O 6.
解: (1)(-)Cu | Cu 2+ (0.5 mol·L-1) || Ag + (0.5 mol·L-1) | Ag(+)
(2) 正极反应 Ag+ + e-
负极反应 Cu 2+ +2e-Ag Cu
①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+
(3)E =?? (Ag +/Ag) -? (Cu 2+ /Cu)
=??#(Ag +/Ag)+0.0592lg[Ag +]-?#(Cu 2+ /Cu)-
=0.7996+0.0592lg0.5-0.3402-
=0.4505(V)
45 0.0592lg[Cu 2+] 20.0592lg0.5 2
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
7.
解:??#(I2/I-) = 0.535V,?#(Br2/Br-) = 1.08V 在酸性条件下:MnO4- + 8H+ + 5e → Mn2+ + 4H2O
[MnO4-]=[ Mn2+]=1 mol·L-1
0.0592lg[H+]8 5? (MnO4-/Mn2+)=??#(MnO4-/Mn2+)+
pH=3时
? (MnO4-/Mn2+)=1.51+0.0592lg(10-3)8 5
=1.226(V)
既大于?#(I2/I-),也大于?#(Br2/Br-),所以既能够氧化I-,也能够氧化Br-。(www.61k.com) PH=6时? (MnO4-/Mn2+)=0.942V
此时,? (MnO4-/Mn2+)>??#(I2/I-),
但? (MnO4-/Mn2+)<??#(Br2/Br-)
∴KMnO4能氧化I-,却不能氧化Br-。 8.
解:只能选择Fe2(SO4)3。
9.
解:(1)E# =φ# (I2/I-) -φ#(Fe3+/Fe2+) = 0.535-0.771 = -0.236V < 0 反应逆向进行:2Fe3+ + 2I- == 2Fe 2++I2
(2)E# =φ# (Cl2/Cl-) -φ#(Sn4+/Sn2+) = 1.358-0.154 = 1.204V > 0 反应正向进行:Cl2 + Sn2+ == Sn4+ + 2Cl-
(3)E# =φ# (Fe3+/Fe2+) -φ#(MnO2/Mn2+) = -0.437V < 0 反应逆向进行: MnO2 + 4H+ + 2Fe2+ == 2Fe3+ + Mn2+ + 2H2O
(4)E# =φ# (Hg2+/ Hg22+) -φ#( Hg22+ /Hg) = 0.106V > 0 反应正向进行:Hg2+ + Hg == Hg22+
计算题:
1.
46
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
nE#n(?#(?)??#(?))解:lgK = = 0.05920.0592
=2?(0.535?0.559)= -0.81 0.0592
∴K = 0.15
由于E#<0
∴此时反应逆向进行
当pH=7时,[H+]=10-7,其它浓度均为1 mol·L-1
E =?? (+) -? (-)
=??#(I2/I-) -?#(H3AsO4/ H3AsO3) -
=0.535-0.559-
=0.39V>0
∴反应正向进行。(www.61k.com]
2.
解:E# =??#(+)-?#(-) = -0.44-0.771 = -1.211V < 0 △rGm#=-nFE# =-2×96485× (-1.211) = 233.69(kJ) > 0 ∴反应不能自发进行。
3.
解:(1)(-)Ag | Ag+(0.1mol·L-1) || Cu2+(0.01mol·L-1) | Cu(+) E = ? (+)-? (-)
0.0592[Cu2?] =0.34-0.7996+lg ?22[Ag]0.0592lg(10-7)2 20.0592lg[H+]2 2
=-0.46+0.05920.01lg2 20.1
=-0.46(V) < 0
故反应逆向自发进行。
(2)(-)Pt | Br2(l),Br-(0.1mol·L-1) || Cr3+(0.01mol·L-1),Cr2+(1mol·L-1) | Pt(+) E = ? (+)-? (-)
0.0592[Cr3?]2[Br?]2
=-0.41-1.087+lg ?22[Ag]
47
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
=-1.68(V) < 0
故反应逆向自发进行。[www.61k.com]
4.
解: (1)E =?? (+)-? (-)
0.0592[Pb2?] =??(Pb/Pb)-?(Sn/Sn)+lg 2[Sn2?]#2+#2+
=-0.126-(-0.136) +
=0.010V > 0
故反应正向进行。 0.05920.100lg 20.100
2?0.010n[?#(?)??#(?)] (2)lgK = = = 0.34 0.05920.0592
∴K = 2.18
5.
解: (1)?#(IO3-,H+/I2) >??#(Br2/Br-)
故电池反应为:2IO3- + 10Br- + 12H+ == I2 + 5Br2 + 6H2O
(2)E =??(IO3,H+/I2) -?(Br2/Br) + (0.0592/10)lg[Br]10 #-#-- =1.20 -1.065 + 0.0592lg0.0001
=-0.101(V) < 0
故反应逆向进行。
(3)E =??#(IO3-,H+/I2) -?#(Br2/Br-) + (0.0592/10)lg[H+]12 =1.20 -1.065 + (0.0592×12/10)lg10-4
=-0.15(V) < 0
故反应逆向进行。
6.
解: (1)?#(MnO4-/Mn2+) = (0.564 +2×2.26 + 0.95 + 1.51)/5 = 1.51(V)
3- (2)MnO2-4 MnO2 Mn
3+E# =??#(右)-?#(左) < 0,MnO2不能歧化成MnO2-4和Mn 1.23
MnO4- MnO2 Mn 2+
48
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
E# =??#(右)-?#(左) < 0,MnO2不能歧化成MnO4-和Mn2+ ∴MnO2不能发生歧化反应
3+ (3)同理,MnO2-4 和Mn能发生歧化反应。(www.61k.com)
7.
解: Cu2+ + H2 == Cu + 2H+
0.0592[H?]2E = E - lg2? [Cu]p2H2#
0.48 =??#(Cu2+/Cu) -?#(H+/H2) - =0.34 -
-lg[H+]2 = 2.36
∴pH = 2.0 0.0592lg[H+]2 20.0592lg[H+]2 2
8.
?解:(1)??(左)<??(右),所以ClO3的歧化反应能自发进行。
?(2)?G298??nFE???6?96485?(1.45?1.23)??127.36(kJ)
lgKc?nE?
0.0592?6?(1.45?1.23)?22.3 0.0592
∴Kc=1.995×1022
9.
解:能。
2?NO??2H??NO??Fe3??H2O 2?Fe
2??2NO?O3?2H??2NO??SO2
2?S4?H2O
??NO?
2?2I?4H?NO??I2?H2O 49
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
???2?5NO??3H2O 2?2MnO4?6H?5NO3?2Mn
2??3??3NO??CrO?8H?2Cr?3NO2273?4H2O
10.
3+ 2+# [Co(NH3)6]3)6] φ = 0.1v 解: 查表得
3+2+
Co φ#

= 1.84v
Cl2- φ# = 1.36v
由上面列出的半反应的φ#值可以看出,[Co(NH3)6]3+不能氧化Cl-, Co3+能将Cl- 氧化为Cl2故前者共存于同一溶液中,后者不能。[www.61k.com]
11.
解:先将有关电极电势列出
Cu2+ φ# = 0.34v ①
Fe2+ φ# = -0.4025v ②

Fe3+ 2+ φ# = 0.77v ③
当Fe使Cu2+还原时,发生下列反应, Fe + Cu2+=Cu+ Fe2+ ,从上述有关
电极电势可以看出,Fe是较强的还原剂,Cu2+是较强的氧化剂,因此反应可正向进行。同样,Cu使Fe3+还原,其反应式为2Fe3++Cu=2Fe2+ + Cu2+,反应正向进行时为Fe3+较强的氧化剂,Cu为较强的还原剂,从上面的有关电极电势也可证明这一点。
由于②式电势小于①式,故处于还原态的Fe和Cu相比,Fe的还原性较Cu强,即Fe比Cu活泼。
12.
解:在碱性介质中,被Zn氧化为,Zn2+与过量的OH-又生成,从而使Zn2+浓度
下降,于是的电极电势变得比酸性介质中更小,故还原性更强。
φ#Zn
2+/Zn = -0.76v φ#[Zn(OH)]/Zn = -1.22v 42-
50
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
11 重要元素及其化合物
11-1、银组离子未知液中加入冷稀HCl所得到的白色沉淀完全不溶于热水和氨水。(www.61k.com]判断有何种离子存在?
?解:银组离子中加入冷稀HCl所得到的白色沉淀完全不溶于热水和氨水是Hg2
2。
11-2、一中性阴离子未知液,加稀硫酸有气泡产生;用银盐和钡盐试验时,得负结果;但用KMnO4和KI-淀粉检查时,都得正结果。试问何种离子可能存在?何种离子无法确定?
?解:根据题意可推断出NO?
2可能存在;NO3、Ac无法确定。 -
11-3、怎样选择溶解试样的溶剂?
解:常用的溶剂有水、盐酸、硝酸和王水。
选择原则:先稀后浓,先冷后热,先单一酸再混合酸,先非氧化性酸再氧化性酸。
11-4、下列氢氧化物:Fe(OH)3、Al(OH)3、Ni(OH)2和Zn(OH)2中,哪一种既溶于过量NaOH溶液又能溶于氨水?
解:在上述四种氢氧化物中,只有Zn(OH)2既溶于过量NaOH溶液又能溶于氨水。 11-5、请选用一种试剂区别下列五种离子:Cu2+、Zn2+、Hg2+、Fe3+、Co2+。 解:用NaOH一种试剂可将Cu2+、Zn2+、Hg2+、Fe3+、Co2+五种离子区别开来. 11-6、如何用一种试剂把下列每一组中的物质分开?
(1)As2S3、HgS;(2)CuS、HgS;(3)Sb2S3、As2S3;(4)PbSO4、BaSO4;(5)Cd(OH)2、Bi(OH)3;
(6) Pb(OH)2、Cu(OH)2;(7)SnS2、PbS;(8)SnS、SnS2;(9)ZnS、CuS;(10) Ag2S、MnS。

解:(1)加NaOH,As2S3溶解而HgS不溶。
(2)加稀HNO3,CuS溶解而HgS不溶。
(3)加浓HCl,Sb2S3溶解而As2S3不溶。
(4)加NH4Ac,PbSO4溶解而BaSO4不溶。
(5)加氨水,Cd(OH)2溶解而Bi(OH)3不溶。
(6)加氨水,Cu(OH)2溶解而Pb(OH)2不溶。
(7)加Na2S,SnS2溶解而PbS不溶。
(8)加Na2S,SnS2溶解而SnS不溶。
(9)加稀HCl,ZnS溶解而CuS不溶。
(10)加稀HCl,MnS溶解而Ag2S不溶。
11-7、某一化合物A溶于水得一浅蓝色溶液,在A溶液中加入NaOH溶液可得浅蓝色沉淀B,B 能溶于HCl溶液,也能溶于氨水;A溶液中通人H2S,有黑色沉淀C生成,C难溶于HCl溶液而易溶于热浓HNO3中;在A溶液中加入Ba(NO3)2溶液,无沉淀产生,而加入AgNO3溶液时有白色沉淀D生成,D溶于氨水。试判断A、B、C、D为何物,并写出有关反应式。
解:化合物A为CuCl2,浅蓝色沉淀B为Cu(OH)2,黑色沉淀C为CuS,白色沉淀D
为AgCl。
Cu2+ +2OH- = Cu(OH)2
Cu(OH)2+2H+=Cu2++2H2O
51
任丽萍 普通化学参考答案(任丽萍)
普通化学习题参考答案
Cu(OH)2+4NH3·H2O=[Cu(NH3)4] + 2OH + 4 H2O
Cu2+ + H2S = CuS + 2H+
3CuS + 8HNO3=3Cu(NO3)2 + 3S + 2NO + 4H2O
Cl- + Ag+ =AgCl
+- AgCl+2NH3·H2O=[Ag(NH3)2] + Cl + 2 H2O
11-8、已知一溶液只有第二组阳离子,将此溶液分成3份,分别得到下述实验结果,试判断哪些离子可能存在?
(1)用水稀释,得到白色沉淀,加HCl溶液则溶解;
(2)加入SnCl2无沉淀发生;与组试剂作用,生成黄色沉淀,此沉淀一部分溶于Na2S,另一部分不溶,仍为黄色。(www.61k.com]
解:(1)容易水解的离子如: Bi3+﹑Sb(Ⅲ)﹑Sn(Ⅱ)﹑Sn(Ⅳ)存在。
(2)可知Hg2+、Pb2+不存在。
+ (3)生成的硫化物为黄色,则Bi3+﹑Cu2+、Sn2不存在。
+ 根据以上判断,可能有:Cd2﹑Sn(Ⅳ)﹑As(Ⅲ)﹑As(Ⅴ)﹑Sb(Ⅲ)﹑Sb(Ⅴ)
2+-
52
本文标题:短文夜色丽江参考答案-巴金 秋夜 短文分析答案61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1