一 : 醋酸的化学式为CH3COOH.某酸溶液中醋酸所含氢原子数与水中所含氢原子数相等,则该醋酸溶液中溶质的
| 醋酸的化学式为CH3COOH.某酸溶液中醋酸所含氢原子数与水中所含氢原子数相等,则该醋酸溶液中溶质的质量分数为( ) |
题型:单选题难度:中档来源:不详
由题意可知一个醋酸分子对应着2个水分子,所以该醋酸溶液中溶质的质量分数为:×100%=×100%=62.5%.
故选C. |
考点:
考点名称:关于溶液的计算
溶质质量分数:
1.
概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2.
表达式:溶质质量分数=
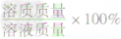
=

3.
含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO
4·5H
2O溶于水时,溶质是CuSO
4。
溶质质量分数=

×100%
b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na
2O溶于水时发生如下反应:Na
2O+H
2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=

。
c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=
 影响溶质质量分数的因素:
影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO
3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO
3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型(1)
利用公式的基本计算①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数=

×100%
②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)
溶液的稀释与浓缩 | 方法 | 计算依据 | 计算公式 |
| 溶液的稀释 | ①加水稀释
②加稀溶液稀释 | ①加水稀释前后,溶液中溶质的质量不变
②用稀溶液稀释浓溶液时。稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 | 加水稀释:稀释前后溶液中溶质的质量不变 m浓×ω浓%=(m浓+m水)×ω稀% |
| 溶液的浓缩 | ①添加溶质 ②蒸发溶剂 ③加入浓溶液 | ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量
②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出)
③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 | 蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀% |
注意:
a.几种溶液混合,溶液的体积不能简单相加,即V
总≠V
A+V
Bb.混合后溶液的质量、溶质的质量可以相加,即m
总=m
A+m
B
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)
饱和溶液中溶质质量分数的计算a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)=

×100g]可推导出:
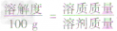
,
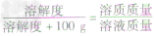
b. 溶解度与溶质质量分数的关系
| 溶解度 | 溶质质量分数 |
| 意义 | 物质溶解性的量度,受外界温度的影响 | 表示溶液中溶质质量的多少,不受外界条件影响 |
| 容积要求 | 100g | 无要求 |
| 温度要求 | 与温度有关 | 一般与温度无关 |
| 溶液是否饱和 | 一定达到饱和 | 不一定饱和 |
| 计算公式 |  ×100g ×100g | 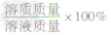 |
| 单位 | 克 | 无单位 |
| 联系 | 饱和溶液中溶质的质量分数= |
特殊的溶质质量分数的计算:(1)
结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO
4·5H
2O溶于水时,溶质是CuSO
4。
溶质质量分数=

×100%
(2)
溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)
当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na
2O溶于水时发生如下反应:Na
2O+H
2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=

。
(4)
某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)
利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
二 : 溴化氢醋酸溶液
醋酸溶液可以用阴道冲洗阴道冲洗!哪里有卖的曾经治疗的情况,想要得到什么帮助醋酸氯气定溶液怎么用
参考建议:该情况可以考虑是阴道炎阴道炎局部用药的话,,一般要求最好先用药物清洗,清洗后在用电脑置药比较好、
参考建议:用于治疗淋病,滴虫等病原体引起的各种阴道炎,宫颈糜烂,白带增多等症,也可用于妇检前,人流前后,房事后,产后的清洗保健.
三 : 溴化氢醋酸溶液
溴化氢醋酸溶液 hydrobromic acid in acetic acid
俗 称:溴化氢冰醋酸溶液
化学式:HBr+CH3COOH structure formula
CAS: HBr 10035-10-6
CH3COOH 64-19-7
产品规格 specification
外 观 橙红色透明液体 appearance
含 量 33% 40% main content
酸 度 ≥90% ≥100%acidity
游离溴 ≤200ppm ≤400ppm Br
Cl -含量 ≤ 200ppm ≤400ppm Cl-
水 份 ≤2000ppm ≤4000ppm Moisture
产品用途:主要用于医药、农药等中间体行业。医药上用于合成镇静剂和麻醉剂,如氢化可的松等,可用于石油工业及合成染料,香料。
包 装:200L钢塑复合桶,250Kg/桶 package:250kg per drum
运输方式:25℃以上需用恒温柜运输 transport:
作业须知:属二级无机酸性腐蚀物品。应贮存在阴凉、通风、干燥的库房中,避光密封保存。
供应商:山东威泰精细化工有限公司 网址:www.wtfinechem.com 电话:0532-86355455
本文标题:
溴化氢醋酸溶液-醋酸的化学式为CH3COOH.某酸溶液中醋酸所含氢原子数与水中所含氢原子数相等,则该醋酸溶液中溶质的 本文地址:
http://www.61k.com/1096571.html 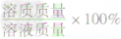 =
=
 ×100%
×100% 。
。 影响溶质质量分数的因素:
影响溶质质量分数的因素: ×100%
×100%  ×100g]可推导出:
×100g]可推导出: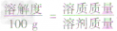 ,
,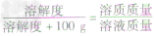
 ×100g
×100g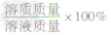

 ×100%
×100% 。
。