一 : 酸式盐:酸式盐-定义,酸式盐-性质
化学中的盐分为单盐和合盐,单盐分为正盐、酸式盐、碱式盐,合盐分为复盐和络盐。酸式盐定义为:电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐。由于阴离子中含有在水中可电离的氢原子,因此被称作“酸式”盐。但实际上,只有强酸(如硫酸)及少部分中强酸(如磷酸)的酸式盐呈酸性,大多数弱酸的酸式盐都因阴离子的水解而显碱性。要注意的是,酸式盐在以离子晶体形式存在时,阴离子并不电离出氢离子,氢离子是酸式酸根离子的一部分。在熔融状态下,酸根离子也不电离。(酸在熔融状态下不电离)
酸式盐_酸式盐 -定义
电离时生成的阳离子除金属离子【或NH4+(有金属离子性质)】外还有氢离子,阴离子为酸根离子的盐。酸碱性判断

酸式盐结构①水溶液呈酸性的酸式盐
强碱强酸的酸式盐:如NaHSO4,在其水溶液中发生完全电离,因此溶液呈酸性;
强酸弱碱的酸式盐:强酸和弱碱生成的盐:如NH4HSO4,溶液呈酸性。(溶液显酸性是由于NH4+水解,离子方程:NH4++H2O=NH3·H2O+H+)
②水溶液呈碱性的酸式盐:
一般为强碱弱酸的酸式盐,如:HPO4-盐,HCO3--盐,HS--盐,因“电离”趋势小于“水解”趋势,所以溶液呈碱性。
酸式盐热稳定性
一般为正盐热稳定性大于酸式盐热稳定性。
Na2CO3受热不易分解,2NaHCO3=Na2CO3+CO2↑+H2O条件加热
CaCO3=CaO+CO2↑,(条件高温)Ca(HCO3)2=CaCO3+CO2↑+H2O(条件加热)
与酸碱反应
弱酸的酸式盐,既能与碱反应,又能与酸反应。
NaHCO3:NaHCO3+NaOH=Na2CO3+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O
水解程度对比
强碱弱酸的酸式盐水解程度小于强碱弱酸的正盐水解程度。如NaHCO3和Na2CO3
NaHCO3水解只有1步:HCO3-+H2O=H2CO3+OH-,[OH-]>[H+]
显然,2种相同浓度的溶液其碱性:NaHCO3<Na2CO3
酸式盐_酸式盐 -性质
酸式盐的性质
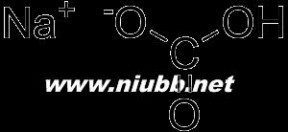
酸式盐结构1、水中的溶解性
一般来说,在相同温度下,不溶性正盐对应的酸式盐的溶解度比正盐的大,如CaCO3难溶于水,Ca(HCO3)2易溶于水;磷酸的钙盐溶解性由大到小为:Ca(H2PO4)2>CaHPO4>Ca3(PO4)2。可溶性正盐对应的酸式盐溶解度比其正盐[1]的小,如Na2CO3的溶解性大于NaHCO3,K2CO3的溶解性大于KHCO3。正因为如此,才有向饱和的碳酸钠溶液中通入过量的二氧化碳有沉淀生成,其反应的方程式为:
Na2CO3(饱和)+CO2+H2O=2NaHCO3↓
2、与碱的反应
酸式盐与碱均可反应,弱酸的酸式盐既能与强酸又能与强碱反应。
中学常见的酸式酸根有:HCO3-、HSO3-、HS-、H2PO4-、HPO42-等,常见的反应离子方程式为:
HCO3-+OH-=CO32-+H2O
HSO3-+OH-=SO32-+H2O
HS-+OH-=S2-+H2O
H2PO4-+OH-=HPO42-+H2O
H2PO4-+2OH-=PO43-+2H2O
HPO42-+OH-=PO43-+H2O
3、与酸的反应
强酸的酸式盐与酸不发生复分解反应。尽管是盐,但可作强酸用,其水溶液具有酸的通性,如NaHSO4可与氢前的金属反应,生成氢气;可与SO32-反应,生成SO2。弱酸的酸式盐与对应的酸不反应(HPO42-例外),可与酸性比其强的酸反应,生成新酸和新盐,如NaHCO3可与HCl、H2SO3、H3PO4在水溶液中反应。
常见的酸酸性强弱为:H2SO4H3PO4H2S
盐酸>H2SO3>HAc>H2CO3>HClO
HNO3H2SiO3
强酸中强酸弱酸
常见酸式酸根与酸反应的离子方程式有:
HCO3-+H+=CO2↑+H2O
HSO3-+H+=SO2↑+H2O
HS-+H+=H2S↑
H2PO4-+H+=H3PO4
HPO42-+H+=H2PO4-
HPO42-+2H+=H3PO4
4、酸式盐电离和水解的性质
强酸的酸式盐只能电离,不能发生水解,如NaHSO4的水溶液一定显酸性;弱酸的酸式盐既可电离,也可水解,其水溶液的酸碱性将由电离和水解以及阳离子等方面决定。中学不研究弱酸弱碱盐溶液的酸碱性,因此,对于强碱弱酸对应的酸式盐溶液的酸碱性就由电离和水解2个方面来决定。当电离大于水解的趋势,其水溶液显酸性,如NaHSO3、NaH2PO4;当水解大于电离的趋势,其水溶液显碱性,如NaHCO3、NaHS、Na2HPO4。当然,电离和水解的趋势哪个大最根本的是要由实验来判断。但是对中学化学中常见的几种,我们要记住。
5、对热的稳定性
一般说来,热稳定性大小顺序为:可溶性正盐>不可溶正盐>酸式盐>多元酸(对同1类酸而言)。如:
Na2CO3对热稳,加热不分解。
CaCO3=高温CaO+CO2↑
2NaHCO3=(加热)Na2CO3+CO2↑+H2O
H2CO3=(可逆)CO2↑+H2O
酸式盐的生成
1、多元弱酸与少量碱反应
如:
H2S+NaOH=NaHS+H2O
CO2+NaOH=NaHCO3
SO2+NaOH=NaHSO3
H3PO4+NaOH=NaH2PO4+H2O
H3PO4+2NaOH=Na2HPO4+2H2O
如果碱的量较大会生成正盐。
2、弱酸正盐与对应的弱酸反应
通入相应的气体或加入过量相应的酸可以把正盐全部转化为酸式盐,这是制取酸式盐的最佳方法。如:
CaCO3+H2O+CO2=Ca(HCO3)2
Na2S+H2S=2NaHS
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2
在中学阶段,所有酸式盐都定义为可溶于水,如要出沉淀,就必须超过溶解度,并非一定要不溶于水才会出沉淀
例如向碳酸钠饱和溶液中通入二氧化碳,就会析出碳酸氢钠沉淀,方程式为
Na2CO3+CO2+H2O=2NaHCO3↓
高中阶段课本没有说过可沉淀的酸式盐,但是习题中出现过,磷酸一氢钙,即Ca(HPO4)2是沉淀,不溶于水,所以磷的肥料不能与碱性肥料,如氨水一同使用,而磷酸二氢钙和碳酸氢钠也是如此。只是溶解度较低,未达到不溶于水的地步,属于可溶物。
PS:附上碳酸氢钠的溶解度:碳酸氢钠的溶解度为:9.6g(20℃)、11.1g(30℃)
谣言
谣言:一元酸不能形成酸式盐。
谣言来源:
《如何比较酸式盐及其相应的正盐》
《简单介绍酸式盐的形成和与酸、碱、盐的反应规律》
《浅析酸式盐的形成、性质及反应规律》
以上三篇文献存在科学性误区,
给出的所谓酸式盐的定义不可信驳斥:即使是一元酸,其酸式形体也可以与酸根缔合,从而形成酸式盐。
文献指出,醋酸钠能溶于醋酸,与醋酸分子结合形成醋酸酸式盐即双乙酸钠。而在双乙酸钠晶体中不存在相对独立的乙酸和乙酸钠分子;双乙酸钠分子内的羰基和羟基氢原子可形成氢键(O—H…O),其H原子位于2个O原子连线的正中间,属于结构化学中极罕见的“对称氢键”。
二 : 酸式盐的定义
酸式盐 -定义 电离时生成的阳离子除金属离子【或NH4+(有金属离子性质)】外还有氢离子,阴离子为酸根离子的盐。
酸碱性判断

酸式盐结构①水溶液呈酸性的酸式盐
强碱强酸的酸式盐:如NaHSO4,在其水溶液中发生完全电离,因此溶液呈酸性;
强酸弱碱的酸式盐:强酸和弱碱生成的盐:如NH4HSO4,溶液呈酸性。(溶液显酸性是由于NH4+水解,离子方程:NH4++H2O=NH3·H2O+H+)
②水溶液呈碱性的酸式盐:
一般为强碱弱酸的酸式盐,如:HPO4-盐,HCO3--盐,HS--盐,因“电离”趋势小于“水解”趋势,所以溶液呈碱性。
酸式盐热稳定性一般为正盐热稳定性大于酸式盐热稳定性。
Na2CO3受热不易分解,2NaHCO3=Na2CO3+CO2↑+H2O条件加热
CaCO3=CaO+CO2↑,(条件高温)Ca(HCO3)2=CaCO3+CO2↑+H2O(条件加热)
与酸碱反应弱酸的酸式盐,既能与碱反应,又能与酸反应。
NaHCO3:NaHCO3+NaOH=Na2CO3+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O
水解程度对比强碱弱酸的酸式盐水解程度小于强碱弱酸的正盐水解程度。如NaHCO3和Na2CO3
NaHCO3水解只有一步:HCO3-+H2O=H2CO3+OH-,[OH-]>[H+]
显然,两种相同浓度的溶液其碱性:NaHCO3<Na2CO3[1]
三 : 酸式盐的含义?
酸式盐的含义?
酸式盐的含义?的参考答案
酸式盐就是指电离时生成的阳离子除了金属离子(或氨根离子)、阴离子外,还会生成氢离子,比如碳酸氢钙.相对应的还有碱式盐,比如碱式碳酸铜(铜绿).
本文标题:
酸式盐的定义-酸式盐:酸式盐-定义,酸式盐-性质 本文地址:
http://www.61k.com/1094011.html 

 酸式盐结构①水溶液呈酸性的酸式盐
酸式盐结构①水溶液呈酸性的酸式盐