一 : 胆矾.明矾主要成分的化学式?求解中……
胆矾.明矾主要成分的化学式?求解中……
胆矾和明矾都是硫酸铜晶体的俗称。化学式为CuSO4,5H2O
二 : 带矾的俗名分别是什么物质?如明矾[KAl(SO)4]
问题补充:还有其他,具体点
1价金属硫酸盐和3价金属硫酸盐结合生成具有通式为X2SO4·Y2(SO4)3·24H2O或XY(SO4)2·12H2O的复盐(X为1价金属离子,Y为3价金属离子),总称为矾。——定义。
(www.61k.com)容易形成矾的1价金属有Li、Na、K、Rb、Cs、NH4+等。3价金属有Al、Cr、Fe、Mn等。
常遇到的矾有:
明矾K2SO4·Al2(SO4)3·24H2O或KAl(SO4)2·12H2O
铵铁矾(NH4)2SO4·Fe2(SO4)3·24H2O或NH4Fe(SO4)2·12H2O
钾铬钒K2SO4·Cr2(SO4)3·24H2O或KCr(SO4)2·12H2O
如果是要写在考卷上的,那么可以是这样:
1价金属硫酸盐和3价金属硫酸盐结合生成的复盐。
矾的另外一种定义为:各种金属(如铜、铁、锌)的硫酸盐,尤指具有玻璃质状态表面或光泽的该种硫酸盐的水合物,例如:
FeSO4·7H2O(绿矾、青矾,黑矾)
CuSO4·5H2O称为胆矾,蓝矾,或石胆
ZnSO4·7H2O称为皓矾
石矾又叫皓矾ZnSO4·7H2O;明矾是十二水硫酸铝钾。
其他矾类俗名
FeSO4·7H2O(绿矾、青矾,黑矾)
CuSO4·5H2O称为胆矾,蓝矾,或石胆
ZnSO4·7H2O称为皓矾
明矾十二水合硫酸铝钾KAl(SO4)2.12H2O
十字石Fe(OH)2·(Al2SiO5)2
文石,石灰石,大理石CaCO3
方解石CaCO3
水晶SiO2
水玻璃Na2SiO3
火硝KNO3
贝状重晶石BaSO4
升汞HgCl2
石英SiO2
打火石SiO2
石灰CaO
石棉碳酸钙镁CaO3·MgO·4SiO2
石灰石CaCO3
石墨碳
甘汞Hg2Cl2
电石CaC2
生石灰CaO
生石膏CaSO4·2H2O
石灰乳Ca(OH)2
立德粉BaSO4与ZnS混和
汉白玉CaCO3为主
白玉刚玉红宝石Al2O3
白炭黑轻质SiO2
白矾ZnSO4·7H2O
次亚硫酸钠五水合硫代硫酸钠Na2S2O3·5H2O
芒硝、朴硝Na2SO4·10H2O
吐酒石半水合酒石酸氧锑钾K(SbO)C4H4O6·1/2H2O
朱砂HgS
冰晶石3NaF·AlF3
灰锰氧高锰酸钾
尖晶石MgO·Al2O3
吊白块
辰砂HgS
苏打Na2CO3
赤血盐K3Fe(CN)6
赤血盐钠Na3Fe(CN)6·H2O
赤铁矿Fe2O3
玛瑙SiO2
吸铁石Fe3O4
鸡血石Al2(Si4O10)(OH)2,珍贵红色的昌化石
鸡冠石、雄黄As2S2或As4S4
砒霜As2O3
重石钨酸钙CaWO4
重晶石BaSO4硫酸钡
钟乳石CaCO3
保险粉Na2S2O4
雷汞Hg(ONC)2雷酸汞
蓝矾CuSO4·5H2O
蒙脱石Al2(Si4O10)(OH)2·nH2O
硼砂Na2B4O7·10H2O
钡餐,重晶石:BaSO4
莫尔盐:(NH4)2SO4.FeSO4.6H2O
莹石:CaF2
光卤石:KCl.MgCl2.6H2O
黄铜矿:CuFeS2
矾土:Al2O3.H2O、Al2O3.3H2O和少量Fe2O3、SiO2
磁铁矿石:Fe3O4
赤铁矿石:Fe2O3
褐铁矿石:2Fe2O3.3H2O
菱铁矿石:Fe2CO3
镁铁矿石:Mg2SiO4
苏口铁:碳以片状石墨形式存在
白口铁:碳以FeC3形式存在
高岭石:Al2(Si2O5)(OH)4或(Al2O3.2SiO2.2H2O)
正长石:KAlSi3O8
石英:SiO2
硼砂:Na2B4O7.10H2O
脉石:SiO2
刚玉(蓝宝石.红宝石):天然产的无色氧化铝晶体
黄铁矿(愚人金):FeS2
炉甘石:ZnCO3
智利硝石:NaNO3
滑石:3MgO.4SiO2.H2O
大理石(方解石、石灰石):CaCO3
孔雀石:CuCO3.Cu(OH)2
白云石:MgCO3.CaCO3
冰晶石:Na3AlF6
高岭土:Al2O3.2SiO2.2H2O
锡石:SnO2
辉铜矿:Cu2S
钛白粉二氧化钛TiO2
胆矾五水合硫酸铜
高岭土二水合硅酸铝Al2O3·2SiO2·2H2O
莫尔盐(NH4)2SO4·FeSO4·6H2O
钻石C(金刚石)
铅丹Pb3O4
铁黑、氧化铁黑Fe3O4
祖母绿Be3Al2(Si6O18)
海波五水合硫代硫酸钠Na2S2O3·5H2O
桔铬黄碱式铬酸铅PbCrO4·PbO
陶土二水合硅酸铝Al2O3·2SiO2·2H2O
密陀僧PbO
萤石氟化钙CaF
黄铜矿CuFeS2
黄铁矿二硫化铁FeS2
硅灰石天然硅酸钙CaSiO3
硅胶硅藻土水合二氧化硅SiO2·nH2O
铬黄铬酸铅PbCrO4
铬绿三氧化二铬Cr2O3
黄血盐K4Fe(CN)6
铜绿Cu2(OH)2CO3
银粉Al粉(颜料),Ag粉(电气业)
铬红PbCrO4·PbO
铬黄PbCrO4
铬绿PbCrO4与Fe4Fe(CN)63混合而成的颜料
绿矾FeSO4·7H2O
硬石膏CaSO4
硝石、焰硝KNO3
雄黄As2S2或As4S4
锌铬黄ZnCrO4·Zn(OH)2
锌钡白BaSO4与ZnS的混合物
锌白、锌氧粉ZnO
普鲁士蓝Fe4[Fe(CN)6]3·nH2O
普鲁士红氧化铁Fe2O3
硝石硝酸钾
智利硝石NaNO3
滑石Mg3(Si4O10)(OH)2或3MgO·4SiO2·H2O
明矾KAl(SO4)2·12H2O
沸石、泡沸石亦称分子筛NaAlSi2O6·H2O
泡花碱、水玻璃Na2SiO3
青石CuSO4·5H2O
金粉由Cu与少量Zn、Al、Sn等制成的金色颜料
金刚砂碳化硅SiC
草碱K2CO3(不纯)
泻盐、泻利盐MgSO4·7H2O
白垩:CaCO3
石灰乳:Ca(OH)2
熟石灰:2CaSO4.H2O
足球烯:C60
铜绿:Cu2(OH)2CO3
纯碱(碱面):Na2CO3
王水:HCl,HNO3(3:1)
水玻璃(泡火碱):Na2SiO3
小苏打:NaHCO3
苏打:Na2CO3
大苏打(海波):Na2S2O3
盐卤:MgCl2.6H2O
雌黄:As2S3
雄黄:As4S4
朱砂:HgS
砒霜:As2O3
泻盐:MgSO4.7H2O
波尔多液:CuSO4+Ca(OH)2
钛白粉:TiO2
雌黄As2S3
漂白粉次氯酸钙Ca(ClO)2
翡翠硅酸铝钠NaAlSi2O6
镉红CdS与CdSe
镉黄CdS与BaSO4
燧石SiO2
熟石灰氢氧化钙Ca(OH)2
熟石膏CaSO4·1/2H2O
膨润土Al2O3·4SiO2·H2O
雕百块水合甲醛次硫酸氢钠NaHSO2·CH2O·H2O
霰石CaCO3
白金铂Pt
芒硝十水合硫酸钠NaSO4.10H2O
泻盐七水合硫酸镁MgSO4.7H2O
生石膏二水合硫酸钙CaSO4.2H2O
熟石膏一水合二硫酸钙2CaSO4.H2O
干冰固态CO2
大苏打Na2S2O3·5H2O
小苏打NaHCO3
王水1:3的浓硝酸和浓盐酸
水银汞Hg
火碱NaOH
气黑C,由天然气制的炭黑
双氧水H2O2
水煤气氢+一氧化碳
白磷P4
发烟硫酸含游离SO3的硫酸
灯黑C,由重油等制成的碳黑
纯碱无水碳酸钠
苛性钠NaOH
苛性钾KOH
波尔多液碱式硫酸铜+水Cu(OH)2·CuSO4+H2O
洗涤碱Na2CO3·10H2O
食盐NaCl
炭黑C
消石灰Ca(OH)2
烧碱NaOH
铂黑极细的铂粉
笑气一氧化二氮N2O
黑火药硝石(75%)硫(10%)木炭(15%)的混合物
三、气体类:
1.高炉煤气:CO,CO2等混合气体
2.水煤气CO,H2
3.天然气(沼气):CH4
4.液化石油气:C3H8,C4H10为主
5.焦炉气:CH4,CO,H2,C2H4为主
6.裂解气:C2H4为主
7.爆鸣气:H2和O2
8.笑气:N2O
9.裂化气:C1~C4的烷烃、烯烃
10.电石气:C2H2(通常含H2S、PH3等)
四、有机类:
1.福马林(蚁醛):HCHO
2.蚁酸:HCOOH
3.尿素:(NH4CNO)或CO(NH2)2
4.氯仿:CCl4
5.木精(工业酒精):CH3OH
6.甘油:CH2OH-CHOH-CH2OH
7.硬脂酸:C17H35COOH
8.软脂酸:C15H31COOH
9.油酸:C17H33OH
10.肥皂:C17H35COONa
11.银氨溶液:[Ag(NH3)2]+
12.乳酸:CH3-CHOH-COOH
13.葡萄糖:C6H12O6
14.蔗糖:C12H22O11
15.核糖:CH2OH-(CHOH)3CHO
16.脱氧核糖:CH2OH-(CHOH)2CH2-CH3
17.淀粉:(C6H10O5)n
18.火棉,胶棉:主要成份都是[(C6H7O2)-(ONO2)3]n只是前者含N量高
19.尿素:CO(NH2)2NH4CNO为氰酸铵.(互为同分异构体)
20.氯仿:CHCl3
21.油酸:C17H33COOH
22.银氨溶液:[Ag(NH3)2]OH
23.脱氧核糖:CH2OH-(CHOH)2CH2-CHO
五、其他类:
许多物质从水溶液里析出晶体时,晶体里常含有一定数目的水分子,这样的水分子叫做结晶水。含有结晶水的物质叫做结晶水合物。
结晶水合物里的水分子属于结晶水合物化学固定组成的一部分。
水合物含一定量水分子的固体化合物。水合物中的水是以确定的量存在的,例如天水硫酸铜CuSO4的水合物的组成为CuSO4·5H2O。水合物中的水有几种不同的结合方式:一种是作为配体,配位在金属离子上,称为配位结晶水;另一种则结合在阴离子上,称为阴离子结晶水。例如CuSO4·5H2O加热到113℃时,只失去四分子水。只有加热到258℃以上,才能脱去最后一分子水。由此可见,4个水分子是作为配体配位在铜离子上的,即[Cu(H2O)4]2+;另一个水分子则结合在硫酸根上。一般认为,一个水分子通过氢键与中的氧原子相连接的。CuSO4·5H2O按水分子的结合方式,其结构式可写成[Cu(H2O)]4][SO4(H2O)]。许多其他水合硫酸盐晶体如FeSO4·7H2O、NiSO4·7H2O、ZnSO4·7H2O等,均有相同的结合方式。
在过渡金属的水合物中,相同组成的水合物往往由于其中的水分子的结合方式不同而使其性质发生变化。例如无水三氯化铬呈红紫色;其水合物为暗绿色晶体,实验式为CrCl3·6H2O。经实验证明,6个水分子中只有4个水分子和2个氯离子作为配体与铬离子结合在内界〔Cr(H2O)4Cl2]+,不论在晶态或在水溶液中均稳定存在,因此,这种水合物的结构式可写成[Cr(H2O)4Cl2]Cl·2H2O。如将暗绿色晶体的溶液冷却至0℃以下并通入氯化氢气体,则析出紫色晶体,其结构式为[Cr(H2O)6]Cl3。将紫色晶体的溶液用乙醚处理并通以氯化氢气体,就析出一种淡绿色晶体,其结构式为〔Cr(H2O)5Cl]Cl2·H2O。
水也可以不直接与阳离子或阴离子结合而依一定比例存在于晶体内,在晶格中占据一定的部位。这种结合形式的水称为晶格水,一般含有12个水分子。有些晶形化合物也含水,但无一定比例。例如沸石和其他硅酸盐矿物。一些难溶的金属氢氧化物实际上也是水合物。
三 : 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂
| 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: |
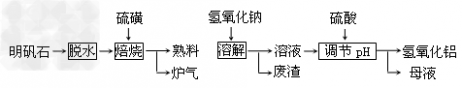 |
| 回答下列问题: (1)“焙烧”过程中发生的反应为2Al2(SO4)3+3S  2Al2O3+9SO2,其中氧化剂为__________。 2Al2O3+9SO2,其中氧化剂为__________。 (2)“溶解”时反应的离子方程式为___________。 (3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是__________。 (4)调节pH时使用的是质量浓度(单位体积溶液所含溶质的质量)为882g/L的H2SO4,配制1L该溶液,需用量筒量取质量分数为98﹪的硫酸(密度是1.8g/cm3)__________mL (5)“废渣”、“母液”中可回收的物质分别是______________。 |
| (1)Al2(SO4)3 (2)Al2O3+2OH-=2AlO2-+H2O (3)取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。 (4)500.0 mL (5)Fe2O3 、K2SO4、Na2SO4 |
考点:
考点名称:工业生产其他物质(工业制备碳酸锂,硫酸钡等化工原理)化工生产过程中的基本问题:硫代硫酸钠的工业制法:
(1)亚硫酸钠
将纯碱溶解后,与(硫磺燃烧生成的)二氧化硫作用生成亚硫酸钠,再加入硫磺沸腾反应,经过滤、浓缩、结晶,制得硫代硫酸钠。
Na2CO3+SO2==Na2SO3+CO2Na2SO3+S+5H2O==Na2S2O3·5H2O
(2)硫化碱法
利用硫化碱蒸发残渣、硫化钡废水中的碳酸钠和硫化钠与硫磺废气中的二氧化硫反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2
(3)氧化、亚硫酸钠和重结晶法
由含硫化钠、亚硫酸钠和烧碱的液体经加硫、氧化;亚硫酸氢钠经加硫及粗制硫代硫酸钠重结晶三者所得硫代硫酸钠混合、浓缩、结晶,制得硫代硫酸钠。
2Na2S+2S+3O2==2Na2S2O3Na2SO3+S==Na2S2O3
(4)重结晶法
将粗制硫代硫酸钠晶体溶解(或用粗制硫代硫酸钠溶液),经除杂,浓缩、结晶,制得硫代硫酸钠。
砷碱法净化气体副产 利用焦炉煤气砷碱法脱硫过程中的下脚(含Na2S2O3),经吸滤、浓缩、结晶后,制得硫代硫酸钠。
高锰酸钾的工业制法:
工业上利用二氧化锰制备高锰酸钾,其步骤是
(1)二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2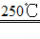 2K2MnO4+2H2O
2K2MnO4+2H2O
(2)电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH
2KMnO4+H2↑+2KOH
高锰酸钾常见的制备方法有以下两矿石中取得的二氧化锰和氢氧化钾在空气中或混合硝酸钾(提供氧气)加热,产生锰酸钾,再于碱性溶液中与氧化剂进行电解氧化得到高锰酸钾。 2MnO2+4KOH+O2→2K2MnO4+2H2O 2K2MnO4+Cl2→2KMnO4+2KCl
也可以用MnSO4在酸性环境中和二氧化铅(PbO2)或铋酸钠(NaBiO3)等强氧化剂反应产生。此反应也用于检验二价锰离子的存在,因为高锰酸钾的颜色明显种:
①法一:以MnO2(软锰矿)为原料制KMnO4
第一步:Mn(IV)→Mn(VI) 2MnO2+4KOH+O2====2K2MnO4+2H2O
第二步:CO2歧化K2MnO4K2MnO4+2CO2====2KMnO4+MnO2+2K2CO3
这种制备方法的最高产率为66.7% 法
②电解法:阳极:2MnO42--2e-→2MnO4- 阴极:2H2O+2e-→H2↑+2OH-总电解反应方程式为2K2MnO4+2H2O→2KMnO4+2KOH+H2↑
理论产率可达100%
纯硅的制取:
工业上在电炉内,用硅石和碳反应得粗硅和一氧化碳,然后用粗硅和氯气反应得四氯化硅,再用四氯化硅和氢气反应的纯硅和氯化氢,这样就完成硅的制造。(第一步完全相同,第二部有三种方法,工业上用的的是西门子的方法,其他两种不常见。)反应方程式
(1)石英制硅(冶金级),这一步是粗硅制取硅商业上是由高纯度的石英砂和木头,焦炭和煤使用碳棒电极在电弧炉中制得。在高于1900°C的温度下,依照下列方程式碳把石英砂还原成硅: SiO2+C→Si+CO2. SiO2+2C→Si+2CO. 这一过程所的硅称为冶金级硅。纯度为98%-99%。另外,硅制备办法还有熔盐电解法,即电解熔解的二氧化硅。
(2)高纯硅的制备在制备高纯硅之前,需要把粗硅转化成三氯化氢硅(300°C): Si+3HCl→HSiCl3+H2接着,通过精馏使SiHCl3与其它氯化物分离,经过精馏的SiHCl3,其杂质水平可低于10-10%的电子级硅要求。然后,提纯后的SiHCl3通过CVD原理在1150°C下制备出多晶硅粉。2HSiCl3→Si+2HCl+SiCl4.
常见的氧化剂及对应的还原产物:
氧化剂 | 还原产物 |
| Cl2、ClO- | Cl- |
| KMnO4(H+)、MnO2 | Mn2+ |
| HNO3 | NOx、N2、NH4+ |
| 浓H2SO4 | SO2 |
| Ag+、Fe3+ | Ag、Fe2+ |
| H2O2 | H2O |
常见的还原剂及对应的氧化产物:
还原剂 | 氧化产物 |
Na、K等金属单质 | Na+、K+ |
某些非金属C、S | CO2、SO2 |
非金属的氢化物CH4、H2S、NH3等 | CO2、S/SO2、NO |
某些低价态的氧化物CO、SO2 | CO2、SO3 |
某些低价态的酸或盐H2SO3、Na2SO3等 | SO42- |
某些低价态的阳离子Fe2+ | Fe3+ |
H2O2 | O2 |
易错易混点:
(1)金属单质只具有还原性,金属最高价阳离子只具有氧化性,处于中间价态的物质既有氧化性,又有还原性;
(2)非金属单质常作氧化剂,某些非金属单质也是较强的还原性物质,比如H2、C等等
(3)元素化合价的变化:
①元素最低价只有还原性,最高价只有氧化性,中间价态既有氧化性又有还原性
②同一元素在反应中化合价发生变化,只能接近不能交叉。
例如: 
氢氧化铝的性质:
不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;既能与酸反应,又能与碱反应。
(1)与酸反应:Al(OH)3+3H+==Al3++3H2O
(2)与碱反应:Al(OH)3+OH-==AlO2-+2H2O
氢氧化铝的性质:
氢氧化铝是一种白色不溶于水的胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。氢氧化铝既能与强酸反应也能与强碱反应,是两性氢氧化物。氢氧化铝是医用的胃酸中和剂的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,是胃液酸度降低,起到中和过多胃酸的作用。氢氧化铝受热是分解成氧化铝和水。2Al(OH)3=(加热)=Al2O3+3H2O氢氧化铝的制备:
实验室制法:Al2(SO4)3+6NH3·H2O==(NH4)2SO4+Al(OH)3↓
其他制法:①AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
②2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
③AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
④3AlO2-+Al3++6H2O==4Al(OH)3↓
例题:用稀H2SO4、NaOH溶液和金属铝为原料制取Al(OH)3。
甲、乙、丙三个学生的制备途径分别是
甲: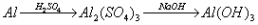
乙: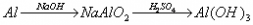
丙: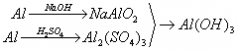
若要得到等量的Al(OH)3,则( B )
A.三者消耗的原料相同 B.甲消耗的原料的总物质的量最多 C.乙消耗的原料的总物质的量最少 D.丙消耗的原料的总物质的量最多
有关Al(OH)3的计算及图象分析:
解答有关Al(OH)3的图象和计算问题要注意以下三点:
(1)“铝三角”关系图中各物质转化方程式中的化学计量数关系。
(2)铝元素的存在形式。
(3)图象分析时:首先要看清横、纵坐标的含义,其次要对图象进行全面的分析,尤其需要关注的是特殊点(起点、折点、顶点、终点)的含义。
1、铝盐与强碱溶液作用生成Al(OH)3沉淀的计算
反应关系如下:
(1)Al3++3OH-==Al(OH)3(生成沉淀)
(2)Al(OH)3+OH-==AlO2-+2H2O(沉淀溶解)
(3)Al3++4OH-==AlO2-+2H2O(生成沉淀,又恰好溶解)
分析以上三个化学反应方程式,所得Al(OH)3沉淀的物质的量与n(Al3+)、n(OH-)的关系为:
当 ≤3时,所得沉淀的物质的量:n[Al(OH)3]=
≤3时,所得沉淀的物质的量:n[Al(OH)3]=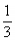 n(OH-)
n(OH-)
当 ≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
≥4时,所得沉淀的物质的量:n[Al(OH)3]=0
当3< <4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)
<4时,所得沉淀的物质的量:n[Al(OH)3]=4n(Al3+)-n(OH-)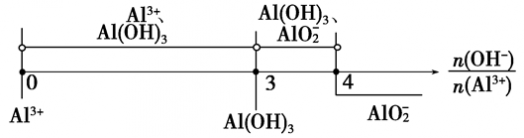
2、有关Al(OH)3的图像分析
①向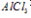 溶液中滴加
溶液中滴加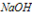 溶液
溶液
O~A段: 
A~B段: 
②向强碱溶液中滴入铝盐溶液 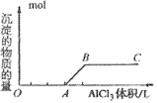
O~A段: 
A~B段: 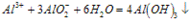
③向铝盐溶液中滴入氨水或向氨水中滴加铝盐溶液
A. 向铝盐中滴加氨水时,当氨水增加到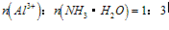 时,产生最大沉淀量
时,产生最大沉淀量
B. 向氨水中滴加铝盐溶液时,开始时氨水过量,如图所示 

分析得:氢氧化铝不溶于弱碱氨水中。
④向偏铝酸盐溶液中滴入强酸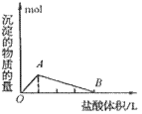
O~A段: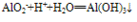
O~B段: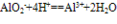
⑤向盐酸中滴加偏铝酸盐溶液 
O~A段: 
A~B段: 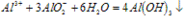
方法与技巧:
利用互滴顺序不同,现象不同可检验的溶液 AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
AlO2-与HCO3-的反应不属于水解相互促进的反应,而是HCO3-电离出的H+与AlO2-发生的反应:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-  本文标题:明矾的化学成分是什么-胆矾.明矾主要成分的化学式?求解中……
本文标题:明矾的化学成分是什么-胆矾.明矾主要成分的化学式?求解中…… 61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1