一 : 聚合硫酸铁,液体聚合硫酸铁
液态硫酸聚铁的制备工艺研究
蹇友纯 20104034058
一、综述
聚合硫酸铁是一种新型无机高分子絮凝剂,广泛用于各种工业污水的混凝净化处理。本文采用直接氧化法制备液态硫酸聚铁,考察了氧化剂用量,氧化温度,浓硫酸用量,氧化剂加入速度,反应时间和产品稳定性等因素对聚合硫酸铁合成的影响, 并制备出产品质量稳定,总铁含量和盐基度均符合行业标准和国家标准的产品。
关键词:聚合硫酸铁;盐基度;絮凝性
1.1 聚合硫酸铁的性质
铁盐和铝盐都是传统无机盐类絮凝剂, 具有相似的水解,聚合行为。对铁盐水解过程的研究表明,铁离子的稳定溶胶也能通过加碱方式制备。日本三上八州家等研究开发了聚合硫酸铁(PFS),于1974年申请了首个专利,20世纪80年代在水处理中得到广泛应用,取得了良好的效果[1]。PFS是在硫酸铁分子族的网状结构中插入羟基后形成的一种无机高分子絮凝剂,可有效去除水中的悬浮物、有机物、硫化物、亚硝酸盐、胶体及金属离子。PFS具有除臭、破乳及污泥脱水等功能,对浮游微生物也有较好的去除作用。PFS处理含油污水的效果远比硫酸亚铁显著, 且对金属设备的腐蚀性较小,但产生的污泥量较多、出水带色。
因聚合硫酸铁在水中水解后可产生多种高价的多核铁离子,对水中悬浮物胶体颗粒进行电中和,降低ζ电位,使水中胶体颗粒脱稳而相互凝聚,同时产生吸附、架桥交联等作用。因聚合硫酸铁的混凝性能优良,形成的矾花粗大密实,沉降速度较聚合氯化铝要快,出水浊度低,对BOD的去除率高达90%以上,不含铝、氯及其他杂质离子等有害物质。Qybkscl聚合硫酸铁适用的源水PH值范围宽4-11,最佳效用PH值为6-9。聚合硫酸铁对低温高浊水的净化效果尤佳。相关国家标准GB14591—2006。
聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁,其分子式一般可表示为
[Fe2(OH)n(S04)3- n/2]m[2]。它是硫酸铁在水解一絮凝过程中的一个中间产物。液体聚合硫酸铁本身含有大量的聚合阳离子,如[Fe3(0H)4]5+、[Fe6(OH)12]6+、
[Fe4(OH)4]6+,其在水溶液中存在着[Fe(H20)6]3+、[Fe2(H20)3]3+、[Fe(H20)2]3+等。聚合硫酸铁作为一种新型无机高分子絮凝剂,聚合硫酸铁同传统的无机盐类混凝剂相比,有以下优点:
(1)絮粒(絮凝体)形成速度快,颗粒密实,比重大,沉降速度快。
(2)对于各种废水中的CoD、BoD、色度及重金属均有良好的去除效果。
(3)絮粒(絮凝体)同微生物的结合能力强,因而对浮游生物等微生物有良好的去除效果。
(4)在应用过程中,原水水温及pH值适应范围较广。
(5)能降低出水中亚硝氮及铁的含量。
因具有优越的净水性能倍受水处理界的青睐,已广泛应用于各种工业废水和城市污水处理。相比传统的铝系絮凝剂而言,PFS 在反应过程中无离子水相转移和残留积累,使用更方便、价格更便宜、用量更省。但现在工业上催化氧化生产PFS,由于技术落后、设备简陋,污染大。研究表明:优化制备工艺条件,并且研究出一种成本低廉的聚合硫酸铁生产工艺有广泛的应用前景[3] 。
1.2 国内外生产聚合硫酸铁的制备方法
聚合硫酸铁的制备主要有直接氧化法法和催化氧化法[4]。大多数PFS的制备采用直接氧化法,此法工艺路线较简单,用于工业生产可以减少设备投资和生产环节,降低设备成本,但这种生产工艺必须依赖于氧化剂,如:H2O2、KClO3、HNO3等无机氧化剂。催化氧化法一般是选用一种催化剂,利用氧气或空气氧化制备聚合硫酸铁。以下是制备聚合硫酸铁的具体操作方法[5,6,7,8,9]:
(1)双氧水氧化法:双氧水(H2O2)在酸性环境中是一种强氧化剂,可以将亚铁氧化成三价铁从而制得聚合硫酸铁:
2FeSO4 + H2O2 + (1-n/2)H2SO4—→Fe2(OH)n(SO4) 3-n/2 + (2-n)H2O
制备过程中,按照生产量和所需要的盐基度,在反应釜中加入硫酸亚铁、水和硫酸混合,当温度升高到30~45℃时,在搅拌过程中,通过加料管在釜底缓慢加入H2O2。H2O2很快将亚铁氧化成三价铁,取样分析待亚铁浓度降至规定浓度时,停止反应。
利用本法生产聚合硫酸铁,具有设备简单、生产周期短、反应不用催化剂、产品不含杂质、稳定性高等特点。但反应过程中, 有H2O2在分解时形成O2气放出在无催化剂时,起不到氧化作用。要减少O2的产生,需要控制H2O2的投加速度制备工艺为间歇式操作,影响生产效率。H2O2成本比较高,它增加了聚合硫酸铁的生产成本,不利于工业化生产。
(2)氯酸钾(钠)氧化法:氯酸钾是广泛应用于炸药和火柴工业的强氧化剂,同样可以将亚铁氧化成三价铁:
6FeSO4 + KClO3 + 3(1-n/2)H2SO4 —→ 3?Fe2(OH)n(SO4) 3-n/2? + 3(1-n)H2O + KCl 制备时,将硫酸、硫酸亚铁和水按比例加入反应釜中,在常温或稍微高温度下,搅拌中加入氯酸钾。检验亚铁离子减少到规定浓度即可结束。
该法生产工艺简单,设备投资少,产品稳定性好,反应效率高,无空气污染。产品中含有氯酸盐,可兼作混凝与杀菌剂。但制品中残留有较高的氯离子和氯酸根离子,不宜于饮用水处理。同时,由于氯酸钾价格昂贵,产品成本高。
(3)次氯酸钠氧化法:次氯酸钠属于碱性氧化剂,其氧化还原电位较高,理论上能将亚铁氧化成三价铁:
2NaClO + 2H2SO4—→K2SO4 + 2H2O + Cl2
生产的氯气仍为氧化剂,可以将亚铁氧化成三价铁。但氯气会有少量以气体形式逸出而浪费掉,不能充分利用。同时也会造成环境污染,曾加后处理工序。次氯酸钠是碱性氧化剂,制备聚合硫酸铁时,为了降低pH值, H2SO4的用量较高。用该法制备的聚合硫酸铁稳定性差,不宜长期保存。
(4)硝酸氧化法:硝酸为中强氧化剂,与亚铁反应如下:
FeSO4 +HNO3 —→ Fe(OH)SO4 + NO2
反应生成的NO2又可以起到氧化作用,因而HNO3的氧化效率高。
该法是以工业硫酸亚铁为原料,采用工业硫酸氧化后以工业浓硝酸氧化。FeSO4:HNO3为1:(0.20~0.30):(0.10~0.32),加入水量小于以上三者总量的20%,于0.1~0.2MPa下,搅拌中通入充足的空气或氧气,于50~70℃氧化,102~103℃水解聚合而成。反映周期控制在30~60min以内。
用HNO3氧化时,成本比较低,反应周期短。所得产品浓度高,易于制成固体产品。若选用工业一级品原料,所得产品可用于饮用水处理。但反应中生成的NO2,会造成环境污染,需增加专门吸收装置予以处理。
综上所述,直接氧化法虽然工艺简单,操作简便,但存在氧化剂用量大,成本高,氧化剂引入的离子需分离出去,反应中产生的有害气体需专门设备吸收处理等问题,因而难于在工业化生产中普及和应用。但实验研究中需要少量的聚合硫酸铁时采用此类方法制备简单易行。
(5)催化氧化法:聚合硫酸铁在工业生产中多采用催化氧化法。即以硫酸亚铁及硫酸为原料,借助催化剂(NaNO2)的作用,利用氧化剂使硫酸亚铁在酸性介质中被氧化成三价铁离子。然后用氢氧化钠中和,调整碱化度进行水解,聚合反应制得聚合硫酸铁。其制备原理如下:
(1)催化氧化反应(慢反应):
2FeSO4 + (1/2)O2 + H2SO4—→ Fe2(SO4) 3 + H2O
(2)水解反应(快反应):
Fe2(SO4) 3+ H2O —→ Fe2(OH)n(SO4) 3-n/2 + (n/2) H2SO4
(3)聚合反应(快反应):
m[Fe2(OH)n(SO4) 3-n/2] —→[Fe2(OH)n(SO4) 3-n/2 ] m
其中:n?2,m?f(n)
2NO + O2 —→ 2NO2
2 FeSO4 + H2SO4 + NO2 —→ Fe2 (SO4 ) 3 + NO + H2O
Fe2(SO4) 3+ nNaOH —→ Fe2(OH)n(SO4) 3-n/2 + (n/2) Na2SO4
m[Fe2(OH)n(SO4) 3-n/2] —→[Fe2(OH)n(SO4) 3-n/2 ] m
副反应:
2NO2 + HO2 —→ HNO2 + NO
此法简单易行,但尚有不足之处。催化剂NaNO2是致癌物质,且生产过程中投加量大,产品中的亚硝酸根离子易超标,限制了其在饮用水处理中的应用;氮的氧化物排出,污染环境,后处理工序复杂;反应速率慢,要适应大规模工业化生产,需采用改进措施。为解决上述不足,不少研究者提出了许多有意义的改进方法,如加温加压,改善生产工艺,添加助催化剂,配以强力搅拌,寻找更为有效且无毒的催化剂等。采用催化法生产聚合硫酸铁,虽然已进入了工业化的阶段,但在改进工艺和设备,缩短反映时间,提高生产效率,降低生产成本和能耗等方面,仍有待科研工作者去进一步研究解决。
(6)氮氧化物催化氧化法:硫酸亚铁和硫酸为原料、硝酸为氧化剂的合成法与以硫酸亚铁、硫酸、氧气为原料, 硝酸为催化剂的合成法的反应机理是完全不同的[10]。前者是以液体硝酸为氧化剂,还原产物NO逸出溶液,不具有任何催化作用。这种方法的特点是硝酸用量大,Fe2+完全靠硝酸中的正五价氮氧化,属于液液反应。后者是以硝酸为催化剂,其特点是在硫酸、硫酸亚铁和水的混合液中加入少量的硝酸,还原产物NO再与O2反应,生成NO2,NO2再氧化Fe2+,如此循环,直至Fe2+被完全氧化为止。该方法是一种气液反应。最近,美国也有利用类似原理生产聚合硫酸铁的专利[11],其生产过程是在70~150℃,一定的压力、氮氧化物的催化作用下,用氧气将Fe2+氧化成Fe3+。
其生产过程是:将硫酸亚铁和硫酸的混合液喷入反应器,并保持反应液占反
应器总体积的1/3。溶液在喷射过程中,与气相中的NO、NO2和O2反应,最后生成聚合硫酸铁。经测定,溶液中含有大量大分子络合物。氧化反应生成的聚合硫酸铁中含有NOx,需将其送至脱氮器,并向脱氮器中充入氧,使脱出NOx的混合气体再循环到反应器使用。它们的区别在于,前者是将液体喷射雾化,,加强气体的吸收过程,提高反应速度。由于原料硫酸亚铁在生产和运输过程中往往混入杂质,这对聚合硫酸铁的生产设备提出了更高的要求。在采用填料塔法生产时,原料不经预处理可以直接用于生产。
另外,采用填料塔法生产,可以在较低的温度和常压下进行,具有安全方便的特点。氮氧化物在催化氧化过程中消耗很少,而且可以循环使用,这样既不会造成浪费,也不会带来污染问题。
(7)生物氧化法:生物氧化法是以硫铁矿为原料,引入混合菌种作为料液,在室温下通入空气作氧化剂,加入合适的营养物质,FeSO4在微生物作用下经氧化、水解、聚合反应得到生物聚合硫酸铁(BPFS)[12]。
硫铁矿主要成分是FeS2,先经过自然氧化为FeSO4:
2FeSO4 + 7O2 + 2H2O—→ 2FeSO4 + 2H2SO4
亚铁离子经氧化亚铁杆菌作用,生成三价铁离子:
2FeSO4 + O2 + H2SO4—→ Fe2(SO4) 3 + H2O
以后的FeS2靠Fe2(SO4) 3氧化成三价铁离子:
Fe2(SO4) 3 + FeS2 —→ 3FeSO4 + 2S
生产的硫磺经氧化硫酸杆菌作用转化为硫酸:
氧化硫酸杆菌
↓
2S+ H2O+ O2 —→H2SO4
这种方法生产PFS,所采用的原料来源广,生产设备简单,成本较低;无需高温高压和消毒催化剂,生产中无任何毒副作用。其不足之处是产品中亚铁离子含量较高,影响净水效果,此种工艺目前还未普遍使用。
(8)一步合成法:一步合成法是将双氧水、氯酸钾等氧化剂溶于碱性或中性含钾化合物中制成氧化剂溶液;在沸点温度下控制pH值,加热搅拌FeSO4悬浮液, 制成一定浓度的FeSO4溶液;将制备的氧化剂溶液加入到FeSO4溶液中,可制得粒径0.2~0.7nm的固体PFS[13]。
1.3 研究开发意义
聚合硫酸铁在水中能产生高效聚合铁络离子,与类似的其它净水剂相比,用量少、成本低、效果好。目前已广泛用于原水净化,污水处理,油水分离,废银回收,以及医药、制革、制糖、 酿酒等行业的废水净化处理,聚铁生产方法有磁铁矿法、硫酸亚铁法、废铁屑法、钢铁厂废酸法、硫酸厂硫铁矿渣法等[14]。南京油脂化工厂、武钢供水厂、成都化工三厂、鞍钢给排水公司、山东滕州净水剂厂等是主生产厂。近年国内对聚铁的研究开发取得很大进展 ,用硫铁矿渣为原料,用常压低温焙烧工艺制聚铁已成功;用钛白粉厂副产硫酸亚铁一步法制固体聚铁产品的新技术,是国家建设部、环保总局的重点科技推广成果。聚铁有强大市场竞争力,开发应用前景广阔[15]。
目前我国一般以副产绿矾为原料采用亚硝酸钠催化氧化生产PFS。生产液体PFS时,由于液体PFS铁含量低、黏度大、干燥温度低、干燥时间长,能耗大。因此,生产过程中应控制和消除污染,改进技术手段,降低能耗。开发新技术,研制新产品高效价廉的絮凝剂是使絮凝剂得以广泛应用的关键 ,它已成为我国“十五”水处理剂的发展规划[16,17]。研究生产PFS高新技术和及PFS新产品具有重要的意义。
本实验将采用直接氧化法制备液态聚合硫酸铁。液态聚合硫酸铁可以直接应用到水处理中,而且还减少了由液态干燥到固态所产生的能耗通。实验中,通过正交实验,研究出最佳制备工艺,以解决液态聚合硫酸铁铁含量低不稳定等问题。
二、实验部分
2.1 实验材料与仪器
2.1.1 实验药品(表1)
实验中所采用的药品与材料如表1所示。
表1 实验药品和材料
Table 1 Reagents and materials
实验药品
重铬酸钾
二苯胺磺酸钠
磷酸
氟化钠
氯酸钾
硫酸亚铁
规格 AR AR AR AR AR AR 生产厂家 长沙分路口塑料化工厂 长沙分路口塑料化工厂 天津市大茂化学试剂厂 天津市大茂化学试剂厂 上海山浦化工有限公司 株洲市化学工业研究所
盐酸
浓硫酸
氢氧化钠
2.1.2 主要仪器设备(表2) AR AR AR 湖南省株洲市化学工业研究所 国药集团化学试剂有限公司 上海山浦化工有限公司
表2 实验仪器和设备
Table 2 Apparatus and equipment
仪器、设备名称
FN121-2型鼓风干燥箱 生产厂家 长沙仪器仪表厂
组合恒温磁力搅拌器 山东省鄄城新科教学仪器厂 PHS-3C型精密pH计
分析天平
恒温水浴锅 海鹏顺科学仪器有限公司 梅特勒-托利多仪器上海有限公司 上海精宏实验设备有限公司
2.2 实验方法
2.2.1 液态聚合硫酸铁的制备
实验中按总SO42-:总Fe比例计算加入浓硫酸量。在烧杯中加入100ml水,再加入计算量浓硫酸配成稀溶液,加热到设计温度。再称取计算量的FeSO4·7H2O和KClO3(设计量)各分成24份,在搅拌下分别将2份FeSO4·7H2O和两份KClO3加入到上述烧杯中,搅拌10min继续加入1份FeSO4·7H2O和一份KClO3,以后每隔设计时间(2,5,8min)加1次,共计加料22次,投料结束后,继续搅拌10min,冷却即可。
2.2.2 PH值的测定
将洗净收干的电极插入待测溶液,测定PH值,所得结果应表示至一位小数,两次测定结果之差不大于0.2PH值单位取算术平均值为测定结果[18]。
2.2.3 盐基度测定
分析试样10ml于250ml锥形瓶中,取25ml0.1mol/L盐酸溶液,加入上述被测溶液中,在50度水浴中加热10分钟,流水冷却至室温,加入饱和氟化钠溶液70ml,再放置半小时后,过滤除去沉淀,用1.5%氟化钠溶液将沉淀物洗2—3次。然后在滤液中加3滴0.1%酚酞指示剂溶液,立即用0.1mol/L氢氧化钠标准溶液滴定至终点,同时作一空白平行试验对照[20]。
2.2.4 二价铁含量的测定
用10ml移液管吸取分析试样10ml于500ml锥形瓶中,加蒸馏水200ml稀释
之,加硫磷混酸溶液20至25ml,再加5滴二苯胺磺酸钠溶液作指示剂[21]。立即用0.1mol/L重铬酸钾标准溶液滴定由无色转变成绿色再成紫色即为终点,记下消耗毫升数。
2.2.5 密度测定
将适量的待测液体注入干燥清洁的250ml量筒中,搅拌均匀后,拿住密度计上端,使它轻轻浮在液中,切莫让液体粘附到露出部分,使密度计处于量筒中心悬浮,按弯月面上缘进行读数(眼睛与弯月面上缘平行)。
三、结果与讨论
3.1 工艺条件对盐基度的影响
3.1.1 聚合硫酸铁制备原理
制备聚合硫酸铁的含铁原料较为广泛,制备方法多种多样,可以废硫酸和铁屑为原料进行生产,其中以硫酸亚铁为原料的聚合硫酸铁不含重金属离子,可用于饮用水处理,其反应方程式如下:
氧化 6FeSO4 + KClO3 + 3H2SO4 —→ 3Fe2(SO4)3 + KCl + 3H2O
水解 Fe2(SO4)3 + nH2O —→ Fe2(OH)n(SO4)3- n/2 + n/2H2SO4
聚合 mFe2(OH)n(SO4)3- n/ 2 —→ [Fe2(OH)n(SO4)3- n/ 2]m
聚合硫酸铁的性能取决于总铁质量分数和盐基度,尤其是盐基度。盐基度越高,说明聚合度越大,混凝性能越好。制备时加硫酸有利于氧化反应的进行,可使Fe2+转化完全。溶液中的SO42-和 HSO4-形成缓冲体系能保持溶液pH值的相对稳定,SO42-向HSO4-转化也会促进Fe3+的水解。硫酸用量对产品的盐基度和总铁质量分数有很大影响,随着硫酸用量的增加,Fe2(SO4)3 的生成速率增加,有利于单体 Fe2(OH)n(SO4)3- n / 2的生成,提高了聚合反应速率,铁结合的羟基数增加,盐基度也随之增大[22]。但当硫酸用量增加到一定程度时,也会抑制水解反应的发生,不利于聚合反应,甚至使聚合硫酸铁发生分解,盐基度下降。氧化反应是不可逆过程,反应速度较快,而水解和聚合反应均为可逆过程。当氧化剂用量少时,Fe2(SO4)3 生成量少,不利于Fe2(OH)n(SO4)3- n / 2 的单体生成,因而盐基度小。
本实验研究了不同温度和物料配比条件下聚合硫酸铁的合成工艺[23] 。对制备的聚合硫酸铁进行质量检验和絮凝效果测试,从中得出制备聚合硫酸铁的最佳工艺条件。
3.1.2 物料比对聚合硫酸铁盐基度的影响
在常温下,当酸度值和氧化剂投入量都相同时,改变物料比能提高反应速率
并且能得到更高品质的聚合硫酸铁。当物料比(硫酸亚铁与硫酸的摩尔比)分别为:1/1.20,1/1.25,1/1.30,1/1.35,1/1.40,1/1.45,1/1.50时,聚合硫酸铁的盐基度B(%)为11.8,12.3,11.6,11.2,12.1,12.5,12.1,结果见图1。
由图1可见,当物料比为1/1.25和1/1.45时盐基度最高,实际生产中考虑到成本节约等问题,当投料比为1/1.45时,加入的硫酸亚铁过多,成本过高。综合考虑实际投料比为1/1.25左右最佳。
图1 物料比对盐基度的影响
Fig.1 The effect of material ratio on the basicity
3.1.3 温度对聚合硫酸铁盐基度的影响
对于大多数化学反应来说 ,当反应物浓度不变时,加热能提高反应速率。实验结果表明,在其他条件不变的情况下,当反应温度(℃)分别为30,35, 40,45,50 ,55,60和65时,聚合硫酸铁的盐基度B(%)分别为8.7,8.8,9.7, 10.2, 11.9, 13, 11.4和10.8。由此可知,聚合硫酸铁盐基度随反应温度的升高而升高,当反应温度升至55℃时,聚合硫酸铁的盐基度已达到较高水平,继续升温盐基度变化幅度不大。由于本实验为放热反应,若温度过高,一方面会引起氧化剂部分分解,为了达到同样的效果,必将增加氧化剂用量;另一方面,温度高也会使聚合硫酸铁发生分解产生沉淀,降低絮凝能力。综合考虑,反应温度控制为55℃左右较适宜。
图2 反应温度对盐基度的影响 Fig.2 The effect of temperature on the basicity
3.1.4 酸度对聚合硫酸铁盐基度的影响
在常温常压下,pH为 1.5,2.0, 2.5,3.0,3.5,4.0,其他因素相同情况下,聚合硫酸铁的盐基度分别为8.7,10.2,12.1,12.8,12.0,11.8,结果见图3。
由图3可知,随着pH的增大,盐基度呈下降趋势。原因是在水解过程中,氢氧根离子和硫酸根离子与铁离子的配合是竞争关系,SO42-少时,较多的氢氧根离子结合铁离子,使得产物盐基度较高,而硫酸根离子过量,生成物已经成为 Fe2(SO4)3,并非PFS。在保证产品质量合格及一定反应速度的前提下,浓 H2SO4的最佳用量为4.3mL, pH为2.5到3时,硫酸亚铁与硫酸的摩尔比为 1∶1.25,此时盐基度最高。
图3 pH对盐基度的影响
Fig.3 The effect of pH value on the the basicity
3.1.5 氧化剂加入速度对聚合硫酸铁盐基度的影响
氧化剂氯酸钾的加入速度直接影响反应效果,加入速度较慢,有利于物料的充分接触,但反应时间过长,加入太慢、太迟又易使 Fe2(SO4)3发生水解,产生沉淀,不利于工业化生产,实验过程中,尝试着加快加入速度,但使得还原性物质(以 Fe2+计)的含量明显增加,Fe2+的转化率无法达到国家标准,这是因为本反应是一个放热反应,加入速度过快,一则使得氯酸钾不能与物料充分接触,二则放热使温度升高,促使了氯酸钾的分解。故经过反复实验,认为控制在 2.5 h 之内连续均匀加入较好[25]。
3.1.6 氧化剂用量对聚合硫酸铁盐基度的影响
在常温常压下,加入定量的FeSO4?7H2O86g、浓H2SO4(98%)4mL、H2O100mL于烧瓶中,用慢慢加入3,6,9,12,14g不同量的KClO3,反应完后测其盐基度。结果见图4。
由于氯酸钾加入到硫酸亚铁溶液中,反应会放出大量的热,因此不可避免地要消耗一部分氯酸钾会分解。为此,氧化过程采用在低温下将过氧化氢慢慢地滴入,溶液的颜色逐渐加深。经过多次实验并由图3发现,当氯酸钾用量达6g,硫酸亚铁与氯酸钾的摩尔比为1:0.1时,生成的红棕色液体的颜色不再加深,说明Fe2+已基本被氧化,达到实验要求,继续增加氯酸钾用量,溶液体积增加,全铁含量降低。因此,选择硫酸亚铁与过氯酸钾的摩尔比为1:0.1。
图4 氧化剂对盐基度的影响
Fig.4 The effect of oxidants on the the basicity
3.1.7 聚合反应时间对聚合硫酸铁盐基度的影响
从图5可知,反应时间对聚合硫酸铁的合成有很大的影响,反应时间越短,则聚合反应不完全,产品的聚合度低,盐基度小;聚合度与絮凝效果的好坏有密切的关系,聚合度越大,其形成的矾花越大,絮凝效果越好[26]。但时间过长,盐基度反而略有下降,并且增加了生产成本。通过实验确定反应时间为2.5 h。
图5 反应时间对盐基度的影响
Fig.5 The effect of time on the basicity
3.1.8 聚合硫酸铁经过熟化后盐基度的变化
在上述各最佳条件下,将制得聚合硫酸铁静置熟化,当静置熟化时间(h)分别为0,24,48和72时,聚合硫酸铁的盐基度( %)分别为12.4,12.1,11.8,11.8和11.7由此可知,随着聚合硫酸铁静置熟化的时间越长,盐基度呈下降的趋势,但总体下降幅度不是很大;存放48h后,其盐基度已基本趋于稳定。
因此如图6,在分析聚合硫酸铁的盐基度时,反应结束就马上分析会造成结果略微偏高,存放48h后可基本达到稳定。这是由于水解聚合反应并非瞬间完成,在相当时间内,溶液均处于非平衡介稳状态。在此熟化期内,随着反应进行,水解产物形态组成也不断变化,溶液pH值也相应变化,因而出现盐基度随时间发生变化的现象。
图6 熟化时间对盐基度的影响
Fig.6 The e ffect of aging time on the basicity
四、小结
本实验采用氯酸钾直接氧化法制取聚合硫酸铁,工艺方法简单,生产周期短,反应条件温和。制得符合标准的产品所需反应的较佳条件如下:硫酸根离子浓度与三价铁离子浓度比值为1.25,硫酸亚铁与氯酸钾的摩尔比为1:0.1,反应温度55,反应时间为2.5h,反应2.5h,可获得较高盐基度,产品呈红褐色粘稠状液体,产品存放48h基本稳定。
参考文献
[1] 陈永泉,何小金,曹玉宇等.复合聚合硫酸铁反应动力学研究[J].能源环境保
护,2007,4(21):43-46.
[2] 刘长让,樊耀亭,刘相中,聚合硫酸铁的制备与应用[J].无机盐工业,2008,31(5):18-20.
[3] 张良佺,黄校华,余新峰等.助聚剂对聚合硫酸铁盐基度影响研究[J].化学反应工程与工
艺,2007,2(18):180-183.
[4] 劳服司,冉年海,李伯涵.聚合硫酸铁的开发[J].卢天化科技,2010,4:231-233.
[5] 陈明尧,吴华秀等.聚合硫酸铁的制备[J].化工时刊,2007,18(1):57-58
[6] 向群,聚合硫酸铁的制备[J].四川师范大学学报,2008,20(1):101-103.
[7] 诸爱士,吴盛林,倪文赋等.聚合硫酸铁改性研究[J].实验室研究与探
索,2006,2(23):12-14.
[8] 马忠英.我国混凝剂聚合硫酸铁生产技术发展现状[J].内蒙古石油化
工,2007,8:300-302.
[9] 潘碌亭,吴锦峰.聚合硫酸铁制备技术的研究与进展[J].工业水处理,2009,9(29):1-5.
[10] 周洪涛,李东,孟繁会,生物法制备聚合硫酸铁及盐基度对聚合硫酸铁性能的影响[J].
热电技术,2007,21(4):26-3.
[11] 武道吉,陈冬辰,李凤亭.国外制造聚合硫酸铁的新方法化[J].化工环
保,2008,5(17):277-280.
[12] 李微雅.聚合硫酸铁的合成与应用[J].印染助剂,2007,1(24):10-12.
[13] 许立国, 李凤亭,任晓红.聚合硫酸铁生产心方法[J].山东电力技
术,2009,1(87):55-57.
[14] 郑怀礼,童腾锐,袁宗宣.聚合硫酸铁制备方法研究及其发展[J].环境污染与治理技术
与设备,2008,1(5):21-28.
[15] 黄宝华,潘湛昌,余倩,张小琴,杨迟.聚合硫酸铁制备及其净水处理应用[J].城市环境
与城市生态,2007,16(6):226-227
[16] 张月仙.聚合硫酸铁制备研究[J].河北北方学院学报(自然科学
版),2009,1(21):11-13.
[17] 朱洪法.精细化工产品配方与制造[M].北京:金盾出版社,2009,136.
[18] 郭强,杨杰,司捷.一种聚合硫酸铁合成的新方法[J].企业科技与发展,2007,37.
[19] 洪金德,朱钰.影响聚合硫酸铁盐基度因素分析[J].华侨大学学报(自然科学
版),2006,4(26):415-417.
[20] 张清一,庞脆玲,欧阳欢.聚合硫酸铁合成及影响因素的研究[J].四川有色金
属,2007,4:53-56.
[21] 吴烈善,李楠,伍敏莉等.固体聚合硫酸铁制备及处理选矿废水的研究[J].广西大学学
报(自然科学版),2009,1(34):63-66.
[22] 郭薇薇,周锦,柳亚军.新型聚合硫酸铁的制备[J].甘肃科技,2006,4(22):41-43.
[23] 王汉道,李宗林,沙育定等.自制聚合硫酸铁处理高色度印染废水的实验研究[J].广东
轻工职业技术学院学报,2004,1(3):9-11.
[24] 周熊,郑永华.聚合硫酸铁的新型合成[J].胶体与聚合物,2006,1(24):31-32.
[25] 邹龙生,杨春华.直接氧化法制备改性聚合硫酸铁的工艺探讨[J].山东化
工,2007(36):30-35.
[26] 伦宁,李景国,王信东.聚合硫酸铁的制备及稳定性研究[J].山东化工,2010,(2):5-6.
二 : 聚合硫酸铁,液体聚合硫酸铁
液态硫酸聚铁的制备工艺研究
蹇友纯 20104034058
一、综述
聚合硫酸铁是一种新型无机高分子絮凝剂,广泛用于各种工业污水的混凝净化处理。[www.61k.com)本文采用直接氧化法制备液态硫酸聚铁,考察了氧化剂用量,氧化温度,浓硫酸用量,氧化剂加入速度,反应时间和产品稳定性等因素对聚合硫酸铁合成的影响, 并制备出产品质量稳定,总铁含量和盐基度均符合行业标准和国家标准的产品。
关键词:聚合硫酸铁;盐基度;絮凝性
1.1 聚合硫酸铁的性质
铁盐和铝盐都是传统无机盐类絮凝剂, 具有相似的水解,聚合行为。对铁盐水解过程的研究表明,铁离子的稳定溶胶也能通过加碱方式制备。日本三上八州家等研究开发了聚合硫酸铁(PFS),于1974年申请了首个专利,20世纪80年代在水处理中得到广泛应用,取得了良好的效果[1]。PFS是在硫酸铁分子族的网状结构中插入羟基后形成的一种无机高分子絮凝剂,可有效去除水中的悬浮物、有机物、硫化物、亚硝酸盐、胶体及金属离子。PFS具有除臭、破乳及污泥脱水等功能,对浮游微生物也有较好的去除作用。PFS处理含油污水的效果远比硫酸亚铁显著, 且对金属设备的腐蚀性较小,但产生的污泥量较多、出水带色。
因聚合硫酸铁在水中水解后可产生多种高价的多核铁离子,对水中悬浮物胶体颗粒进行电中和,降低ζ电位,使水中胶体颗粒脱稳而相互凝聚,同时产生吸附、架桥交联等作用。因聚合硫酸铁的混凝性能优良,形成的矾花粗大密实,沉降速度较聚合氯化铝要快,出水浊度低,对BOD的去除率高达90%以上,不含铝、氯及其他杂质离子等有害物质。Qybkscl聚合硫酸铁适用的源水PH值范围宽4-11,最佳效用PH值为6-9。聚合硫酸铁对低温高浊水的净化效果尤佳。相关国家标准GB14591—2006。
聚合硫酸铁(PFS)也称碱式硫酸铁或羟基硫酸铁,其分子式一般可表示为
[Fe2(OH)n(S04)3- n/2]m[2]。它是硫酸铁在水解一絮凝过程中的一个中间产物。液体聚合硫酸铁本身含有大量的聚合阳离子,如[Fe3(0H)4]5+、[Fe6(OH)12]6+、
[Fe4(OH)4]6+,其在水溶液中存在着[Fe(H20)6]3+、[Fe2(H20)3]3+、[Fe(H20)2]3+等。聚合硫酸铁作为一种新型无机高分子絮凝剂,聚合硫酸铁同传统的无机盐类混凝剂相比,有以下优点:
(1)絮粒(絮凝体)形成速度快,颗粒密实,比重大,沉降速度快。
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
(2)对于各种废水中的CoD、BoD、色度及重金属均有良好的去除效果。(www.61k.com)
(3)絮粒(絮凝体)同微生物的结合能力强,因而对浮游生物等微生物有良好的去除效果。
(4)在应用过程中,原水水温及pH值适应范围较广。
(5)能降低出水中亚硝氮及铁的含量。
因具有优越的净水性能倍受水处理界的青睐,已广泛应用于各种工业废水和城市污水处理。相比传统的铝系絮凝剂而言,PFS 在反应过程中无离子水相转移和残留积累,使用更方便、价格更便宜、用量更省。但现在工业上催化氧化生产PFS,由于技术落后、设备简陋,污染大。研究表明:优化制备工艺条件,并且研究出一种成本低廉的聚合硫酸铁生产工艺有广泛的应用前景[3] 。
1.2 国内外生产聚合硫酸铁的制备方法
聚合硫酸铁的制备主要有直接氧化法法和催化氧化法[4]。大多数PFS的制备采用直接氧化法,此法工艺路线较简单,用于工业生产可以减少设备投资和生产环节,降低设备成本,但这种生产工艺必须依赖于氧化剂,如:H2O2、KClO3、HNO3等无机氧化剂。催化氧化法一般是选用一种催化剂,利用氧气或空气氧化制备聚合硫酸铁。以下是制备聚合硫酸铁的具体操作方法[5,6,7,8,9]:
(1)双氧水氧化法:双氧水(H2O2)在酸性环境中是一种强氧化剂,可以将亚铁氧化成三价铁从而制得聚合硫酸铁:
2FeSO4 + H2O2 + (1-n/2)H2SO4—→Fe2(OH)n(SO4) 3-n/2 + (2-n)H2O
制备过程中,按照生产量和所需要的盐基度,在反应釜中加入硫酸亚铁、水和硫酸混合,当温度升高到30~45℃时,在搅拌过程中,通过加料管在釜底缓慢加入H2O2。H2O2很快将亚铁氧化成三价铁,取样分析待亚铁浓度降至规定浓度时,停止反应。
利用本法生产聚合硫酸铁,具有设备简单、生产周期短、反应不用催化剂、产品不含杂质、稳定性高等特点。但反应过程中, 有H2O2在分解时形成O2气放出在无催化剂时,起不到氧化作用。要减少O2的产生,需要控制H2O2的投加速度制备工艺为间歇式操作,影响生产效率。H2O2成本比较高,它增加了聚合硫酸铁的生产成本,不利于工业化生产。
(2)氯酸钾(钠)氧化法:氯酸钾是广泛应用于炸药和火柴工业的强氧化剂,同样可以将亚铁氧化成三价铁:
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
6FeSO4 + KClO3 + 3(1-n/2)H2SO4 —→ 3?Fe2(OH)n(SO4) 3-n/2? + 3(1-n)H2O + KCl 制备时,将硫酸、硫酸亚铁和水按比例加入反应釜中,在常温或稍微高温度下,搅拌中加入氯酸钾。(www.61k.com)检验亚铁离子减少到规定浓度即可结束。
该法生产工艺简单,设备投资少,产品稳定性好,反应效率高,无空气污染。产品中含有氯酸盐,可兼作混凝与杀菌剂。但制品中残留有较高的氯离子和氯酸根离子,不宜于饮用水处理。同时,由于氯酸钾价格昂贵,产品成本高。
(3)次氯酸钠氧化法:次氯酸钠属于碱性氧化剂,其氧化还原电位较高,理论上能将亚铁氧化成三价铁:
2NaClO + 2H2SO4—→K2SO4 + 2H2O + Cl2
生产的氯气仍为氧化剂,可以将亚铁氧化成三价铁。但氯气会有少量以气体形式逸出而浪费掉,不能充分利用。同时也会造成环境污染,曾加后处理工序。次氯酸钠是碱性氧化剂,制备聚合硫酸铁时,为了降低pH值, H2SO4的用量较高。用该法制备的聚合硫酸铁稳定性差,不宜长期保存。
(4)硝酸氧化法:硝酸为中强氧化剂,与亚铁反应如下:
FeSO4 +HNO3 —→ Fe(OH)SO4 + NO2
反应生成的NO2又可以起到氧化作用,因而HNO3的氧化效率高。
该法是以工业硫酸亚铁为原料,采用工业硫酸氧化后以工业浓硝酸氧化。FeSO4:HNO3为1:(0.20~0.30):(0.10~0.32),加入水量小于以上三者总量的20%,于0.1~0.2MPa下,搅拌中通入充足的空气或氧气,于50~70℃氧化,102~103℃水解聚合而成。反映周期控制在30~60min以内。
61阅读请您转载分享:
用HNO3氧化时,成本比较低,反应周期短。所得产品浓度高,易于制成固体产品。若选用工业一级品原料,所得产品可用于饮用水处理。但反应中生成的NO2,会造成环境污染,需增加专门吸收装置予以处理。
综上所述,直接氧化法虽然工艺简单,操作简便,但存在氧化剂用量大,成本高,氧化剂引入的离子需分离出去,反应中产生的有害气体需专门设备吸收处理等问题,因而难于在工业化生产中普及和应用。但实验研究中需要少量的聚合硫酸铁时采用此类方法制备简单易行。
(5)催化氧化法:聚合硫酸铁在工业生产中多采用催化氧化法。即以硫酸亚铁及硫酸为原料,借助催化剂(NaNO2)的作用,利用氧化剂使硫酸亚铁在酸性介质中被氧化成三价铁离子。然后用氢氧化钠中和,调整碱化度进行水解,聚合反应制得聚合硫酸铁。其制备原理如下:
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
(1)催化氧化反应(慢反应):
2FeSO4 + (1/2)O2 + H2SO4—→ Fe2(SO4) 3 + H2O
(2)水解反应(快反应):
Fe2(SO4) 3+ H2O —→ Fe2(OH)n(SO4) 3-n/2 + (n/2) H2SO4
(3)聚合反应(快反应):
m[Fe2(OH)n(SO4) 3-n/2] —→[Fe2(OH)n(SO4) 3-n/2 ] m
其中:n?2,m?f(n)
2NO + O2 —→ 2NO2
2 FeSO4 + H2SO4 + NO2 —→ Fe2 (SO4 ) 3 + NO + H2O
Fe2(SO4) 3+ nNaOH —→ Fe2(OH)n(SO4) 3-n/2 + (n/2) Na2SO4
m[Fe2(OH)n(SO4) 3-n/2] —→[Fe2(OH)n(SO4) 3-n/2 ] m
副反应:
2NO2 + HO2 —→ HNO2 + NO
此法简单易行,但尚有不足之处。(www.61k.com)催化剂NaNO2是致癌物质,且生产过程中投加量大,产品中的亚硝酸根离子易超标,限制了其在饮用水处理中的应用;氮的氧化物排出,污染环境,后处理工序复杂;反应速率慢,要适应大规模工业化生产,需采用改进措施。为解决上述不足,不少研究者提出了许多有意义的改进方法,如加温加压,改善生产工艺,添加助催化剂,配以强力搅拌,寻找更为有效且无毒的催化剂等。采用催化法生产聚合硫酸铁,虽然已进入了工业化的阶段,但在改进工艺和设备,缩短反映时间,提高生产效率,降低生产成本和能耗等方面,仍有待科研工作者去进一步研究解决。
(6)氮氧化物催化氧化法:硫酸亚铁和硫酸为原料、硝酸为氧化剂的合成法与以硫酸亚铁、硫酸、氧气为原料, 硝酸为催化剂的合成法的反应机理是完全不同的[10]。前者是以液体硝酸为氧化剂,还原产物NO逸出溶液,不具有任何催化作用。这种方法的特点是硝酸用量大,Fe2+完全靠硝酸中的正五价氮氧化,属于液液反应。后者是以硝酸为催化剂,其特点是在硫酸、硫酸亚铁和水的混合液中加入少量的硝酸,还原产物NO再与O2反应,生成NO2,NO2再氧化Fe2+,如此循环,直至Fe2+被完全氧化为止。该方法是一种气液反应。最近,美国也有利用类似原理生产聚合硫酸铁的专利[11],其生产过程是在70~150℃,一定的压力、氮氧化物的催化作用下,用氧气将Fe2+氧化成Fe3+。
其生产过程是:将硫酸亚铁和硫酸的混合液喷入反应器,并保持反应液占反
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
应器总体积的1/3。[www.61k.com]溶液在喷射过程中,与气相中的NO、NO2和O2反应,最后生成聚合硫酸铁。经测定,溶液中含有大量大分子络合物。氧化反应生成的聚合硫酸铁中含有NOx,需将其送至脱氮器,并向脱氮器中充入氧,使脱出NOx的混合气体再循环到反应器使用。它们的区别在于,前者是将液体喷射雾化,,加强气体的吸收过程,提高反应速度。由于原料硫酸亚铁在生产和运输过程中往往混入杂质,这对聚合硫酸铁的生产设备提出了更高的要求。在采用填料塔法生产时,原料不经预处理可以直接用于生产。
另外,采用填料塔法生产,可以在较低的温度和常压下进行,具有安全方便的特点。氮氧化物在催化氧化过程中消耗很少,而且可以循环使用,这样既不会造成浪费,也不会带来污染问题。
(7)生物氧化法:生物氧化法是以硫铁矿为原料,引入混合菌种作为料液,在室温下通入空气作氧化剂,加入合适的营养物质,FeSO4在微生物作用下经氧化、水解、聚合反应得到生物聚合硫酸铁(BPFS)[12]。
硫铁矿主要成分是FeS2,先经过自然氧化为FeSO4:
2FeSO4 + 7O2 + 2H2O—→ 2FeSO4 + 2H2SO4
亚铁离子经氧化亚铁杆菌作用,生成三价铁离子:
2FeSO4 + O2 + H2SO4—→ Fe2(SO4) 3 + H2O
以后的FeS2靠Fe2(SO4) 3氧化成三价铁离子:
Fe2(SO4) 3 + FeS2 —→ 3FeSO4 + 2S
生产的硫磺经氧化硫酸杆菌作用转化为硫酸:
氧化硫酸杆菌
↓
2S+ H2O+ O2 —→H2SO4
这种方法生产PFS,所采用的原料来源广,生产设备简单,成本较低;无需高温高压和消毒催化剂,生产中无任何毒副作用。其不足之处是产品中亚铁离子含量较高,影响净水效果,此种工艺目前还未普遍使用。
(8)一步合成法:一步合成法是将双氧水、氯酸钾等氧化剂溶于碱性或中性含钾化合物中制成氧化剂溶液;在沸点温度下控制pH值,加热搅拌FeSO4悬浮液, 制成一定浓度的FeSO4溶液;将制备的氧化剂溶液加入到FeSO4溶液中,可制得粒径0.2~0.7nm的固体PFS[13]。
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
1.3 研究开发意义
聚合硫酸铁在水中能产生高效聚合铁络离子,与类似的其它净水剂相比,用量少、成本低、效果好。[www.61k.com]目前已广泛用于原水净化,污水处理,油水分离,废银回收,以及医药、制革、制糖、 酿酒等行业的废水净化处理,聚铁生产方法有磁铁矿法、硫酸亚铁法、废铁屑法、钢铁厂废酸法、硫酸厂硫铁矿渣法等[14]。南京油脂化工厂、武钢供水厂、成都化工三厂、鞍钢给排水公司、山东滕州净水剂厂等是主生产厂。近年国内对聚铁的研究开发取得很大进展 ,用硫铁矿渣为原料,用常压低温焙烧工艺制聚铁已成功;用钛白粉厂副产硫酸亚铁一步法制固体聚铁产品的新技术,是国家建设部、环保总局的重点科技推广成果。聚铁有强大市场竞争力,开发应用前景广阔[15]。
目前我国一般以副产绿矾为原料采用亚硝酸钠催化氧化生产PFS。生产液体PFS时,由于液体PFS铁含量低、黏度大、干燥温度低、干燥时间长,能耗大。因此,生产过程中应控制和消除污染,改进技术手段,降低能耗。开发新技术,研制新产品高效价廉的絮凝剂是使絮凝剂得以广泛应用的关键 ,它已成为我国“十五”水处理剂的发展规划[16,17]。研究生产PFS高新技术和及PFS新产品具有重要的意义。
61阅读请您转载分享:
本实验将采用直接氧化法制备液态聚合硫酸铁。液态聚合硫酸铁可以直接应用到水处理中,而且还减少了由液态干燥到固态所产生的能耗通。实验中,通过正交实验,研究出最佳制备工艺,以解决液态聚合硫酸铁铁含量低不稳定等问题。
二、实验部分
2.1 实验材料与仪器
2.1.1 实验药品(表1)
实验中所采用的药品与材料如表1所示。
表1 实验药品和材料
Table 1 Reagents and materials
实验药品
重铬酸钾
二苯胺磺酸钠
磷酸
氟化钠
氯酸钾
硫酸亚铁
规格 AR AR AR AR AR AR 生产厂家 长沙分路口塑料化工厂 长沙分路口塑料化工厂 天津市大茂化学试剂厂 天津市大茂化学试剂厂 上海山浦化工有限公司 株洲市化学工业研究所
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
盐酸
浓硫酸
氢氧化钠
2.1.2 主要仪器设备(表2) AR AR AR 湖南省株洲市化学工业研究所 国药集团化学试剂有限公司 上海山浦化工有限公司
表2 实验仪器和设备
Table 2 Apparatus and equipment
仪器、设备名称
FN121-2型鼓风干燥箱 生产厂家 长沙仪器仪表厂
组合恒温磁力搅拌器 山东省鄄城新科教学仪器厂 PHS-3C型精密pH计
分析天平
恒温水浴锅 海鹏顺科学仪器有限公司 梅特勒-托利多仪器上海有限公司 上海精宏实验设备有限公司
2.2 实验方法
2.2.1 液态聚合硫酸铁的制备
实验中按总SO42-:总Fe比例计算加入浓硫酸量。(www.61k.com]在烧杯中加入100ml水,再加入计算量浓硫酸配成稀溶液,加热到设计温度。再称取计算量的FeSO4·7H2O和KClO3(设计量)各分成24份,在搅拌下分别将2份FeSO4·7H2O和两份KClO3加入到上述烧杯中,搅拌10min继续加入1份FeSO4·7H2O和一份KClO3,以后每隔设计时间(2,5,8min)加1次,共计加料22次,投料结束后,继续搅拌10min,冷却即可。
2.2.2 PH值的测定
将洗净收干的电极插入待测溶液,测定PH值,所得结果应表示至一位小数,两次测定结果之差不大于0.2PH值单位取算术平均值为测定结果[18]。
2.2.3 盐基度测定
分析试样10ml于250ml锥形瓶中,取25ml0.1mol/L盐酸溶液,加入上述被测溶液中,在50度水浴中加热10分钟,流水冷却至室温,加入饱和氟化钠溶液70ml,再放置半小时后,过滤除去沉淀,用1.5%氟化钠溶液将沉淀物洗2—3次。然后在滤液中加3滴0.1%酚酞指示剂溶液,立即用0.1mol/L氢氧化钠标准溶液滴定至终点,同时作一空白平行试验对照[20]。
2.2.4 二价铁含量的测定
用10ml移液管吸取分析试样10ml于500ml锥形瓶中,加蒸馏水200ml稀释
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
之,加硫磷混酸溶液20至25ml,再加5滴二苯胺磺酸钠溶液作指示剂[21]。[www.61k.com)立即用0.1mol/L重铬酸钾标准溶液滴定由无色转变成绿色再成紫色即为终点,记下消耗毫升数。
2.2.5 密度测定
将适量的待测液体注入干燥清洁的250ml量筒中,搅拌均匀后,拿住密度计上端,使它轻轻浮在液中,切莫让液体粘附到露出部分,使密度计处于量筒中心悬浮,按弯月面上缘进行读数(眼睛与弯月面上缘平行)。
三、结果与讨论
3.1 工艺条件对盐基度的影响
3.1.1 聚合硫酸铁制备原理
制备聚合硫酸铁的含铁原料较为广泛,制备方法多种多样,可以废硫酸和铁屑为原料进行生产,其中以硫酸亚铁为原料的聚合硫酸铁不含重金属离子,可用于饮用水处理,其反应方程式如下:
氧化 6FeSO4 + KClO3 + 3H2SO4 —→ 3Fe2(SO4)3 + KCl + 3H2O
水解 Fe2(SO4)3 + nH2O —→ Fe2(OH)n(SO4)3- n/2 + n/2H2SO4
聚合 mFe2(OH)n(SO4)3- n/ 2 —→ [Fe2(OH)n(SO4)3- n/ 2]m
聚合硫酸铁的性能取决于总铁质量分数和盐基度,尤其是盐基度。盐基度越高,说明聚合度越大,混凝性能越好。制备时加硫酸有利于氧化反应的进行,可使Fe2+转化完全。溶液中的SO42-和 HSO4-形成缓冲体系能保持溶液pH值的相对稳定,SO42-向HSO4-转化也会促进Fe3+的水解。硫酸用量对产品的盐基度和总铁质量分数有很大影响,随着硫酸用量的增加,Fe2(SO4)3 的生成速率增加,有利于单体 Fe2(OH)n(SO4)3- n / 2的生成,提高了聚合反应速率,铁结合的羟基数增加,盐基度也随之增大[22]。但当硫酸用量增加到一定程度时,也会抑制水解反应的发生,不利于聚合反应,甚至使聚合硫酸铁发生分解,盐基度下降。氧化反应是不可逆过程,反应速度较快,而水解和聚合反应均为可逆过程。当氧化剂用量少时,Fe2(SO4)3 生成量少,不利于Fe2(OH)n(SO4)3- n / 2 的单体生成,因而盐基度小。
本实验研究了不同温度和物料配比条件下聚合硫酸铁的合成工艺[23] 。对制备的聚合硫酸铁进行质量检验和絮凝效果测试,从中得出制备聚合硫酸铁的最佳工艺条件。
3.1.2 物料比对聚合硫酸铁盐基度的影响
在常温下,当酸度值和氧化剂投入量都相同时,改变物料比能提高反应速率
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
并且能得到更高品质的聚合硫酸铁。(www.61k.com)当物料比(硫酸亚铁与硫酸的摩尔比)分别为:1/1.20,1/1.25,1/1.30,1/1.35,1/1.40,1/1.45,1/1.50时,聚合硫酸铁的盐基度B(%)为11.8,12.3,11.6,11.2,12.1,12.5,12.1,结果见图1。
由图1可见,当物料比为1/1.25和1/1.45时盐基度最高,实际生产中考虑到成本节约等问题,当投料比为1/1.45时,加入的硫酸亚铁过多,成本过高。综合考虑实际投料比为1/1.25左右最佳。
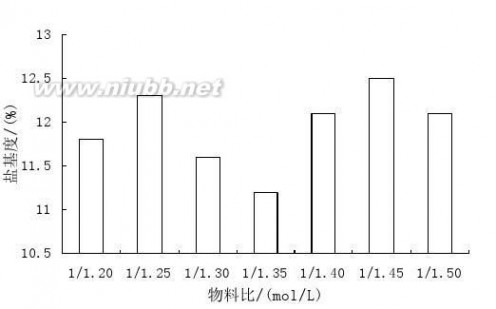
图1 物料比对盐基度的影响
Fig.1 The effect of material ratio on the basicity
3.1.3 温度对聚合硫酸铁盐基度的影响
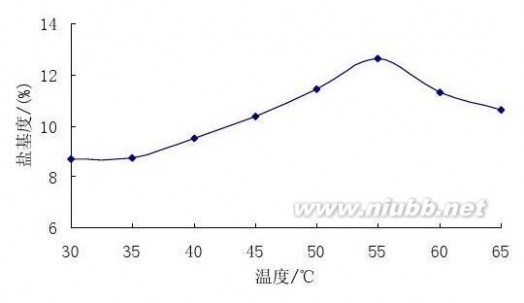
对于大多数化学反应来说 ,当反应物浓度不变时,加热能提高反应速率。实验结果表明,在其他条件不变的情况下,当反应温度(℃)分别为30,35, 40,45,50 ,55,60和65时,聚合硫酸铁的盐基度B(%)分别为8.7,8.8,9.7, 10.2, 11.9, 13, 11.4和10.8。由此可知,聚合硫酸铁盐基度随反应温度的升高而升高,当反应温度升至55℃时,聚合硫酸铁的盐基度已达到较高水平,继续升温盐基度变化幅度不大。由于本实验为放热反应,若温度过高,一方面会引起氧化剂部分分解,为了达到同样的效果,必将增加氧化剂用量;另一方面,温度高也会使聚合硫酸铁发生分解产生沉淀,降低絮凝能力。综合考虑,反应温度控制为55℃左右较适宜。
61阅读请您转载分享:
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
图2 反应温度对盐基度的影响 Fig.2 The effect of temperature on the basicity
3.1.4 酸度对聚合硫酸铁盐基度的影响
在常温常压下,pH为 1.5,2.0, 2.5,3.0,3.5,4.0,其他因素相同情况下,聚合硫酸铁的盐基度分别为8.7,10.2,12.1,12.8,12.0,11.8,结果见图3。(www.61k.com)
由图3可知,随着pH的增大,盐基度呈下降趋势。原因是在水解过程中,氢氧根离子和硫酸根离子与铁离子的配合是竞争关系,SO42-少时,较多的氢氧根离子结合铁离子,使得产物盐基度较高,而硫酸根离子过量,生成物已经成为 Fe2(SO4)3,并非PFS。在保证产品质量合格及一定反应速度的前提下,浓 H2SO4的最佳用量为4.3mL, pH为2.5到3时,硫酸亚铁与硫酸的摩尔比为 1∶1.25,此时盐基度最高。
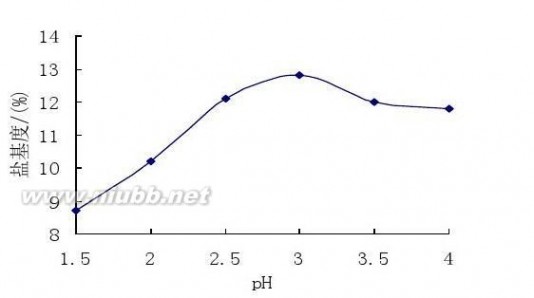
图3 pH对盐基度的影响
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
Fig.3 The effect of pH value on the the basicity
3.1.5 氧化剂加入速度对聚合硫酸铁盐基度的影响
氧化剂氯酸钾的加入速度直接影响反应效果,加入速度较慢,有利于物料的充分接触,但反应时间过长,加入太慢、太迟又易使 Fe2(SO4)3发生水解,产生沉淀,不利于工业化生产,实验过程中,尝试着加快加入速度,但使得还原性物质(以 Fe2+计)的含量明显增加,Fe2+的转化率无法达到国家标准,这是因为本反应是一个放热反应,加入速度过快,一则使得氯酸钾不能与物料充分接触,二则放热使温度升高,促使了氯酸钾的分解。(www.61k.com)故经过反复实验,认为控制在 2.5 h 之内连续均匀加入较好[25]。
3.1.6 氧化剂用量对聚合硫酸铁盐基度的影响
在常温常压下,加入定量的FeSO4?7H2O86g、浓H2SO4(98%)4mL、H2O100mL于烧瓶中,用慢慢加入3,6,9,12,14g不同量的KClO3,反应完后测其盐基度。结果见图4。
由于氯酸钾加入到硫酸亚铁溶液中,反应会放出大量的热,因此不可避免地要消耗一部分氯酸钾会分解。为此,氧化过程采用在低温下将过氧化氢慢慢地滴入,溶液的颜色逐渐加深。经过多次实验并由图3发现,当氯酸钾用量达6g,硫酸亚铁与氯酸钾的摩尔比为1:0.1时,生成的红棕色液体的颜色不再加深,说明Fe2+已基本被氧化,达到实验要求,继续增加氯酸钾用量,溶液体积增加,全铁含量降低。因此,选择硫酸亚铁与过氯酸钾的摩尔比为1:0.1。
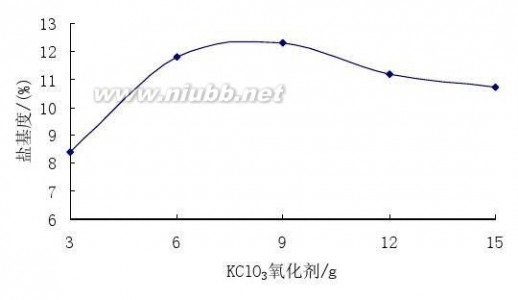
图4 氧化剂对盐基度的影响
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
Fig.4 The effect of oxidants on the the basicity
3.1.7 聚合反应时间对聚合硫酸铁盐基度的影响
从图5可知,反应时间对聚合硫酸铁的合成有很大的影响,反应时间越短,则聚合反应不完全,产品的聚合度低,盐基度小;聚合度与絮凝效果的好坏有密切的关系,聚合度越大,其形成的矾花越大,絮凝效果越好[26]。(www.61k.com]但时间过长,盐基度反而略有下降,并且增加了生产成本。通过实验确定反应时间为2.5 h。
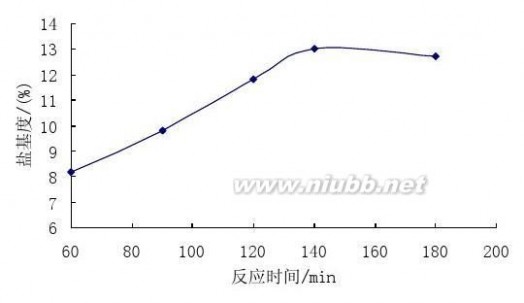
图5 反应时间对盐基度的影响
Fig.5 The effect of time on the basicity
3.1.8 聚合硫酸铁经过熟化后盐基度的变化
在上述各最佳条件下,将制得聚合硫酸铁静置熟化,当静置熟化时间(h)分别为0,24,48和72时,聚合硫酸铁的盐基度( %)分别为12.4,12.1,11.8,11.8和11.7由此可知,随着聚合硫酸铁静置熟化的时间越长,盐基度呈下降的趋势,但总体下降幅度不是很大;存放48h后,其盐基度已基本趋于稳定。
因此如图6,在分析聚合硫酸铁的盐基度时,反应结束就马上分析会造成结果略微偏高,存放48h后可基本达到稳定。这是由于水解聚合反应并非瞬间完成,在相当时间内,溶液均处于非平衡介稳状态。在此熟化期内,随着反应进行,水解产物形态组成也不断变化,溶液pH值也相应变化,因而出现盐基度随时间发生变化的现象。
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
图6 熟化时间对盐基度的影响
Fig.6 The e ffect of aging time on the basicity
四、小结
本实验采用氯酸钾直接氧化法制取聚合硫酸铁,工艺方法简单,生产周期短,反应条件温和。[www.61k.com)制得符合标准的产品所需反应的较佳条件如下:硫酸根离子浓度与三价铁离子浓度比值为1.25,硫酸亚铁与氯酸钾的摩尔比为1:0.1,反应温度55,反应时间为2.5h,反应2.5h,可获得较高盐基度,产品呈红褐色粘稠状液体,产品存放48h基本稳定。
参考文献
[1] 陈永泉,何小金,曹玉宇等.复合聚合硫酸铁反应动力学研究[J].能源环境保
护,2007,4(21):43-46.
[2] 刘长让,樊耀亭,刘相中,聚合硫酸铁的制备与应用[J].无机盐工业,2008,31(5):18-20.
[3] 张良佺,黄校华,余新峰等.助聚剂对聚合硫酸铁盐基度影响研究[J].化学反应工程与工
艺,2007,2(18):180-183.
[4] 劳服司,冉年海,李伯涵.聚合硫酸铁的开发[J].卢天化科技,2010,4:231-233.
[5] 陈明尧,吴华秀等.聚合硫酸铁的制备[J].化工时刊,2007,18(1):57-58
[6] 向群,聚合硫酸铁的制备[J].四川师范大学学报,2008,20(1):101-103.
[7] 诸爱士,吴盛林,倪文赋等.聚合硫酸铁改性研究[J].实验室研究与探
索,2006,2(23):12-14.
[8] 马忠英.我国混凝剂聚合硫酸铁生产技术发展现状[J].内蒙古石油化
工,2007,8:300-302.
[9] 潘碌亭,吴锦峰.聚合硫酸铁制备技术的研究与进展[J].工业水处理,2009,9(29):1-5.
[10] 周洪涛,李东,孟繁会,生物法制备聚合硫酸铁及盐基度对聚合硫酸铁性能的影响[J].

61阅读请您转载分享:
聚合硫酸铁 聚合硫酸铁,液体聚合硫酸铁
热电技术,2007,21(4):26-3.
[11] 武道吉,陈冬辰,李凤亭.国外制造聚合硫酸铁的新方法化[J].化工环
保,2008,5(17):277-280.
[12] 李微雅.聚合硫酸铁的合成与应用[J].印染助剂,2007,1(24):10-12.
[13] 许立国, 李凤亭,任晓红.聚合硫酸铁生产心方法[J].山东电力技
术,2009,1(87):55-57.
[14] 郑怀礼,童腾锐,袁宗宣.聚合硫酸铁制备方法研究及其发展[J].环境污染与治理技术
与设备,2008,1(5):21-28.
[15] 黄宝华,潘湛昌,余倩,张小琴,杨迟.聚合硫酸铁制备及其净水处理应用[J].城市环境
与城市生态,2007,16(6):226-227
[16] 张月仙.聚合硫酸铁制备研究[J].河北北方学院学报(自然科学
版),2009,1(21):11-13.
[17] 朱洪法.精细化工产品配方与制造[M].北京:金盾出版社,2009,136.
[18] 郭强,杨杰,司捷.一种聚合硫酸铁合成的新方法[J].企业科技与发展,2007,37.
[19] 洪金德,朱钰.影响聚合硫酸铁盐基度因素分析[J].华侨大学学报(自然科学
版),2006,4(26):415-417.
[20] 张清一,庞脆玲,欧阳欢.聚合硫酸铁合成及影响因素的研究[J].四川有色金
属,2007,4:53-56.
[21] 吴烈善,李楠,伍敏莉等.固体聚合硫酸铁制备及处理选矿废水的研究[J].广西大学学
报(自然科学版),2009,1(34):63-66.
[22] 郭薇薇,周锦,柳亚军.新型聚合硫酸铁的制备[J].甘肃科技,2006,4(22):41-43.
[23] 王汉道,李宗林,沙育定等.自制聚合硫酸铁处理高色度印染废水的实验研究[J].广东
轻工职业技术学院学报,2004,1(3):9-11.
[24] 周熊,郑永华.聚合硫酸铁的新型合成[J].胶体与聚合物,2006,1(24):31-32.
[25] 邹龙生,杨春华.直接氧化法制备改性聚合硫酸铁的工艺探讨[J].山东化
工,2007(36):30-35.
[26] 伦宁,李景国,王信东.聚合硫酸铁的制备及稳定性研究[J].山东化工,2010,(2):5-6.
61阅读请您转载分享:
三 : 聚合硫酸铁:聚合硫酸铁-基本内容,聚合硫酸铁-性能指标
本文标题:聚合硫酸铁-聚合硫酸铁,液体聚合硫酸铁61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1