一 : 双氧水含量如何测定?
双氧水含量如何测定?
高锰酸钾滴定
用滴瓶以减量法对三种规格的产品称量如下:27.5 %规格的产品,称量约0.15-0.20g的试样;35%规格的产品,称量约0.12-0.16 g的试样;50%规格的产品,称量约0.10-0.12 g的试样,精确到0.0002 g .置于一盛有100m L硫酸溶液(1:15)的250m L锥形瓶中,用高锰酸钾标准溶液(c(1/5KMnO4)=0.1mol/L)滴定至溶液呈粉红色,并在30s 内不消失即为终点.
X=1.70V.c/m

二 : 分析化学实验 过氧化氢含量的测定 实验报告
实 验 报 告
姓名: 班级: 同组人: 项目 过氧化氢含量的测定 课程: 分析化学 学号:
一、实验目的
1. 了解高锰酸钾标准溶液的配制方法和保存条件。(www.61k.com)
2. 掌握以Na2C2O4为基准物标定高锰酸钾溶液浓度的方法原理及滴定条件。
3. 掌握用高锰酸钾法测定过氧化氢含量的原理和方法。
二、实验原理
标定高锰酸钾溶液的基准物质有H2C2O4·2H2O、Na2C2O4、FeSO4·7H2O、(NH4)2SO4·6H2O、As2O3和纯铁丝等。由于前两者较易纯化,所以在标定高锰酸钾时经常采用。
本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L的高锰酸钾溶液,两者反应方程式如下:2KMnO4+5Na2C2O4+8H2SO4===2MnSO4+8H2O+10CO2↑+5Na2SO4+K2SO4
H2O2是一种常用的消毒剂,在医药上使用较为广泛。在酸性条件下,可用KMnO4标准溶液直接测定H2O2,其反应如下:2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O
此反应可在室温下进行。开始时反应速度较慢,随着Mn的产生反应速度会逐渐加快。因为H2O2不稳定,反应不能加热,滴定时的速度仍不能太快。测定时,移取一定体积H2O2的稀释液,用KMnO4标准溶液滴定至终点,根据KMnO4溶液的浓度和所消耗的体积,计算H2O2的含量。
注:1.用KMnO4溶液滴定H2O2时,不能用HNO3或HCl来控制溶液酸度。
2.H2O2样品若系工业产品,常加入少量乙酰苯胺等稳定剂,这时会造成误差,可改用碘量法测定。
三、仪器和药品
仪器:电子天平、称量瓶、50mL酸式滴定管、10、25、50mL移液管、
50mL量筒、电炉、2 mL刻度吸管、250mL容量瓶
试剂: 3mol·L-1 H2SO4 、0.02 mol·L-1 KMnO4 标准溶液、Na2C2O4、
过氧化氢样品(质量分数约为30%)
四、内容及步骤
1、0.02 mo·L-1 KMnO4溶液的配制
用台秤称取约1.7g KMnO4溶于500 mL水中,盖上表面皿,加热煮沸1h,煮时及时补充水。静置一周后,用玻璃砂芯漏斗过滤,保存于棕色瓶中待标定。
2、KMnO4溶液浓度的标定
准确称取0.15~0.20g Na2C2O4基准物质于250mL锥形瓶中,加水约20mL使之溶解,再加10mL3mol·L的H2SO4溶液,并加热至75~85℃,立即用待标定的KMnO4溶液滴定,滴至溶液呈淡红色并经30s不褪色,即为终点。平行测定3次,根据滴定所消耗KMnO4溶液体积和基准物的质量,计算KMnO4溶液的浓度。
-12+
分析化学实验小结 分析化学实验 过氧化氢含量的测定 实验报告
3、样品的测定
用移液管吸取市售的过氧化氢样品(质量分数约为30%)2 mL,置于250mL容量瓶中,加水稀释至标线,充分混合均匀。(www.61k.com]
再吸取稀释液25.00mL,置于250mL锥形瓶中,20~30mL水和3 mol·L-1H2SO410mL,用KMnO4标准溶液滴定至溶液呈粉红色并经30s不褪色,即为终点。根据KMnO4标准溶液用量,计算未经稀释的样品中H2O2的质量浓度(用g·mL表示) 五、实验结果记录与计算
溶液浓度的标定
-1
2、过氧化氢的含量的测定
六、思考题:
1.用Na2C2O4标定KMnO4溶液浓度时,酸度过高或过低有无影响?溶液的温度过高或过低有什么影响?
2.用KMnO4法测定H2O2时,为什么不能用HNO3或HCl来控制溶液的酸度?
教师评语: 年 月 日
三 : 某化工厂排放的废水中含有一定量的氢氧化钾,为了回收
某化工 |
(1 )配制2% 的稀盐酸的质量为 |
考点:
考点名称:关于溶液的计算溶质质量分数: =
=
 ×100%
×100% 。
。 影响溶质质量分数的因素:
影响溶质质量分数的因素: ×100%
×100% | 方法 | 计算依据 | 计算公式 | |
| 溶液的稀释 | ①加水稀释 ②加稀溶液稀释 | ①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时。稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 | 加水稀释:稀释前后溶液中溶质的质量不变 m浓×ω浓%=(m浓+m水)×ω稀% |
| 溶液的浓缩 | ①添加溶质 ②蒸发溶剂 ③加入浓溶液 | ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 | 蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀% |
 ×100g]可推导出:
×100g]可推导出: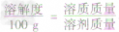 ,
,
| 溶解度 | 溶质质量分数 | |
| 意义 | 物质溶解性的量度,受外界温度的影响 | 表示溶液中溶质质量的多少,不受外界条件影响 |
| 容积要求 | 100g | 无要求 |
| 温度要求 | 与温度有关 | 一般与温度无关 |
| 溶液是否饱和 | 一定达到饱和 | 不一定饱和 |
| 计算公式 |  ×100g ×100g |  |
| 单位 | 克 | 无单位 |
| 联系 | 饱和溶液中溶质的质量分数= | |
 ×100%
×100% 。
。61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1